НАЧИНАЮЩЕМУ ХИМИКУ
Девять уроков пиротехники
(автор неизвестен)

Этот спецкурс учит школьников теоретически предсказывать горючие и взрывчатые свойства индивидуальных веществ и их смесей. Конечно, любой праведный учитель может этим возмутиться, но ведь не секрет, что большинство ребят, интересующихся химией, что-нибудь, да взрывают. Так, может быть лучше объяснить, как сделать такие опыты безопасными и красивыми? (Ведь не зря же во всем мире признали: чем пугать старшеклассников внебрачными связями, лучше научить их пользоваться противозачаточными средствами.) Тем более что, для простейшей оценки горючих и взрывчатых свойств веществ достаточно элементарных химических знаний.
Предположим, вы раздобыли кусок магния или магниевого сплава, зажали его в тисках и начали работать напильником. Вниз летят серебристые стружки. Вы предвкушаете, как смешаете их и подожжете. Но вот напильник случайно задевает тиски, высекаются искры. По кучке магниевых опилок пробегает волна бело-розового света, и… вам придется сильно пожалеть о своей любви к химии (если, конечно, вы заранее не позаботились об огнетушителе).
— Ну это уж слишком! — скажете вы, если недавно зажигали магниевую стружку. — Нам это удалось с таким трудом!
Да, но вспомните, что мелкий порошок куда менее активного железа или никеля обладает пирофорными свойствами (самовоспламеняется на воздухе). Так что, если и удивляться, то тому, что свеженапиленный магний обычно успевает дождаться, пока вы его с чем-то смешаете.
Еще стандартный случай из жизни любителей огня и взрывов. Вы раздобыли и опробовали состав искристой свечи ("бенгальского огня"), а потом решили его усовершенствовать — сделать, например, пламя голубым или сине-зеленым. Вы уже знаете, что стоит примешать галогениды меди, и огонь будет именно такого цвета. Поэтому вы добавляете немного хлорной меди к смеси нитратов, чугунных и алюминиевых опилок. И вот у вас в руках полная спичечная коробка нового искристого состава. Но она почему-то горячая. Вы слышите легкое шипение и отбрасываете коробку подальше, в безопасное место. Ну, а теперь представьте, что приготовленную смесь вы успели спрятать в любимый ящик под кроватью, где хранятся другие смеси, ракеты и взрывпакеты…
А ведь всего-то надо было вспомнить про железный гвоздь в растворе медного купороса, про то, что полностью обезводить кристаллогидрат хлорной меди обычно невозможно, да про то, что большинство реакций сопровождается выделением тепла.
Кстати, о тепле. Это весьма важное понятие. Горючие и взрывчатые свойства веществ и их смесей можно оценить, рассматривая только тепловой эффект и механическую работу реакции — изменение энтальпии данной химической системы. Есть специальные таблицы, в которых собраны стандартные энтальпии образования химических соединений. По определению, энтальпия (ее еще называют теплосодержанием) — это теплота, поглощенная системой в процессе реакции, плюс механическая работа, совершенная системой против внешних сил при постоянном давлении. Для расчетов полезна стандартная энтальпия образования Н°298. Ее вычисляют для химических реакций (иногда даже гипотетических), в которых соединения получают при 25 °C и 1 атмосфере из простых веществ. У простых веществ в наиболее устойчивой форме (при данных стандартных условиях) принято нулевое значение энтальпии.
Пример 1.
Для жидкой ртути при 25 °C и 1 атм. Н°298 = 0; для паров ртути в тех же условиях Н°298 = 60,8 кДж/моль. Положительная Н°298 означает, что, испаряясь, ртуть поглощает энергию.
Пример 2.
Для реакций:
Н2(г) + 1/2О (г) = Н2О (г)
ΔН°298 = -242 кДж/моль;
Н2(г) + 1/2О (г) = Н2О (ж)
ΔН°298 = -286 кДж/моль;
Эти величины — табличные значения энтальпии образования воды. На их основе можно сделать вывод, что при конденсации паров воды (стандартные условия):
Н2О (г)-> Н2О (ж) выделится 44 кДж/моль тепла.
Изменение энтальпии здесь, как и в случае любой химической реакции, равно алгебраической разности стандартных энтальпии образования продуктов и исходных веществ.
Теперь вернемся к "взрывчатой" теме. Мы не будем рассматривать синтез и свойства индивидуальных ВВ (тротила, гексогена, гремучей ртути и тому подобного). Красивые и, если очень хочется, громкие эффекты можно получить, пользуясь пиротехническими смесями, которые состоят из горючего и окислителя с различными добавками. Однако прежде чем смешивать, надо оценить, насколько безопасным будет продукт. Для простейшей оценки мы будем учитывать только тепловые эффекты возможных реакций.
Большинство пиротехнических составов — это стехиометрическая смесь горючего и окислителя. Часто они способны гореть без доступа воздуха.
Пиротехнические смеси должны быть:
1 — стойкими при длительном хранении;
2 — минимально чувствительными к механическим воздействиям (не загораться при случайном трении или ударе);
3 — не слишком легко воспламеняемыми (обычно температура зажигания не менее 200 °C);
4 — не взрывчатыми (то есть горение не должно переходить в детонацию);
5 — минимально токсичными (не содержать солей ртути, кадмия, таллия и тому подобного);
6 — максимально однородными, сгорать равномерно с определенной скоростью).
Возможно, вам покажется странным, что дальше я буду рассказывать и о весьма экзотических веществах. Однако мне хорошо известно, как в нынешних условиях всеобщего разгильдяйства в руки юных химиков попадают самые невероятные реагенты, причем свойства многих из них в доступной литературе не описаны. К сожалению, происходит все больше случаев, когда неграмотное обращение с химическими продуктами, "найденными" в районе оборонных заводов, кончалось трагически.
Красивые и, если очень хочется, громкие эффекты можно получить с помощью пиротехнических составов. Но прежде чем что-то смешивать и поджигать, надо прикинуть, какими могут быть последствия.
В прошлый раз мы уже говорили о том, что пиротехнические смеси состоят из горючего (то есть восстановителя) и окислителя. Горючим в пиротехнике могут быть самые разные вещества — от древесных опилок до порошка вольфрама. Но с очень мелкими металлическими порошками надо обращаться с особой осторожностью: ведь они часто сами по себе воспламеняются.
Порошок неизвестного металла, о котором вы знаете лишь то, что он "вот только с завода и здорово горит", может причинить большие неприятности. Вы обязательно должны знать состав металла или сплава, с которыми собираетесь химичить. Конечно, безопаснее работать с крупными (диаметром не меньше 0,1 мм) металлическими опилками, пролежавшими несколько дней на воздухе.
Фосфор — весьма опасное горючее вещество. Лучше не использовать его в самодельных смесях. И вообще избегайте любых контактов с белым фосфором (яд)!
В качестве окислителей для пиротехнических смесей тоже годны самые разнообразные соединения — от бертолетовой соли до гипса и гексахлорэтана. Так вот, расчет по термохимическим уравнениям нужен именно для прогноза поведения окислителя в смеси. Дело в том, что некоторые окислители способны и без горючего распадаться с выделением тепла. Причем они могут не только загореться, но и сдетонировать. Смеси таких окислителей с восстановителями обладают повышенной чувствительностью к трению и удару. Конечно, чтобы точно предсказать способность смеси к детонации, надо проанализировать все кинетические параметры системы (энтропийный фактор, энергию активации, автокатализ и тому подобное). Но главное, что окислители, неспособные к экзотермическому разложению, практически не детонируют.
Уточним терминологию. При горении выделяющаяся в зоне реакции теплота передается от слоя к слою за счет теплопроводности. Поэтому зона горения распространяется со скоростью от нескольких миллиметров до нескольких метров в секунду. При детонации же химическая реакция распространяется волною сжатия (ударной волной) со скоростью до нескольких километров в секунду.
Попробуем предсказать опасность неизвестного вам окислителя на примере нитрата аммония. Это удобрение иногда взрывается, особенно если мощный детонатор действует на большую массу слежавшегося NH4NО3 и тепловые эффекты возможных реакций распада:
1. NH4NO3 = N2О + 2Н2О
2. NH4NO3 = 0,5NО2 + 0,75N2 + 2Н2О
3. NH4NO3 = N2 + 2Н2О + 0,5СО2
1. Необходимые данные: Δ Н°298 кДж/моль
NH4NO3 = -365
N2О (г) = -242
N2О = +82
СО2 (г) = +34
Пример расчета первой реакции:
ΔН°298 реакции = (сумма ΔН°298 продуктов) — (сумма ΔН°298 исходных веществ)
Или ΔН°298 = (+ 82 — 2∙242) — (-365) = -37 кДж.
Аналогично, для второй реакции (2) получаем —102 кДж, для третьей (3) —119 кДж на 1 моль исходного нитрата аммония. Из расчетов видно, что чем больше в продуктах реакции кислорода и азота, тем больше тепла выделяется при разложении. Оно и понятно: ведь у простых веществ ΔН°298 по определению равно нулю, а оксиды азота эндотермичны.
А теперь давайте познакомимся с основными свойствами некоторых окислителей, тех, что чаще всего используют пиротехники (табл. 1). Для дальнейших расчетов вам поможет таблица 2.
Всем известная бертолетова соль разлагается в присутствии катализатора(Мп02). Реакция слабо экзотермична:
КСlO3 = КСl + 1,5O2 — 389–437; ΔН°298 = -48 кДж.
Но смеси с хлоратом калия чувствительны к трению и удару, поэтому сейчас эту соль в пиротехнике не применяют. А вот в производстве спичек как раз и нужна механическая чувствительность смесей хлората с восстановителями.
Вы, наверное, заметили, что в таблицах не упоминается любимый "дворовыми пиротехниками" перманганат калия. Распад этой соли также экзотермичен:
2КМnO4 = К2МnO4 + МnО2 + O2
ΔН°298 = 2°(-834) -1180 -522 = -34 кДж
Но на скорость реакции влияет автокатализ — ускорение реакции продуктами распада. Поэтому смеси с перманганатом горят неустойчиво, часто самовоспламеняются. Не используйте "марганцовку" в самодельных смесях, а если уже намешали, не храните эти смеси долго!
Пользуясь таблицами 1 и 2, вы сами можете определить тепловые эффекты реакций окислителей с различными горючими. Из перечисленных окислителей наиболее опасны нитрат и перхлорат аммония. Интересно, что смеси с аммониевыми солями обычно горят медленнее, чем аналогичные с солями калия и натрия.
Таблица 1. Свойства окислителей
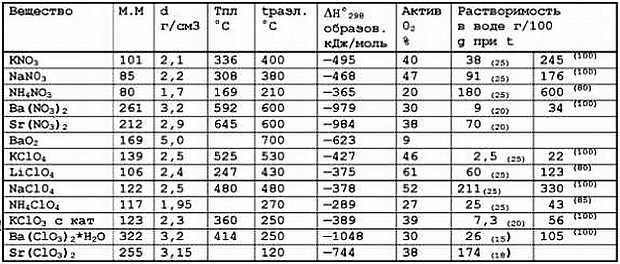
Примечания:
а) указана минимальная из найденных в справочниках температура разложения;
б) процентное содержание активного кислорода указано для реакции с малоактивными горючими;
в) температура, при которой измерена растворимость, указана над ее значением.
Таблица 2. Стандартные энтальпии образования

Термохимический расчет показывает, что для таких горючих, как Mg или Al, окислителями могут быть почти любые соли кислородсодержащих кислот или оксиды:
BaSO4 + 4Mg = BaS + 4MgO; ΔН°298 = -1405 кДж
Fe2O3 + 2Al = Al2O3 + 2Fe; ΔН°298 = -854 кДж
Кроме того, поскольку образование 1 моль оксида магния энергетически более выгодно, чем 1 моль оксида натрия или калия, смесь нитрата щелочного металла с избытком магния должна давать при горении пары щелочного металла:
К2O + Mg = MgO + 2К; ΔН°298 = -240 кДж
KNO3 + 3Mg = К + 0,5N2 + 3MgO; ΔН°298 = -1311 кДж.
Значит, чтобы правильно рассчитать состав новой пиротехнической смеси, необходима элементарная термохимическая проверка уравнения реакции, положенного в основу расчета. На основании табличных данных легко показать, что для смесей нитратов натрия и калия с магнием в правой части уравнения нужно записывать свободные щелочные металлы. Если же в качестве окислителей вы возьмете перхлораты, то процесс разложения остановится на хлоридах щелочных металлов.
Итак, уважаемые читатели, у нас появилась возможность предсказать для еще не приготовленной смеси, загорится ли она. Можно даже оценить, насколько горячим будет наше теоретическое пламя. Между тем, термохимический расчет не поможет оценить скорость реакции горения. Однако это часто необходимо.
Итак, уважаемые читатели, у нас появилась возможность предсказать для еще не приготовленной смеси, загорится ли она. Можно даже оценить, насколько горячим будет наше теоретическое пламя. Между тем термохимический расчет не поможет оценить скорость реакции горения. Здесь теория работает гораздо хуже. Например, перед полетами "Шатла" и "Бурана" ученые много лет исследовали очень сложный процесс взаимодействия водорода с кислородом, который включает множество стадий и промежуточных продуктов. Даже современные компьютеры не позволят провести полный кинетический расчет (т. е. расчет скорости реакции) в известной почти полтора тысячелетия трехкомпонентной системе — черном порохе. Ведь при его сгорании получаются десятки стабильных и метастабильных продуктов (сравните с системой водород — кислород).
Но если вы задумали изготовить для модели ракеты твердое топливо по собственному рецепту, вам просто необходимо заранее прикинуть скорость горения смеси в рыхлом и спрессованном виде и, что очень важно, оценить зависимость скорости горения от давления. (Думаю, что, пользуясь уравнением реакции и газовыми законами, вы сумеете рассчитать объем продуктов сгорания на единицу объема смеси. От этого зависит главная характеристика ракетного топлива — удельный импульс тяги.)
Несколько экспериментов помогут понять, что происходит в пиротехнических смесях в момент зажигания. Для начала вам понадобятся весы, позволяющие взвешивать до 20 г с точностью 0,1 г (сделать их самому не очень трудно); ступка объемом 300–500 мл с пестиком (обязательно фарфоровые, чугунные использовать нельзя!); парафиновая или стеариновая свеча, нитрат калия, черный (то есть хорошо прокаленный) древесный уголь (только не из выброшенного противогаза или отработанного заводского фильтра: такой уголь выделяет все ранее поглощенные вредные вещества); "сухое горючее" — уротропин (гексаметилентетрамин). Сжигать образцы пиросмесей надо на несгораемой подставке — удобно использовать куски керамической облицовочной плитки. А хранить готовые пиротехнические смеси лучше в пластмассовой, а не стеклянной посуде.
Эксперимент 1. Медленно поднесите горящую спичку к свече и внимательно наблюдайте за фитилем. Парафин сначала расплавится, затем задымится — вы увидите туман его остывающих паров. Только после этого свеча загорится, то есть вспыхнут пары вокруг фитиля. Попробуйте теперь спичкой зажечь кусок парафина, лежащий на несгораемой подставке. Вам это не удастся до тех пор, пока уголек от сгоревшей спички не коснется капли расплава парафина.
Следовательно, твердый или жидкий парафин на воздухе не горит — горят его пары, которые выделяет тонкий, хорошо прогреваемый фитиль.
Эксперимент 2. Тщательно разотрите смесь нитрата калия (калиевой селитры) и древесного угля в соотношении 4:1 (2 г селитры и 0,5 г угля). Сначала разотрите в ступке уголь до исчезновения слегка поблескивающих крупинок, затем продолжайте растирание, добавляя по частям навеску селитры. Растирать нитрат и уголь вместе будет безопасно, если пестик со ступкой, уголь и селитра не содержат даже малейших следов перманганатов, перхлоратов, хлоратов и броматов; не допускаются удары, способные высечь искру. Чугунные ступки непригодны именно из-за искрения даже при слабых ударах. Нитрат калия во многих наших экспериментах можно заменить нитратом натрия (но не аммония!). Для этого, пользуясь таблицей 1 (см. предыдущее занятие), нужно пересчитать массу окислителя, исходя из содержания активного кислорода. Пример такого расчета: 2 г нитрата калия содержат 40 % или 0,8 г акт. [О]. Если оставить неизменной массу горючего (0,5 г угля), то потребуется масса нитрата натрия, содержащего 47 % акт. [О]: 0,8 г: 0,47= =1,7 г.
Теперь приготовьте около 2 г стехиометрической смеси нитрата с уротропином. Для расчета уравняйте реакцию:
(KNO3 + CH2)6N4 = К2O + СO2 + Н2O + N2.
Проверьте себя — после округления массы должны примерно соотноситься как 5:1. Начать растирать смесь удобнее с уротропина.
Насыпьте на несгораемую подставку конической кучкой диаметром 5–6 мм и высотой 2–3 мм немного смеси с углем.
Внимание! Образец для сжигания надо удалить от готовых смесей и реактивов минимум на 2 метра (я бы посоветовал всем начинающим пиротехникам особо обратить внимание на расстояние от места испытания до места хранения общей смеси. Поскольку эта основная ошибка новичка, и связанные с этим, ремонт квартиры и посещение больницы. Советую при экспериментах всегда держать наготове ведро воды.). Образец лучше поместить в хорошо проветриваемое место или под тягу. Рядом не должно быть горючих предметов (ваты, бумаги, тряпок)!
Медленно поднося сверху горящую спичку, подожгите смесь. Точно так подожгите такую же кучку смеси с уротропином. Затем возьмите по 0,5 г каждой из смесей и тщательно их перемешайте. А теперь попробуйте поджечь кучку "гибридной" смеси. В своем лабораторном журнале запишите составы смесей и характер их горения. Оставшиеся смеси высыпьте в банки с этикетками.
Внимание! У вас должно стать привычкой, что банки с пиротехническими смесями надо немедленно надписывать, причем не условными шифрами. Лучше наклеивать этикетки, где указан полный состав и дата изготовления.
Если вы растерли исходные смеси достаточно тщательно, то смесь с углем сгорела быстро, хотя и с трудом загорелась; в смеси с уротропином сначала мог загореться уротропин и даже почти весь сгореть до начала совместного горения с селитрой (слабое мало окрашенное пламя). "Гибридная" смесь загорелась легко и сгорела довольно быстро, хотя медленнее, чем смесь с углем. Теперь подумайте — какая может быть связь между экспериментами 1 и 2? От чего зависит способность смеси воспламеняться и скорость горения? Наши эксперименты показали, что основные реакции горения пиротехнических смесей протекают не в твердой, а в газовой фазе. Чтобы поджечь смесь селитры с углем, вам понадобилось сначала расплавить селитру. При этом в газокапельном слое над твердой смесью, образованном продуктами сгорания, жидкими микрокаплями оксида, нитрата и нитрита калия, идет быстрая реакция. А вот смесь с легко сублимирующимся уротропином загорается гораздо легче, но значительная часть тепла реакции расходуется на возгонку горючего — селитра плохо прогревается и медленно разлагается. Много тепла уносят и пары воды. "Гибридная" смесь сочетает легкость загорания уротропина и высокую теплоту горения углерода, поэтому горит достаточно быстро.
Общие выводы: реакция горения пиротехнической смеси обычно начинается в газовой или жидкой фазе; горение происходит в газовом или газокапельном слое у поверхности твердой смеси; скорость горения смеси определяется сочетанием процессов плавления, испарения, выделения тепла в зоне реакции, расходованием его на фазовые переходы и уносом энергии продуктами с высокой теплоемкостью (вода).
Попробуем разобраться, как влияют на скорость горения пиротехнических смесей различные физические факторы.
Эксперименты, в которых изменяли внешние газовые давления, показали, что скорость горения пиросмесей может довольно сильно зависеть от давления — с его увеличением все смеси горят быстрее. В то же время, если уменьшить давление до 1–0, 1 мм. рт. ст., то некоторые пиросмеси вообще перестанут гореть. Это подтверждает, что экзотермические процессы горения идут в основном в газовом (газокапельном) слое. Когда давление растет, зона высокой температуры придвигается к конденсированной фазе. Тому несколько причин, во- первых, увеличивается скорость реакций (ведь она пропорциональна, как вы помните, концентрациям реагентов), во-вторых, увеличивается теплопроводность газа. Когда же давление уменьшается, наблюдается противоположная картина.
Можно, таким образом, разделить процесс горения пиросмеси на эндотермические (идущие с поглощением тепла) стадии плавления, испарения и разложения окислителей (они происходят на поверхности твердой фазы) и экзотермические реакции в газокапельном слое.
Вполне очевидно, что:
1. Предварительно нагретые смеси могут гореть быстрее.
2. Лучшее измельчение ускоряет процессы.
3. Спрессованный (гранулированный) состав имеет меньшую поверхность и горит медленнее, но более равномерно, чем просто порошок.
К влиянию физических факторов можно отнести и то, что пиросмеси будут гореть медленнее, если добавить органические смолы, парафин, канифоль, уротропин, а также хлорид аммония. Эти вещества требуют дополнительной энергии на плавление и возгонку, а образующаяся при их сгорании вода (пар) обладает большой теплоемкостью, что снижает температуру газокапельного слоя. При этом температура может оказаться недостаточной для разложения окислителя, тогда смесь перестанет гореть.
К химическим факторам, влияющим на скорость горения, относятся индивидуальные свойства веществ, от которых зависят температура и теплота разложения окислителей, а также теплота сгорания горючего и теплоемкость продуктов реакции.
Разумеется, скорость горения зависит от соотношения компонентов в смеси и наличия катализаторов разложения окислителя.
Быстрее всего горят стехиометрические смеси, то есть смеси, приготовленные в соответствии с уравнением реакции. При этом, как мы говорили раньше, необходимо правильно выбрать уравнение, исходя из термохимических данных.
На практике почти не используют смеси, состоящие только из одного окислителя и одного горючего. Стехиометрическое соотношение тоже часто специально нарушается — во многих случаях необходим избыток горючего.
Учитывая, что главным праздником для пиротехников является Новый год и Рождество, рассмотрим роль компонентов в пиротехнической смеси на примере хорошо всем знакомой искристой свечи, которую традиционно и неправильно называют "бенгальский огонь". Искристая свеча — это стальная проволока диаметром 0,8–1,5 мм и длиной 15–25 см, на которую обычно наклеен следующий состав:
— чугунные опилки — 30 % (по массе);
— Ва(NO3)2 — 50 %;
— алюминий (пудра) — 6 %;
— декстрин (крахмал) — 14 %.
Стоит изменить соотношения или заменить один компонент на другой, как свеча будет гореть хуже. Проверим это экспериментально.
Эксперимент 3. Очень велик соблазн взять вместо чугунных опилок порошок железа (железо, восстановленное водородом), который есть в школьных химических кабинетах и наборе "Юный химик". Тем не менее напилите хотя бы 0,1 г чугуна и сравните с чистым железом. Высыпайте понемногу металлический порошок на пламя горящей свечи. А затем проделайте то же с чугунными опилками. Оказывается, чистое железо дает при горении тусклые красноватые искры, а чугун — яркие. К тому же искры от чугуна красиво ветвятся. Дело в том, что в чугуне растворен углерод.
Так что придется вам взяться за напильник. Кстати, хрупкий чугун превращается в опилки довольно легко.
Эксперимент 4. Следующая проблема — довольно дефицитный нитрат бария. Сразу хочется заменить его хотя бы нитратом калия. Попытаемся это сделать. Приготовьте смесь № 1 из 5 г нитрата бария и 3 г чугунных опилок; затем смесь № 2, пересчитанную по содержанию кислорода в окислителе, — 1,2 г нитрата калия и 1,0 чугунных опилок. Попробуйте, как во втором эксперименте (см. предыдущее занятие), поджечь образцы этих смесей. Вряд ли у вас это получится. Придется ввести в составы более легко воспламеняемое горючее. К смеси № 1 добавьте 1,4 г крахмала, а к смеси № 2–0,4 г. Тщательно перемешайте (старайтесь не перетирать изо всех сил — может получиться малоискрящаяся чугунная пыль) и снова попробуйте поджечь. Обратите внимание на характер горения. Смесь № 2 легче воспламеняется, но образует раскаленную каплю и почти не искрит. Это связано с тем, что оксид и пероксиды калия плавятся при температуре ниже 600 °C, карбонат — при 900 °C, а оксид бария — выше 2000 °C. В результате выделяющийся в смеси № 2 азот не может вытолкнуть частицы металла, прилипшие к расплаву калиевого оксида.
Наконец добавьте к смеси № 1 0,5 г алюминиевой пудры, к смеси № 2 — чуть меньше 0,2 г. Теперь обе смеси достаточно легко воспламеняются и интенсивно горят, но все равно искрят по-разному. Кстати, масса смеси № 2 не случайно взята небольшой — чтобы не переводить зря реактивы.
Но главный недостаток смеси с нитратом калия в следующем: когда она горит на проволоке, то получается жидкий шлак, капающий вниз, а это совершенно недопустимо.
Эксперимент 5. Чтобы нанести искристый состав на проволоку, лучше использовать не крахмал, а сравнительно низкомолекулярный декстрин с той же брутто-формулой — (C6H10O5)n. Получить его можно из крахмала. Насыпьте порошок крахмала на металлический лист, утрамбуйте до 1–1,5 мм и медленно нагрейте до потемнения и начала "плавления" (около 350 °C). После охлаждения стряхните неразложившийся крахмал: вам нужна темно-коричневая масса.
Эксперимент 6. Приготовьте нарезанную стальную проволоку. Не пытайтесь заменить ее алюминиевой или медной — они могут расплавиться. Заготовьте не менее 50 г смеси по приведенному выше рецепту. Сухую смесь лучше всего разводить в полиэтиленовой банке с обрезанным верхом объемом 100–200 мл (от шампуня, клея и т. п.). Когда смесь высохнет, ее остатки легко удалить из гибкой банки. Медленно добавляйте к сухой смеси воду и мешайте, пока не получите сметанообразную массу.
Проволоку покрывать смесью лучше в два приема. Обмакните и сушите ее в течение 0,5–1 часа (получается слой смеси до 1 мм). Затем обмакните снова. Общая толщина свечи должна составить 5–6 мм. Сушить свечи надо в вертикальном положении намазанной частью вниз, например втыкая проволоку в закрепленный на полке пластилин. Общее время сушки — не менее суток.
Проверьте после этого срока качество изделий. Если они горят равномерно, хорошо искрят и весь шлак удерживается на проволоке (зажгите свечу в полуметре над расстеленной газетой: на ней не должны появиться прожженные пятна) — можете дарить друзьям ваши искристые свечи.
Правила пользования обычные — не ближе 2 м от елки, бумаги, ваты, не бросайте куда попало только что сгоревшие и тем более горящие свечи.
Едва ли можно найти юного химика, ни разу ничего не взрывавшего. И самому интересно, и друзей хочется удивить. Но как сделать подобные опыты безопасными? Ясно, что запреты число несчастных случаев не уменьшат. Надо познакомить школьников с основами пиротехники. И нашелся смелый человек, рискнувший создать подобный курс. В. В. Загорский уже несколько лет ведет факультатив по теориям быстрых экзотермических реакций в специализированном учебно-научном центре МГУ и летней школе "Химера".
На прошлом занятии, на примере искристой свечи мы с вами убедились, как важно правильно подобрать компоненты в пиротехнической смеси. Причем, чтобы достичь нужного эффекта необходимо не просто стехиометрическое сочетание окислителя и восстановителя. (Напомню, для нашей искристой свечи мы использовали состав: чугунные опилки — 30 % по массе, нитрат бария — 50 %, алюминиевая пудра — 6 %. декстрин — 14 %.) Если вы попытаетесь составить уравнения реакций, соответствующие приведенному искристому составу, то обнаружите в нем избыток восстановителя. Дело в том, что частицы металла должны давать красивые искры. Поэтому сгорать им надо за счет кислорода воздуха, а не окислителя. Кстати, окислитель, кроме отдачи кислорода, отвечает за получение тугоплавкого шлака. Декстрин служит клеем, горючим и пламегасителем (поскольку выделяет воду). Алюминиевая пудра стабилизирует горение.
На первом занятии мы говорили, что пиротехнические смеси позволяют получить красивые эффекты. И самое впечатляющее из них — это, пожалуй, цветное пламя. Есть много рецептов составов цветного пламени, но если вы не понимаете физики и химии, ответственных за цвет процессов, то вам трудно выбрать нужный состав и тем более разработать его самому.
Индивидуальные вещества и смеси могут гореть, излучая в самых разных частях спектра — от ультрафиолетового (водород, сероуглерод) до инфракрасного (специальные термиты). Пламя свечи и горящего магния излучает в видимом диапазоне — в первом случае свет перед полным сгоранием испускают раскаленные частички сажи, во втором — окись магния. Оба пламени являются примерами излучателей непрерывного спектра. Глазом такое излучение воспринимается как красное при 600–900 °C, оранжевое или желтое при 900— 1200 °C и белое при более высоких температурах, до которых нагревается тело-излучатель (частички сажи и дыма в пиросмесях). При этом доля видимого света обычно составляет очень малую часть всего излучения (в основном инфракрасного).
Чтобы получить пламя, ярко окрашенное в один из цветов видимого спектра, необходимо использовать другие излучатели, способные испускать кванты только в узком диапазоне энергий. Ими могут быть атомы или молекулы в газовой фазе — более крупные частицы в горячей зоне пламени должны почти отсутствовать. Отсюда следует общий принцип для желающих получить цветное пламя: в составе должна быть смесь, горящая бесцветным пламенем, и добавка, выделяющая атомы или молекулы-излучатели. Нужно, чтобы энергии горения хватило для возбуждения излучателя (на практике не менее 3,5 кДж/г смеси). Кстати, дыма при горении может быть много — главное, чтобы твердые частицы отсутствовали именно в горячей зоне пламени. Рассмотрим конкретные примеры.
Красное пламя. Возбужденные атомы лития испускают яркий красный (671 нм) и оранжевый (610 нм) свет в виде узких спектральных полое. Однако в пиротехнике литий почти не используют, из-за относительно высокой стоимости соединений: кроме того, все литиевые соли важнейших кислот-окислителей чрезвычайно гигроскопичны. Главный излучатель красного цвета пламени в пиротехнических смесях — монохлорид стронция SrCl. В результате термического возбуждения он испускает кванты света с длиной волны 636, 648, 661, 674, 688 нм. Оксид стронция, а также моно-, фторид и монобромид не дают интенсивного и чистого красного излучения в пламени. Теоретически монохлорид стронция можно получить в пламени по реакциям:
SrO + 1/2Cl2 + С = SrCl + CO
SrO + 1/2C2Cl6 = SrCI + CO + Cl2,
2SrO + Cl2 (изб.) = 2SrCl + O2,
2SrCl2 = 2SrCI + Cl2.
Эти равновесные процессы могут протекать только при недостатке кислорода. Оксид стронция образуется при разложении нитрата, карбоната или оксалата, используемых обычно в пиросмесях. А вот хлорид стронция (SrCl2) по гигроскопичности сравним с хлоридом кальция и в смесях не применяется. Поэтому последняя из реакций маловероятна. Источник хлора в пиросмесях — это обычно хлорат калия, перхлорат калия или аммония, а также хлорорганические соединения. Из последних наиболее доступен и безопасен (не дает летучих ядовитых паров) перхлорвинил (ПХВ,ПВХ) в виде опилок (порошка). Таким образом, составы красного огня должны содержать, кроме окислителя и горючего, соединение стронция (окислителем может быть полностью или частично нитрат стронция) и источник хлора. Пламя таких составов должно быть восстановительным, то есть смеси содержат избыток горючего. Чистота цвета пламени достигает 80 % от интенсивности всего видимого излучения пиросмеси.
Желтый излучатель наиболее доступен. Это, например, возбужденные атомы натрия, испускающие кванты света с длиной волны 589 нм. Выше 1000 °C большинство соединений натрия легко диссоциирует, и в пламени появляется линейчатый спектр излучения атомарного металла. В крупных городах улицы вечером освещают натриевые лампы, в которых пары металла возбуждаются электрическим разрядом. Желтое пламя легко получить, если использовать в качестве окислителя натриевую селитру. Менее гигроскопичными будут составы с нитратом калия, калий дает в видимой области бледно-фиолетовое пламя. Эффективным источником атомов натрия в этом случае может быть его оксалат (несколько хуже — карбонат). Чистота цвета достигает 80 %. В присутствии галогенов желтое излучение натрия ослабляется, что весьма полезно для составов красного и зеленого пламени.
Зеленое пламя. Зеленый свет испускают возбужденные атомы таллия (535 нм), соединения бора и меди. Однако наиболее эффективный излучатель — монохлорид бария ВаСl. Соединения таллия чрезвычайно ядовиты, бор дает обычно малоинтенсивную окраску, дигалогениды меди с зелеными полосами в спектре испускания достаточно гигроскопичны и несовместимы с более активными металлами, которые входят в состав горючего. Оксид бария и другие, его галогениды содержат в спектре испускания много желтых полос. Реакции получения в пламени ВаСl те же, что и в случае монохлорида стронция. Поскольку, в отличие от стронция хлорат бария малогигроскопичен, раньше были популярны составы на основе Вa(Сl3)2∙Н2O. Но они обладают высокой чувствительностью к механическим воздействиям, поэтому сейчас их не производят. Если вы читали предыдущее занятие, то пользуясь таблицами 1 и 2, вы можете сами сравнить по степени опасности хлорат бария с бертолетовой солью. (Кстати, а любом случае необходимые константы всегда можно найти в "Справочнике химика" или каком-либо другом химическом справочнике.) Для зеленого пламени важно то же, что и для красного — в смеси необходим источник бария и хлора, недостаток окислителя. Чистота цвета составов зеленого пламени может достигать 80 %.
Синее пламя. В отличие от рассмотренных выше цветов, синее пламя имеет невысокую чистоту и интенсивность. До сих пор нет оптимальных излучателей синего спектра. Синий цвет излучают возбужденные атомы индия (451 нм), сине- зеленый цвет придают пламени соединения цинка, сине-фиолетовый — соединения рубидия и галлия. Однако индий и галлий — редкие металлы, а излучатели на основе цинка малоинтенсивны. В пиротехнике синее пламя получают, используя в качестве излучателя молекулы монохлорида меди CuCl (спектральные полосы излучения при 429, 442, 476, 485, 488 нм). Монохлорид меди испускает кванты в синей части видимого спектра при температуре не выше 1200 °C в восстановительном пламени. В современных составах синего пламени чаще всего используют смесь перхлората аммония с уротропином (избыток горючего) и добавкой нескольких процентов монохлорида меди. Чистота цвета не превышает 30 %. Ранее, чтобы получить синее пламя, брали горючую смесь хлората калия с серой и 15–20 % малахита. В такой смеси сера способствует выделению свободного хлора по реакции:
КСlO3 + S = K2SO4 + SO2 + Cl2
Добавки хлорорганических соединений позволяют обойтись без серы. При разработке составов синего пламени на основе соединений меди не забывайте, что последние реагируют с более активными металлами, особенно в присутствии влаги. Из-за невысокой спектральной чистоты синего пламени требуется тщательная очистка исходных реактивов.
Будем считать, уважаемые читатели, что вы уже достаточно хорошо освоили элементарные теоретические основы пиротехники. (См. предыдущие занятия.) Пора переходить к практическим занятиям. Их основная цель предполагается та же, что в Специализированном учебно-научном центре МГУ и в летней школе "Химера" — изготовить фейерверк самим. А для начала несколько общих замечаний.
Учтите, что даже самый простой фейерверк — это прежде всего тяжелая работа, требующая физических усилий, терпения и аккуратности. Мы, например, посчитали, что стандартная фейерверочная ракета и при налаженном производстве требует для изготовления в 300–400 раз больше времени, чем для полета. Кстати, как показывает мой опыт, молодые люди обычно не могут проделать всю работу от начала до конца. У девушек терпения больше.
Вам потребуется довольно большой ассортимент реактивов, материалов, инструментов. Поскольку вы будете накапливать запас различных пиротехнических смесей и вспомогательных изделий (стопин, звездочек и тому подобного), я категорически не советую заниматься такой работой дома. Это опасно хотя бы потому, что готовые фейерверочные изделия, полуфабрикаты и смеси совершенно недопустимо хранить в одной комнате. Оптимальный вариант — найти достаточно смелого учителя, готового предоставить школьный кабинет химии для пиротехнических экспериментов (крайний случай это сарай, лучше кирпичный, понятно почему?).
ВНИМАНИЕ! Автор не может отвечать за результаты работ, если вы колдуете дома и без помощи квалифицированного руководителя. Если вы правильно и полно ответите на вопросы, составленные в основном по темам предыдущих публикаций, то вступите в наш пироклуб. И сможете получать новости и технологии фейерверочного искусства. Конечно, вам придется порыться и в других книгах. Не запрещены консультации у грамотных химиков.
Давайте отвлечемся немного от химической термодинамики и поговорим о прошлом. История создания черного пороха, служившего единственным взрывчатым веществом в течение по крайней мере 600 лет, тесно переплетена с историей развития промышленного неорганического синтеза. Два из трех компонентов — сера и древесный уголь — известны с древнейших времен. Но они не могли гореть без доступа воздуха. Нужен был легко разлагающийся окислитель — калиевая селитра. К ней человек шел не одно столетие.
Первые упоминания о применении боевых горючих смесей относятся к "греческому огню". (Подробнее о нем можно прочитать в "Химии и жизни", 1993, № 3.)
Например, в 670 и 718 гг. н. э. этим зажигательным средством были уничтожены корабли арабского флота, осаждавшего Константинополь (Царьград). Можно допустить, что ранние составы "греческого огня" не содержали селитры и соответственно не могли гореть без доступа воздуха.
Из разных описаний (например, "Огненная книга" Марка Грека, 1250 г.) следует, что в состав "огня" входили смола, сера, нефть, масла. Испытывали на себе действие "греческого огня" и русские воины. В 941 г. возвратившиеся из неудачного похода на Царьград ратники князя Игоря рассказывали: "У греков в руках точно молние небесное, которое они пускали трубами и жгли нас: вот почему и не одолели мы их". Из описаний следует, что огонь "пускали трубами", причем с близкого расстояния. Но смесь, не содержащая окислителя (селитры), не могла гореть в трубах! Вполне вероятно, что "греческий огонь" образца 941 года уже содержал селитру.
В Китае первое описание состава и рецепта приготовления горючей смеси из селитры, серы и угля появилось около 600 г. н. э. Возможно, что метаемый трубами "греческий огонь" был приготовлен на основе импортной селитры, причем ее рецепт в Византии не знали. Этим можно объяснить достаточно редкое использование мощного оружия и то, что оно не спасло греков от поражения войском киевского князя Святослава в 971 г. и от разгрома Царьграда крестоносцами в 1204 г. В последнем случае греки использовали зажигательные лодки (брандеры), но не извергающие огонь трубы.
В середине XIII в. в Европе появились описания нового соединения — селитры, а также способов ее производства и очистки. Первые рецепты написаны арабскими учеными, которые в свою очередь упоминают о "китайских огненных стрелах".
Получается селитра при разложении животных и растительных остатков. Древние термины "salpetre" (англ.) или "nitrum" (лат.) означали белую соль, добываемую из земли, — ими называли и поваренную соль, и соду. Латинский термин происходит от арабского "нитрум". В условиях жаркого климата и длинного сухого сезона достаточно быстрое разложение органических веществ и накопление смеси нитратов в почве — обычное явление. Однако, чтобы выделить из естественной смеси достаточно чистую калиевую селитру, пригодную для горючих составов, нужны немалые химические знания. Наиболее подходящий для накопления "селитряной земли" климат был в Северной Африке, Сирии, Южном Китае и Индии. Научные знания арабов и китайцев в то время позволили им организовать производство довольно чистой селитры. Хотя иногда калиевую селитру называют "индийской", утверждения об ее индийском происхождении неверны. Для производства "селитряной земли" использовали смесь навоза, костей и внутренностей животных, помещаемую в специальные ямы с золой и известью. Образованные касты индийского общества вряд ли могли соприкасаться с таким сырьем. Однако в XIII веке в Индии уже сформировалась каста "селитрянщиков", которые производили нитрат калия в больших количествах, скорее всего, по китайской технологии. Поскольку арабы называли очищенную калиевую селитру "китайским снегом", наиболее вероятно, что разработали технологию китайцы. Известный ученый и путешественник Марко Поло, посетивший Китай в 1275–1292 гг., дал такое описание. "Белую доброкачественную соль" получали после экстракции водой из "селитряной земли" и упаривания раствора. Этот продукт китайцы использовали и как поваренную соль — известно, что нитраты улучшают консервирующее действие хлорида натрия.
Поскольку еще в прошлом веке в Индии производили калиевую селитру практически по той же технологии, воспользуемся данными из книги А.Маршалла "Взрывчатые вещества" (1915 г.). "Сырая" селитра до перекристаллизации содержала от 30 до 65 % нитрата калия, до 14 % нитратов кальция и магния, от 15 до 35 % хлорида натрия, до 15 % сульфата натрия. После первой перекристаллизации содержание нитрата калия увеличивалось до 82–90 %, но в такой селитре было еще до 7 % хлорида натрия. Поскольку нитрат натрия гигроскопичен, селитра для производства пороха требовала, по крайней мере, двух перекристаллизаций.
Первым европейским ученым, описавшим приготовление пороха (не позже 1249 г.), был Роджер Бэкон (1214–1292). Он зашифровал свою книгу, поэтому полностью ее смогли прочитать только в XIX веке. Примерно в то же время Марк Грек описал "гремящие" и "летающие" трубы с пороховой смесью — примитивные бомбы и ракеты.
В 1300 г. во Фрайбурге (Германия) отлили первую европейскую пушку. В этом же городе жил и монах Бертольд Шварц, составивший в 1388 г. рецепт приготовления пороха высокого качества. Огнестрельное оружие было использовано в 1326 г. в Англии и Флоренции, в 1331 г. в Германии. В России первые пушечные выстрелы прозвучали при Дмитрии Донском. "Лета 6897 (1389 г. — В. 3.) вывезли из Немец арматы на Русь и огненную стрельбу и от того часу уразумели из них стреляти" — сообщает Голицынская летопись. Однако "Софийский временник" упоминает о более раннем боевом применении пушек — при обороне Москвы в 1382 г. от войск татарского хана Тохтамыша.
В 1525 г. во Франции впервые появился гранулированный порох.
Древняя пиротехническая смесь сохраняет значение и в наше время. Последний патент получен в 1988 г. (США) — разработано дешевое ракетное топливо на основе черного пороха и нитроцеллюлозы в качестве связующего.
Но, конечно, раньше всего смесь селитры, угля и серы использовали не на войне, а на праздниках. Упоминания о фейерверках гораздо более древние, чем сведения об огнестрельном оружии. Необычные эффекты можно получить при использовании даже плохо растертых смесей на основе загрязненной селитры. Например, "японские огненные колосья" изготовляли из смеси селитры, поваренной соли, серы и угля. При поджигании таких смесей, обычно очень слабо перетертых, возникает раскаленный шарик, выбрасывающий искры. При лучшем перетирании всех компонентов и добавлении относительно крупнозернистого угля легко получаются смеси, способные при сжигании в трубках давать искристые фонтаны.
Итак, мы уже говорили о том, что черный порох появился только после того, как была разработана технология производства и очистки калийной селитры. Почему именно калийной, а, например, не аммиачной?
Селитры — это соли азотной кислоты. Если вы помните, мы уже упоминали об экзотермическом распаде аммиачной селитры (нитрата аммония):
(1). NH4NO3 = 0,5NО2 + 0,75N2 + 2Н2О
(2). NH4NO3 = N2 + 2Н2О + 0,5СО2
Эти реакции сопровождаются выделением тепла, соответственно 102 и 119 кДж на 1моль исходного нитрата аммония. Нетрудно заметить, что в молекуле NH4NO3 присутствуют одновременно окислитель (N+5) и восстановители (N-3, 0–2). Если энергия, выделяющаяся при распаде такой молекулы, может вызвать аналогичное превращение хотя бы одной из соседних молекул, вполне возможно, что эти реакции будут протекать со взрывом. Увы, это предположение нашло не одно подтверждение. Первый серьезный "эксперимент" — происшествие на складе химического завода в Оппау (Германия, 1921 г.). Там пытались раздробить слежавшуюся массу смеси нитрата и сульфата аммония небольшими зарядами динамита. Масса сдетонировала, в результате погибло около 1000 человек, разрушены сотни зданий. С тех пор произошло более 40 крупных аварий, связанных с детонацией нитрата аммония.
На основе нитрата аммония изготовляют недорогие бризантные смеси — аммоналы (избыток кислорода используется для окисления порошка алюминия) и аммотолы (смесь "кислородоизбыточного" NH4NO3 с "кислородонедостаточным" тринитротолуолом СН3С6Н3(NО2)3). Аналогичные свойства проявляет другая аммониевая соль — перхлорат.
Способность нитрата аммония к самопроизвольному разложению в присутствии катализатора вы уже проверяли экспериментально (см. "Химию и жизнь" 1993, № 9). Логично предположить, что смесь нитрата аммония с углем будет замечательно гореть по уравнению:
(3) NH4NO3 + 0,5С = 2Н2О + N2 + 0,5СО2
Сравним тепловой эффект реакции (3) с тепловым эффектом реакции (4);
(4) 2KNО3 + 2,5С = К2О + N2 + 2,5СО2
Для реакции (3) получаем:
ΔН°298 = [(2∙(-242) + (0,5∙(- 394)) — (-365)] = -316 кДж;
Для реакции (4):
ΔН°298 = [(-362) + (2,5∙(-394)] — (2∙(-495)] = -357 кДж.
Но надо учесть, что первая цифра относится к 86 г смеси, а вторая к 232 г. На килограмм стехиометрической смеси нитрата аммония с углем получаем энтальпию — 3674 кДж, а на килограмм нитрата калия с углем —1539 кДж.
Так что, если судить по уравнению (4) и термохимическому расчету, нитрат аммония — идеальный окислитель для пороховой смеси. Однако те из вас, кто видел эту соль, наверное, заметили, что в ней много влажных комков — недаром аммиачную селитру, используемую для удобрения, гранулируют. Очень высокая растворимость нитрата аммония не позволит держать порох сухим, поскольку данная соль впитывает пары воды из воздуха при относительной влажности более 67 % (эта гигроскопическая точка соответствует относительной влажности воздуха над насыщенным раствором соли при 20 °C). Пиротехники знают, что не стоит готовить смеси с солями, гигроскопическая точка которых ниже 75 %.
Гигроскопическая точка нитрата натрия — 77 %, нитрата калия — 92,5 %. В средней полосе относительная влажность воздуха часто превышает 80 %, при этом смеси на основе натриевой и аммиачной селитры быстро отсыреют. А примесь влаги в горючей смеси, как вы помните из предыдущих статей, снижает скорость горения.
Есть еще одна причина того, что смеси с окислителями-солями аммония — горят медленно. Не только известный вам хлорид, но и практически все остальные аммониевые соли способны возгоняться. Причем при возгонке аммиачная селитра начинает разлагаться:
(5) NH4NO3 = NH3 + HNO3 — 174,4 кДж.
При 200 °C давление паров над нитратом аммония составляет уже 839 Па и равновесие заметно сдвинуто вправо. При более высокой температуре начинаются реакции аммиака с азотной кислотой. Но этим экзотермическим реакциям предшествует эндотермическая стадия возгонки, охлаждающая поверхность горящей смеси. В результате смеси на основе нитрата аммония горят очень медленно, хотя и детонируют. Что ж, придется для будущих фейерверков доставать нитрат калия. В продаже встречаются удобрения — натриевая и аммиачная селитры. Их можно использовать для приготовления калиевой селитры.
Для того чтобы получить нитрат калия из аммиачной селитры, удобнее всего использовать карбонат калия (поташ), который продается в фотомагазинах. Приготовьте насыщенные растворы из рассчитанных количеств солей, слейте их и кипятите под тягой или на открытом воздухе:
(6) 2NH4NO3 + К2СО3 = 2KNО3 + 2NH3 — + СО2 — + Н2О
Кстати, эта реакция происходила и в древних ямах-селитряницах, где органические остатки были перемешаны с золой, содержащей много поташа.
Необходимые данные, для того чтобы получить нитрат калия из натриевой селитры, есть в задаче для 8-го (теперь 9-го класса). Попробуйте решить эту задачу самостоятельно.
В вашем распоряжении есть хлорид калия, карбонат калия и нитрат натрия. Растворимость солей (г соли на 100 г воды) при разных температурах приведена в таблице:
В прошлый раз мы рассказали о том, как выбрать окислитель для черного пороха. Но кроме окислителя вам понадобятся два восстановителя — древесный уголь и сера. Для производства пороха нужен хорошо прокаленный, активированный уголь не пригоден, уж больно важны органические и минеральные примеси, которые содержатся в недожженном угле, они служат катализаторами протекающих реакций. Чтобы приготовить древесный уголь, вам потребуется древесина лиственных пород (ветки ольхи, липы, ивы, тополя, наломанные весной). Одна или несколько высоких жестяных (не алюминиевых) консервных банок с отогнутыми, но не оторванными крышками и, разумеется, костер. Заполните банки плотно ветками без коры и прикройте крышками, оставив очень небольшие щели. Поставьте банки в середину хорошо прогоревшего костра, в котором много тлеющих углей. Допустимый нагрев банки — до еле заметного красного каления стенок. После того как перестанут гореть газы и пары, выходящие из щели, банку можно вынимать из костра. Скорее всего, у вас получится бурый уголь (см. таблицу).

После второй-третьей попытки у вас будет получаться равномерно обожженный уголь достаточно высокого качества. В прошлом веке, используя древесный уголь с невысокой степенью обжига ("шоколадный"), производили двухкомпонентный порох, состоящий из калиевой селитры и древесного угля. Состав его определяется формальным уравнением горения:
(7) 2KNО3 + 4С = К2О + N2 + 3СО + СО2
На самом деле реакция гораздо сложнее. Более ранние и более традиционные, в том числе использующиеся сегодня черные пороха содержат легколетучее горючее с достаточно высокой теплотой сгорания — серу. Элементарная сера плавится при 119,3 °C, кипит при 444,6 °C, а уже при 260 °C давление ее паров составляет 10 мм. рт. ст. Большинство горючих соединений вспыхивает от внешнего пламени, если давления их паров соответствуют 10–30 мм. рт. ст. Следовательно, в смеси серы, калиевой селитры и угля температура вспышки серы достигается до плавления селитры (336 °C). Температура воспламенения такой смеси будет меньше зависеть от степени обжига угля. Чтобы получить хорошо хранящуюся горючую смесь, пользуйтесь только крупнокристаллической серой. Мелкие порошки (серный цвет, коллоидная сера) обычно загрязнены серной кислотой.
Эксперимент 7. Но вначале давайте повторим правила техники безопасности:
Пользуйтесь только фарфоровыми ступками. Следите, чтобы ступки были чистыми. Не растирайте окислители вместе с восстановителями (кроме специально оговоренных случаев). Надписывайте банки, в которых храните реактивы и смеси. Не проводите эксперименты ближе двух метров от горючих материалов. Поджигайте только небольшие (0,1 г) образцы смеси.
Итак, добавьте к смеси нитрата калия с углем (в соотношении 4:1) предварительно растертую серу (около 10 % от массы смеси). Затем предельно осторожно разотрите смесь с серой, не допуская ударов (иначе возможен взрыв!). Попробуйте теперь сжечь стандартный (0,1 г) образец.
ОСТОРОЖНО! Если смесь растерта тщательно, она сгорает очень быстро — можно сжечь щепотку на куске бумаги, и бумага почти не обуглится. Ну вот, вы и "изобрели" классический, черный порох!
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ