ГЛАВА 2 Кислород берет верх над флогистоном
Лавуазье, самому молодому члену Академии наук, было суждено осуществить поразительнейший опыт: он заставил исчезнуть горсть алмазов, использовав солнечный свет и гигантскую линзу. Затем Лавуазье поселился в Арсенале, в лаборатории которого родилась новая наука. Именно там, сжигая серу и фосфор, ученый изгнал из мира химии флогистон с помощью кислорода. Кроме того, он нашел время для работы в Управлении порохов и селитр, заложив тем самым основы военной мощи Франции.
Самым значительным изменением, которое привнесла женитьба Антуана в его жизнь, стал переезд. Из дома его бабушки на улице Фур-Сент-Есташ новобрачные перебрались в дом, который отец Лавуазье специально купил для них на улице Неф-де-Бон-Анфан. Зато Марии пришлось кардинально изменить свою жизнь, чтобы приспособиться к мужу, и сделала она это очень необычным для того времени способом: молодая женщина полностью погрузилась в научные проекты Антуана и понемногу приобрела необходимые навыки для того, чтобы быть по-настоящему ему полезной. Лавуазье говорил и писал только по-французски, поэтому Мария усовершенствовала свое знание латыни — языка, который тогда использовался во многих научных документах. Параллельно, поскольку главные открытия в области пневматики — одной из областей, интересовавших Антуана, — происходили в Англии, она начала изучать и английский язык. Параллельно с этим Мария брала уроки рисования под руководством Жака Луи Давида, уже признанного в то время художника. Кроме того, она посещала занятия по химии и со временем стала ассистенткой в лаборатории мужа.
Антуану понадобилась вся помощь, на какую была способна его жена, поскольку к работе в Генеральном откупе добавлялись все более сложные задачи, которые он должен был решать в качестве члена Академии наук. Лавуазье строго соблюдал все свои обязательства, он желал улучшить функционирование учреждений, к которым принадлежал, и приумножить пользу от них для всей страны. Однако, несмотря на то что работа в Генеральном откупе и Академии наук отнимала очень много сил, Антуан не терял из виду свою главную цель: превратить химию в точную науку.
В связи с этим 1772 год стал ключевым для Лавуазье. Являясь членом Академии, имея гарантированное финансовое будущее благодаря Генеральному откупу и обзаведясь семьей, он был готов погрузиться в масштабную работу: изучить роль воздуха в процессе горения. Это было одно из явлений, более других волновавших ученых того времени. Лавуазье уже много размышлял над ним во время работы над проектом освещения улиц Парижа. По всей Европе один за другим проводились опыты с целью прояснить этот процесс, который, казалось, объяснялся теорией флогистона. Тогда ученые полагали, что при воспламенении тело теряет флогистон и прекращает гореть, когда окружающий его воздух насыщается этим веществом и больше не может его впитывать. Так, например, считалось, что уголь и дерево содержат большое количество флогистона и именно по этой причине так хорошо горят (мы бы сегодня сказали «вещества-поглотители»).
Но во многих случаях гипотеза флогистона не могла рационально объяснить результаты опытов. Например, французский химик Луи Бернар Гитон де Морво (1737-1816) только что опубликовал результаты опытов по прокаливанию металлов, в результате которых образовывавшаяся «известь» неизменно весила больше, нежели чистый металл. Это противоречило теории: окисляясь, металлы теряли флогистон, однако становились тяжелее. Чтобы объяснить данное явление, приверженцы теории флогистона предположили, что флогистон в некоторых случаях может иметь отрицательную массу, и это объясняло, почему вещества, теряющие флогистон, становились тяжелее. Лавуазье решил покончить с этим противоречием путем планомерного изучения пневматической химии (химии газов), чтобы окончательно подтвердить или опровергнуть теорию флогистона.
В 1772 году Академия решила разгадать одну тайну. Считалось, что алмазы не разрушаются под воздействием огня; однако французский химик Жан Дарсе (1725-1801) утверждал, что провел немало опытов, во время которых алмазы исчезали под воздействием тепла, и это подтверждали другие ученые со времен Бойля. Речь шла о том, чтобы понять, разрушает тепло алмазы или нет, и если разрушает, то с чем это связано — с превращением камней в пар или с их возгоранием. Академия создала комитет, в который вошли Лавуазье, Пьер Жозеф Макёр (1718-1784) и Луи Клод Каде де Гассикур (1731-1799). Два уважаемых парижских химика осуществили множество опытов в оборудованной наиболее подходящим образом лаборатории Каде, но получили неубедительные результаты. Для раскрытия тайны нужен был источник очень интенсивного тепла, желательно без горючих материалов, чтобы продукты горения не смешивались с изучаемым веществом. Но найти его было непросто, поскольку до изобретения в XIX веке горелки Бунзена печи в химических лабораториях работали на угле.
Я рассматриваю природу как большую химическую лабораторию, в которой происходят любого рода соединения и разложения.
Антуан де Лавуазье
Кроме того, исследование зашло в тупик, поскольку у членов комитета не было алмазов, необходимых для продолжения опытов. Но на помощь им пришел ювелир Майар, который согласился предоставить три своих алмаза при условии, что сможет лично наблюдать за тем, как будет проходить нагревание.
Майар был убежден: для исчезновения алмазов необходимо наличие воздуха, и он хотел, чтобы химики осуществили опыт, подтверждающий его гипотезу. Для этого они поместили алмазы в глиняный сосуд, который заполнили угольной пылью. Далее сосуд закрыли и поместили его в два горшка, из которых один был перевернут вверх дном так, чтобы отверстия горшков совпадали и таким образом были тоже плотно закрыты. Ученые нагревали дважды закрытый сосуд в течение многих часов, но в итоге получили практически неизменившиеся алмазы, поверхность которых лишь слегка потемнела. Данный результат, казалось, подтверждал гипотезу Майара, однако не опровергал гипотезы испарения, поскольку можно было предположить, что используемая печь не позволила достигнуть достаточно высокой температуры.
Тогда Лавуазье вспомнил о линзе Чирнгаузена, хранившейся в подвалах Академии. Она была названа так в честь немецкого ученого, разработавшего ее веком раньше, и представляла собой гигантскую лупу, чуть больше десяти метров диаметром. Ее можно было использовать для создания того, что тогда называли «солнечной печью», в которой достигалась гораздо более высокая температура, нежели в конвенционной печи. Кроме того, за этой «печью» было гораздо удобнее следить, нежели за огнем в настоящей печи, где к тому же дым и пепел могли смешиваться с изучаемыми телами. Первые опыты не принесли желаемых результатов, поскольку линза не была отшлифована и имела много недостатков. Тогда было сконструировано устройство, основанное на том же принципе, но массивную линзу заменили сосудом, наполненным спиртом. Его создание профинансировал Трюден де Монтиньи, благородный вельможа, увлеченный наукой, и вдобавок друг Лавуазье. Получив данное устройство Лавуазье, Макёр, Каде и физик Матюрен Жак Бриссон (1723-1806) в октябре 1772 года осуществили в Королевском саду свой знаменитый опыт.
Он походил на настоящий спектакль, собравший толпу любопытных, и дамы по этому случаю надели свои лучшие наряды. На Лавуазье были затемненные очки, чтобы защитить глаза от интенсивного луча света. Помимо алмазов Майара изучалось также воздействие тепла на рубины; их нагревали как на воздухе, так и в запечатанных емкостях.
На этой гравюре, изображающей линзу Чирнгаузена, мы можем видеть устройство, похожее на то, которое использовал Лавуазье во время опыта с алмазами.
А: большая линза, состоящая из двух кусков выпуклого стекла и наполненная спиртом.
В: линза меньшего размера.
С: крепление устройства к земле.
D: регулируемая подставка.
Е: рычаги, с помощью которых можно поднимать и опускать большую линзу.
F: механизм, позволяющий приближать и отдалять маленькую линзу от большой.
G: сосуд, содержащий вещества, подлежащие нагреву.
Н: платформа, на которой стоит все устройство.
I: колеса, позволяющие передвигать платформу.

Когда нагреву были подвергнуты запечатанные сосуды, то есть опыт осуществлялся при отсутствии воздуха, ни один из драгоценных камней не претерпел изменений. Зато когда нагревание происходило на воздухе, алмазы начинали уменьшаться в размерах и через 20 минут исчезали без следа. (Вот неопровержимый способ проверить, является ли прозрачный камень алмазом: если он исчезнет при сильном нагреве на воздухе — значит, это алмаз). А вот с рубинами, которые состоят из окиси алюминия (А12Оэ), содержащей небольшое количество хрома, ничего не произошло. Образовавшиеся во время опыта газы были собраны с помощью устройства, похожего на разработанное Стивеном Гейлсом (1677-1761), которое впоследствии было усовершенствовано Пристли. Ко всеобщему удивлению, полученным газом оказался «фиксируемый воздух», названный так Джозефом Блэком (1728-1799) и образующийся при сжигании угля.
Лавуазье было поручено составить и представить Академии доклад (он сохранился до наших дней), призванный объяснить, что алмазы не испаряются, а сгорают. Но ученый не удовольствовался точным и подробным описанием произведенных опытов и полученных результатов: весь этот процесс заставил его глубоко задуматься. Он сразу заключил, что алмаз должен быть чем-то вроде угля, хотя внешне между алмазом и углем нет ничего общего (сегодня мы знаем, что алмазы состоят из углерода, у них такой же химический состав, как и у угля: при высокой температуре они горят и производят диоксид углерода — газ, который отвечает за парниковый эффект). Вопреки мнению коллег, Лавуазье начал подозревать, что в химическом процессе ничего не разрушается и ничего не создается, но все изменяется, и значит, если мы получили один и тот же продукт, то исходные вещества были одинаковыми. С другой стороны, поскольку воздух необходим для горения, возможно, он — не просто компонент, как считалось прежде, но и активный участник этого химического процесса.
Возникали два вопроса: в чем заключается действие воздуха, заставляющее исчезать алмазы? И какова роль флогистона?
На самом деле алмазы исчезали из-за процесса горения, то есть из-за взаимодействия угля с кислородом, где «фиксируемый воздух» Блэка — это СO2:
С (твердое вещество) + O2(газ) → СO2(газ).
Рубины не реагируют с кислородом из воздуха, поскольку алюминий окислен и уже вступил в реакцию с кислородом.
Установив однажды эффективность «солнечной печи», Лавуазье продолжал использовать ее для опытов с нагреванием. Чтобы понять процесс горения, он сначала изучил изменения, которые претерпевали другие, не металлические вещества — фосфор и сера. Уже давно было известно, что белый фосфор самопроизвольно возгорается и при этом легко наблюдаемом процессе выделяется большое количество тепла.
Когда Лавуазье принялся за его изучение, он получил дополнительную информацию: Антуан подтвердил то, на что уже указал Гейле: вес фосфора сильно увеличивается в процессе горения. В отличие от продукта, образовывавшегося во время горения алмазов, продукт, получавшийся во время горения фосфора, был плотным, и это позволяло его точно взвесить. В конце 1772 года Лавуазье послал в Академию письмо, в котором объяснял, что фосфор поглощает воздух в большом количестве и вместо того, чтобы терять вес (чего можно было ожидать из- за потери флогистона), наоборот, приобретает вес, равный поглощенному воздуху. Образовывающееся новое вещество было «кислотным духом фосфора», поскольку при смешивании его с водой получалось то, что мы называем сегодня фосфорной кислотой.
P4 + 5O2→ P4O10,
P4O10 + 6H2O→ 4H3PO4.
Проведя сходный опыт с серой, Лавуазье заметил подобный эффект: продукт сгорания весил больше, чем исходная сера, а при смешивании с водой образовывал то, что известно сегодня под названием серной кислоты. Он заметил также, что из одного фунта серы получалось больше одного фунта кислоты.
S + 3/2 O2 → SO3;
SO3 + H2O → H2SO4.

РИС. 1
Следующим шагом стало изучение превращения «извести» металла (свинцового глета или оксида свинца) при нагревании с помощью линзы Чирнгаузена вместе с углем, который, как мы уже видели, считался тогда источником флогистона.
Лавуазье собрал «эластичный флюид» (хотя Ван Гельмонт предложил слово «газ» веком раньше, оно еще не использовалось), который собирался на воде, предварительно покрытой слоем масла, мешавшим воде поглощать газ. Чтобы измерить его, он использовал пневматическую ванну, разработанную Гейлсом.
Мы знаем сегодня, что существование элемента или соединения в твердом, жидком или газообразном состоянии зависит от его давления и температуры. Почти невозможно представить себе времена, когда газ не считался веществом.
И все же это логично: трудно изучать вещества без определенной формы и объема, невидимые, часто без запаха, которые, соответственно, с трудом можно собрать. Поэтому одним из самых важных открытий в химии до Лавуазье стало открытие существования разных видов «воздуха»» и разработка приборов для их сбора. Фламандец Ян Баптист Ван Гельмонт считается отцом «пневматической науки»», поскольку еще в XVII веке он изучал все возможные типы воздуха, хотя так и не сумел определить его состав. Ван Гельмонт выделил воздух, содержавшийся в термальных водах, который является тем же самым веществом, что образуется при горении угля либо в погребах при брожении вина (СO2); с другой стороны, был еще воздух, который улетучивался при горении серы (SO2), и горючий воздух, выделяющийся при гниении органики (Н2, СН4, H2S). Ван Гельмонту мы обязаны и словом «газ»». Большинство историков науки утверждают, что корень данного слова происходит от греческого «хаос»», хотя Лавуазье связывал его с другим словом, означающим «призрак»». Долгое время считалось, что «обычный воздух»», то есть окружающая нас атмосфера, является просто средой, в которой происходят химические реакции, и сам по себе он никакой роли в этих реакциях не играет. В начале XVIII века опыты англичанина Стивена Гейлса и шотландца Джозефа Блэка сделали очевидным тот факт, что во время таких реакций, как горение, атмосфера может быть веществом, активно участвующим в реакции.

Для выделения разных типов «воздуха» необходимо, чтобы они не улетучивались в атмосферу. Поэтому Гейле придумал установку, изображенную на этой гравюре, представленной в его труде Vegetable Staticks (1727). В улучшенном виде данная установка сыграла решающую роль в определении различных газов.
Как видно на рисунке 1, речь шла о стеклянном колпаке, частично заполненном водой, в центре которого находилась пневматическая ванна с емкостью, куда помещали материал для нагревания. Сфокусированные солнечные лучи достигали емкости через поверхность колпака, который, в свою очередь, был погружен в другую емкость, также наполненную водой.
Лавуазье установил, что по мере того как уменьшалось количество «извести» и образовывался чистый металл, выделялся некий газ и уменьшался уровень воды внутри колпака. Объем произведенного газа был в 750 раз больше объема использованной окиси свинца.
Чтобы понять такое огромное увеличение объема, надо принять во внимание, что окись свинца — это твердое вещество, тогда как выделяемый «воздух» является газом, а твердые и жидкие вещества занимают гораздо меньший объем, нежели газообразные. Например, один моль любого газа в нормальных условиях (Р = 1 атм, Т = °0 С) занимает 22, 4 литра. А 1 литр воды (Н2O), плотность которой составляет 1 грамм на миллилитр, весит 1 килограмм и содержит 55, 55 молей.
Газ: 1 моль → 22, 4 литра.
Вода (жидкая): 1 литр → 55, 55 молей.
Плотность других твердых и жидких веществ обычно больше: например, плотность меди — порядка 7 граммов на миллилитр, а ртути — больше 13.
Подтвердив увеличение объема, Лавуазье повторно провел опыт с фосфором, но на этот раз использовал закрытую емкость, чтобы определить, меняется ли объем воздуха вокруг. Он убедился, что воздух теряет между пятой и шестой частью от изначального количества. Лавуазье провел множество опытов, чтобы определить увеличение веса, и в итоге убедился, что 154 грана фосфора поглотили во время горения 80 гранов воздуха или другого «эластичного флюида», содержащегося во вдыхаемом воздухе. Гран, так же как и фунт, являлся единицей веса, используемой в то время: 1 парижский фунт =16 унций; 1 парижская унция = 8 тросов; 1 трос = 72 грана; 1 парижский фунт соответствовал 480 граммам.
Кроме того, Лавуазье заметил, что в закрытой емкости может окисляться только определенное количество фосфора. Предвосхищая важность этих опытов, но не решаясь обнародовать их объяснение, он отправил 1 ноября 1772 года в Академию наук запечатанное письмо, в котором детально изложил свои мысли:
«Это увеличение веса происходит из-за необыкновенного количества воздуха, который собирается во время горения, соединенного с парами. То, что происходит с серой и фосфором, заставляет меня думать, что явление, сопровождающее горение этих элементов, будет наблюдаться и в случае большинства других веществ: они могут увеличивать вес во время горения или прокаливания. Я убежден, что увеличение веса при образовании металлических известей происходит по тем же причинам. Опыты привели меня к тем же заключениям: нагревая окись свинца в закрытом горшке прибора Гейлса, я заметил, что когда известь превращается в металл, выделяется большое количество воздуха, и этот воздух занимает объем в 750 раз больше, нежели объем используемой окиси свинца».
Это было первое описание, разумеется упрощенное, процесса горения. Оно ознаменовало собой настоящую революцию, поскольку Лавуазье не воспользовался теорией флогистона, на которую опирались все химики Европы в течение более чем 50 лет. Кроме того, он обозначил разницу между так называемым «фиксируемым воздухом» (СO2), который выделялся во время нагрева окиси свинца и угля, и «обычным воздухом» (O2 + N2). Согласно Гейлсу, речь шла об одном и том же веществе, тогда как, по мнению других ученых, эти два «воздуха» имели разные свойства, поскольку если «обычный воздух» был жизненно необходим, «фиксируемый воздух» убивал животных, которые его вдыхали, и заставлял гаснуть огонь.
В феврале 1773 года Лавуазье начал новую лабораторную тетрадь планом работы, нацеленным на изучение пневматической химии и на окончательное опровержение или подтверждение теории флогистона.
Существует много аллотропических форм фосфора, и они обладают разной структурой и разными свойствами. Самыми известными примерами абсолютно непохожих по внешнему виду и свойствам аллотропических форм являются алмаз и графит, состоящие из углерода. Самые известные аллотропические формы фосфора — белая и красная, однако также существует фиолетовый фосфор и черный. Белый фосфор химически наиболее активен, его молекула состоит из четырех атомов фосфора (Р), расположенных в вершинах тетраэдра. При контакте с воздухом он самовоспламеняется и образует оксид Р4О10. Во время этого процесса выделяется большое количество энергии. Образовавшееся вещество гораздо более твердое, нежели изначальный белый фосфор. Во избежание возгорания белый фосфор хранится в воде. Мы сегодня понимаем этот и другие процессы, потому что Лавуазье придумал систематическую номенклатуру для химических соединений и открыл закон сохранения массы. Фосфор при контакте с кислородом производит оксид, как и в случае с алмазами, но, в отличие от диоксида углерода, оксид фосфора является твердым веществом, поэтому не улетучивается в атмосферу, и следовательно, его легко взвесить. На рисунке ниже изображен процесс реакции фосфора с кислородом. Изначальное распределение атомов фосфора примерно сохраняется, но в оксиде один атом кислорода (темно-серый) вклинивается между каждой парой атомов фосфора (светло-серые в Р4 и в Р4O10).

P4 (твердое вещество)+ 5O2 (газ)→ Р4O10 (твердое вещество)
Однако его истинная цель была еще более честолюбивой. Результаты осуществленных опытов заставили его задуматься о необходимости пересмотреть химию какой ее знали в то время или, говоря его собственными словами, «вызвать революцию в физике и химии».
«Прежде чем приступить к серии опытов, которые я задумал осуществить с эластичными флюидами, выделяющимися из тел при брожении, перегонке и в итоге при любых видах соединения, а также поглощаемыми воздухом при горении различных веществ, я должен записать некоторые размышления, необходимые для разработки плана, которому я должен следовать. Господа Гейле, Блэк, Макбрайд, Кранц, Пристли и Смет осуществили в связи с этим многочисленные опыты, они должны были быть столь многочисленными, чтобы создать целую теорию. [...] Важность данной темы стала для меня причиной выполнения всей этой работы, которая призвана осуществить революцию в физике и химии. Думаю, все, что было осуществлено до нынешних пор, можно рассматривать лишь как указания. Я собираюсь начать все сначала с новыми мерами предосторожности, связать воедино все, что мы знаем о воздухе, который содержится в телах и выделяется из них согласно новым полученным знаниям, и выработать новую теорию. Работы многочисленных авторов, которых я упомянул, рассмотренные с этой точки зрения, кажутся мне звеньями одной большой цепи; они объединили некоторые идеи. Но надо еще осуществить большую серию опытов, чтобы сформировать последовательность».
Вот так Лавуазье определил цель своей работы, и ему оставалось только достичь ее.
С тех пор как Лавуазье представил в Академии свой первый доклад по поводу гипса в 1764 году, он не переставал посылать туда меморандумы и записки. Но в январе 1774 года ученый опубликовал свое первое важное произведение — «Небольшие физические и химические исследования», — в котором были собраны результаты большей части его опытов, даже если они были мало подтверждены теориями. В этой книге Лавуазье применил структуру, предвосхищающую ту, которая используется сегодня в научных статьях: в первой части он рассматривал результаты, полученные другими учеными, некогда работавшими в той же области, а во второй детально описывал собственные выводы. Излагая свои результаты, Антуан сначала воспроизводил предыдущие и проверял, совпадают ли они с теми, что получили другие ученые, а также удовлетворяют ли его выводы, к которым пришли его коллеги. По мнению Гейлса и Блэка, воздух в «извести» был «фиксируемым», Лавуазье же считал, что речь идет об «обычном воздухе» или же о веществе, которое присутствует в этом обычном воздухе.
После публикации своего произведения Лавуазье продолжил опыты с использованием мощной линзы Чирнгаузена, которая после того, как он ее улучшил, позволяла получать ранее недостижимые температуры. С ее помощью он нагревал все доступные вещества с воздухом и без. Лавуазье хотел получить информацию о процессе горения и распада. Он уже предугадывал идею о том, что все твердые тела могут распадаться, если их нагреть до достаточно высокой температуры. Поэтому ученый использовал «солнечную печь» с целью нагреть все доступные ему простые и сложные вещества. Он хотел убедиться в своей давно вынашиваемой идее: тела не всегда сохраняют свое твердое или жидкое состояние, они могут менять данные состояния и даже образовывать «воздухи» при определенных температуре и давлении. В последнюю четверть XVII века утверждение о том, что флогистон является всего лишь плодом фантазии, было революционным, хотя сегодня нам это кажется очевидным.
За лето 1774 года Лавуазье расплавил множество металлов, но некоторые, такие как, например, платина, ему не поддавались. Сегодня мы знаем, почему так происходило: платина плавится при температуре примерно 1800 °С, а другие известные в то время металлы — при гораздо более низкой температуре: олово, например, при температуре 232 °С, свинец — при 327 °С, цинк — при 420 °С, а медь — при 1083 °С. Лавуазье пришел к справедливому выводу о том, что неудача с платиной связана с технической проблемой — он не смог получить достаточно высокой температуры, — а не с ошибкой в теории трех состояний материи, которая начинала у него вырисовываться.
Существует мнение, что ученые заняты только умственной деятельностью и не интересуются общественным признанием. Конечно, есть профессии, для которых известность имеет большее значение: например, карьера актера напрямую зависит от его популярности. Однако ученые тоже нередко стремятся к славе. Этого нельзя утверждать ни о Лавуазье, ни о его коллегах, зато можно сказать о Пристли, британском религиозном пасторе-отступнике, который вступил с Лавуазье в ожесточенную борьбу за право считаться первооткрывателем кислорода. Пристли был настолько злопамятен, что упорно отвергал предложения Лавуазье, призывавшего покончить с теорией флогистона. Это было еще более удивительно, поскольку Пристли, несмотря на различие взглядов с Лавуазье, был очень проницательным ученым. В данной области он осуществил больше опытов, чем кто-либо другой, и сделал вывод, что теория флогистона является абсолютно необоснованной. Даже ирландец Ричард Кирван (1733-1812), который страстно защищал данную теорию и являлся автором трактата о флогистоне, переведенного Марией для Антуана с английского, написал Лавуазье незадолго до его ареста, признав превосходство аргументов теории горения.
Карл Вильгельм Шееле (1742-1786) родился в Штральзунде (Швеция) и с детства работал в аптеках Гетеборга, Стокгольма и Мальмё. В 1755 году в возрасте 33 лет он скопил достаточно средств, чтобы реализовать свою мечту: купить собственную аптеку в Чё- пинге и беспрепятственно заниматься опытами. Шееле совершил множество открытий и был избран членом Шведской королевской академии наук, что позволило ему получить предложения стать профессором во многих европейских университетах. Но он предпочел остаться в своей аптеке и продолжать консультировать клиентов, работая по удобному для себя графику. Этим он занимался до конца своих дней.
Именно ему принадлежит пальма первенства среди химиков по количеству открытых природных элементов, таких как азот, кислород, хлор, марганец, молибден и барий. Однако Шееле приходится делить свои заслуги с другими учеными, поскольку свои открытия он обнародовал спустя много лет после их совершения. Это касается, например, открытия кислорода, который он получил впервые в 1772 году при разложении хлората калия. Но поскольку Шееле опубликовал свои результаты только в 1777 году, данное открытие приписывается Пристли. Последний получил кислород при нагревании оксида ртути в августе 1774 года. Кроме того, Шееле получил сульфат бария (шарик, который глотается перед рентгеноскопией желудка), органические соединения глицерина и лактозы, винную, лимонную, молочную, мочевую и щавелевую кислоты. Минерал вольфрамат кальция (CaWo4) называется «шеелитом» в его честь. Пытаясь выделить пигмент берлинской лазури, Шееле открыл опасную синильную кислоту (вкус и запах которой он точно описал) и арсин, самое ядовитое соединение мышьяка. Он первым обнаружил воздействие света на соли серебра — явление, лежащее в основе фотографии. Но известность шведскому аптекарю принесло открытие зеленого пигмента, или гидроарсенита меди (CuHAsO3), который использовали такие знаменитые художники, как Джозеф Тернер и Эдуард Мане. Преждевременная смерть Шееле в 43 года была прямым следствием его опытов, хотя нам точно неизвестно, что послужило ее причиной: отравление (Шееле, как и многие химики того времени, имел привычку смело пробовать на вкус открытые им химические вещества) или несчастный случай в лаборатории.

Пристли и Лавуазье, кажется, оба забыли, что на самом деле открыл кислород шведский фармацевт Карл Вильгельм Шееле, который и сегодня сохраняет пальму первенства по количеству открытых элементов и соединений. У нас нет доказательств, что Пристли знал об открытии Шееле; зато Лавуазье должен был знать о нем, поскольку в сентябре 1774 года, когда он обратился к изучению газа, он получил письмо от шведского ученого. Шееле рассказывал ему о своих исследованиях этого «воздуха», и хотя Лавуазье так и не отозвался на послание шведского ученого, оно сохранилось в его архиве.
В начале 1774 года французский химик Пьер Байен (1725— 1798) сообщил, что mercurius calcinatusperse, также известный как оксид ртути, превращается в металл при простом нагревании, без использования угля. Его вывод расстроил Лавуазье, поскольку теория флогистона (который обязательно должен был быть привнесен углем) в таком случае оказывалась несостоятельной. С другой стороны Ла-Манша Джозеф Пристли проверил установленное Байеном явление, но, будучи знатоком искусства собирания «воздухов», он заметил в этом опыте еще более интересные явления.
В августе того же года лорд Шельбурн вместе с Пристли, который работал в то время у лорда как библиотекарь и «философский компаньон», взяли курс на континент. В октябре они добрались до Парижа, где члены Академии наук приняли Пристли с почетом, подобающим уважаемому британскому ученому. Двумя годами ранее Пристли получил престижную медаль Копли от Королевского общества в знак признания его открытий различных «воздухов» и за изучение электричества. Лавуазье особенно интересовал его приезд, поскольку Пристли развил и улучшил методы своих соотечественников Гейлса и Блэка в области пневматической химии, что позволило ему получить самые продвинутые результаты в данной сфере. Лавуазье сердечно принял его не только в Академии наук, но и в собственном доме. Там преподобный Пристли приятно удивился, найдя в лице мадам Лавуазье отличного переводчика: к тому времени она уже бегло говорила по-английски.
Во время этого визита Пристли и Лавуазье обменялись информацией об опытах, которые они осуществляли, в частности об опытах с горением. Скорее всего, Лавуазье рассказал ему об экспериментах с линзой Чирнгаузена. Пристли располагал гораздо более скромными средствами, чем его французский коллега, но после поступления на службу к лорду Шельбурну он начал оборудовать достойную лабораторию. У него также появилось больше времени для занятий в ней, а нехватку средств он компенсировал воображением и исключительной работоспособностью.

РИС. 2
Один из опытов, который Пристли осуществил 1 августа, незадолго до своей поездки во Францию, особенно вдохновил его, поскольку у него появилось предположение, что он нашел доказательство существования нового «пневматического тела». Пристли нагрел mercurius calcinatusperse и получил, использовав метод Гейлса, «воздух» с особыми свойствами.
Данный опыт представлял большой интерес, поскольку, в отличие от оксидов других металлов, которые для уменьшения нуждались в угле, оксид ртути уменьшался просто от нагревания до 400 °С, при этом выделяя чистый кислород:
HgO (твердое вещество) →Hg (жидкое вещество) + O2(газ).
Протестантский пастор Джозеф Пристли (1733-1804) не признавал английского короля как главу Церкви, из-за чего лишился многих прав, среди которых было и получение университетского образования. Однако он был очарован электричеством и начал свою научную карьеру со встречи с Бенджамином Франклином (1706- 1790), убедившим его опубликовать трактат об электричестве, который Пристли писал в тот момент, и следовать своему научному призванию. Американец оставался научным и личным примером на протяжении всей жизни для Пристли, который достиг звания самого большого авторитета в пневматической химии Англии. Улучшая скромные установки, разработанные его соотечественниками Гейлсом, Мейоу и Блэком для сбора «воздуха», ученый открыл и проанализировал больше воздухов, чем кто бы то ни было: оксиды азота (NO, NO2 и N2O), хлороводород (HCl), сернистый ангидрит (SO2), составные части «обычного воздуха» (1М2 и O2), аммиак (NH3) и смертельный угарный газ (СО). Как и Лавуазье, Пристли полагал, что наука должна основываться на опытах, а не на абстрактных измышлениях, и наравне со своим французским коллегой считал научные знания залогом процветания общества — такие идеи считались тогда революционными. Пытаясь установить отношения между наукой и промышленностью, он открыл способ приготовления сельтерской воды, которая до этого являлась роскошью, уготованной тем, кто мог себе позволить воды, полученные из природных источников. Однако Пристли оказался менее проницательным в отношении теории флогистона, которую он защищал даже больше, чем ее изобретатели. В сфере политики он поддерживал американскую войну за независимость и французскую революцию. Из-за религиозных верований или политических убеждений отношения Пристли с членами Королевского общества ухудшились, что в итоге привело к его эмиграции в американские колонии. При посредничестве Франклина, договорившегося о нескольких его выступлениях в научном обществе Филадельфии, Пристли получил предложения из самых престижных университетов. Он подружился с Джорджем Вашингтоном и стал научным советником Томаса Джефферсона, в эпоху правления которого, в 1804 году, Джозеф Пристли скончался.

Красная известь получалась при нагревании ртути с кислородом до 350 °С.
Пристли заразил Лавуазье своим энтузиазмом даже больше, чем того хотел. По его рассказу, он положил calcinatus в небольшую емкость, расположенную на ртути, которая содержалась в стеклянном колпаке, перевернутом вверх дном. Этот колпак, в свою очередь, находился в другой емкости, также содержавшей ртуть, как мы могли видеть на рисунке 2. Нагрев его с помощью фокусирующей лупы (гораздо меньшей по размеру и менее совершенной, нежели гигантская лупа Академии), он получил особый «воздух», пригодный для дыхания и раздувавший огонь свечей.
Пристли решил продолжить опыт, чтобы определить «доброкачественность» «обычного воздуха», так как он заметил, что этот воздух пропорционально взаимодействует с «азотистым воздухом». Он использовал прибор, показанный на рисунке 3: образовывавшиеся вещества имели меньший объем, а вода, поднимавшаяся по перевернутой трубке, показывала, что пятая часть изначального воздуха исчезла. То, что Пристли называл «азотистым воздухом», мы сегодня знаем как NO, который при взаимодействии с кислородом из воздуха превращается в NO2. Исходного вещества 3 моля, а получившегося — всего 2, что объясняет уменьшение объема на треть, которое констатировал Пристли.
2NO (газ) + O2(газ)→2NO2(газ).
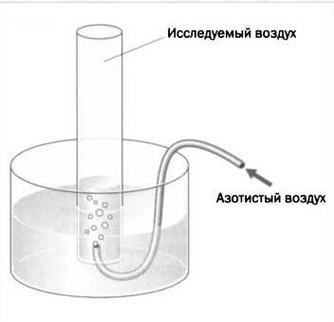
РИС.З
Сегодня мы знаем, что такое уменьшение объема связано с потреблением всего кислорода, который составляет 20% общего объема воздуха. Чтобы понять это, Пристли использовал мышей для определения «доброкачественности» воздуха, но результаты не совпадали, поскольку некоторые мыши умирали в два раза быстрее, нежели другие, хотя все они дышали «воздухом» одного качества.
Когда Пристли использовал метод «азотистого воздуха» для определения качества «воздуха», полученного вследствие нагревания оксида ртути, он заметил, что выделившийся воздух был гораздо лучше «обычного воздуха» (так как состоял на 100% из кислорода). По возвращении из Франции в Англию Пристли повторил опыт с оксидом ртути, который подтвердил, что при наличии такого воздуха мыши могут жить гораздо дольше, нежели при «обычном», что пламя свечи горит сильнее, а дерево сгорает быстрее.
Он попробовал сам дышать этим воздухом и понял, что не испытывает отличных ощущений от тех, когда дышит «обычным воздухом». Тем не менее ему показалось, что его легкие стали легче, и ученый предсказал: этот «чистый воздух» в дальнейшем может использоваться для лечения больных с легочными заболеваниями. Он заявил, что «на сегодняшний день только у двух мышей и у меня была возможность подышать этим воздухом». Как мы видим, химики того времени были очень отважными: они вдыхали новое полученное вещество, убедившись в его безвредности всего лишь на опыте с двумя мышами.
Близкое знакомство с тем, что было сделано до нас, может существенно облегчить наши будущие проекты. Возможно, это знакомство для них даже необходимо.
Джозеф Пристли
Теория флогистона предполагала, что воздух обладает некоторой способностью поглощать флогистон, который выделяется как при горении, так и при дыхании, а когда насыщается им до предела (как пропитанная губка), уже не может ничего поглощать, и поэтому животные умирают, а огонь гаснет. Поскольку от «воздуха», получавшегося в результате нагревания оксида ртути, свечи горели лучше, а мыши жили дольше, Пристли предположил, что в нем совершенно не содержалось флогистона, поэтому он назвал его «дефлогистированным воздухом», то есть освобожденным от флогистона, который выделяется от огня печей и при дыхании. В знаменитом письме 15 марта 1775 года Приели утверждал, что выделяемый при нагревании оксида ртути воздух, который он исследовал с помощью «азотистого воздуха», в пять-шесть раз лучше для дыхания, нежели нормальный или атмосферный воздух.
Тем временем во Франции Лавуазье повторил опыт Пристли с оксидом ртути, чтобы проверить гипотезу о том, что извести металлов содержат воздух, образующийся во время горения и отличный от «фиксируемого воздуха». Он предположил, что «воздух», содержащийся в этих известях (сегодня мы знаем, что речь идет о кислороде), существенно отличается от того, который выделяется при нагревании их с углем и называется «фиксируемый воздух» (СO2).
Существование извести ртути (оксида ртути), которая не нуждалась в угле для восстановления, было самым простым доказательством существования нового воздуха. Лавуазье предположил, что вес фосфора и серы увеличивался по тем же причинам во время их окисления. Когда ученый опубликовал свои «Небольшие исследования» в 1774 году, он еще не был уверен, что воздух, выходивший из металлов во время горения, является «фиксируемым воздухом», «обычным воздухом» или другим «чистым воздухом», содержащимся в атмосфере.
В мае 1775 года, повторив опыт Пристли и интерпретировав результаты с точки зрения своей изначальной гипотезы, Лавуазье опубликовал отчет, в котором склонялся к своей гипотезе: то, что выделялось из металлов и образовывало известь, было «в высшей степени удобовдыхаемым воздухом». Содержание отчета было очень похоже на опубликованное Пристли, за одним исключением: Лавуазье не ссылался на теорию флогистона, она ему была не нужна.
Он также не упомянул и о недавних экспериментах Пристли с оксидом, хотя его опыты были по сути такими же, потому что англичанин лично рассказал о них Лавуазье во время пребывания во Франции в октябре 1774 года. Лавуазье был крайне щепетилен в том, что касалось признания заслуг каждого ученого; тем удивительнее это его упущение. Из-за него некоторые ученые дошли до того, что поставили под сомнение авторство всех открытий Лавуазье, и споры об этом не утихали и после его смерти.
До открытия теории горения Лавуазье был призван на новую государственную службу. После смерти Людовика XV и восхождения на трон Людовика XVI в 1774 году физиократ Жак Тюрго (1727-1781) сменил на посту главы финансов аббата Терре. В результате многих лет растрат и плохого управления государственная казна была пуста. Одной из огромных статей расходов являлось оснащение армии боеприпасами. В теории государство гарантировало поставки компании, обладающей монополией на производство пороха, но в реальности плохие условия контракта не позволяли обеспечить французскую армию в достаточном количестве «национальным» порохом, который к тому же был очень посредственного качества. Поэтому государство было вынуждено покупать порох за границей по очень высоким ценам, тогда как французская компания продавала свою лучшую продукцию с аукциона, в том числе и врагам Франции. Эта неразбериха со снабжением порохом сыграла определенную роль в ужасном конце семилетней войны в 1763 году, в результате которой Франция лишилась почти всех своих американских колоний.
Причины проблем с производством пороха были многочисленны: цена была занижена, что делало продукцию нерентабельной с экономической точки зрения, но поскольку контракт с поставляющей компанией не предполагал санкций за неисполнение обязательств, то улучшать продукцию было незачем. Однако главная сложность заключалась в изготовлении одной составляющей — селитры (KNO3). С получением двух других — серы и угля — проблем не было. Французская армия оказалась заложником производителей селитры, которые, зная об этой ситуации, требовали чрезмерно высокую цену и не пересматривали ее в зависимости от размеров поставки.
Чтобы решить данную проблему, Тюрго создал Управление порохов и селитр, призванное следить за всем процессом, и поставил в его главе четырех руководителей, одним из которых был Лавуазье. Перед ними стояла трудная задача. Они сразу же были вынуждены потратить 4 миллиона ливров на выплату неустойки по разрыву контракта с компанией, отвечавшей до этого момента за поставки пороха. Перед руководителями стояло несколько задач: помимо улучшения качества и увеличения количества пороха, они должны были получить прибыль для министерства финансов благодаря монополии на производство и продажу. Дополнительная задача — избавить страну от зависимости от производителей селитры. За свой тяжелый труд руководители Управления получали зарплату 2400 ливров в год, плюс покрытие расходов. Работа Управления порохов и селитр была необыкновенно действенной, и меньше чем через два года половина суммы, выплаченной компании, ответственной ранее за производство пороха, была возмещена.
Однако нехватка селитры сохранялась, это вещество добывалось главным образом из навоза. Следуя примеру правительств других стран, Лавуазье распорядился провести исследования в шахтах и разработать меры для более действенного способа сбора навоза из хлевов. Академия наук назначила комиссию, призванную наблюдать за процессом на национальном уровне, и Лавуазье участвовал в ее работе. В данной области он также провел существенные улучшения, и Франция перестала испытывать нехватку пороха: наоборот, теперь его хватало с избытком.
В сентябре 1775 года отец Лавуазье умер от сердечного приступа в своем имении в Бурге. Ученый был крайне опечален этим событием и особенно тем, что не смог быть рядом с отцом в его последние дни. Позднее он писал, что потерял своего лучшего друга. Но Лавуазье не мог долго оплакивать отца, его звала работа.

Г равюра из книги Лавуазье «Элементарный курс химии», изображающая приборы для измерения газов. В центре — газометр.

Лаборатория в Арсенале, рисунок Марии Лавуазье. Антуан стоит спиной; Мария, сидящая за столом справа, записывает результаты опыта; один из помощников Лавуазье, возможно Арман Сеган, дует в трубку, чтобы собрать газ из легких.
Назначение на должность в Управление порохов и селитр повлекло за собой еще одно большое изменение в жизни Антуана: он переехал на свое рабочее место, в Арсенал, в одном из помещений которого оборудовал лабораторию и снабдил ее лучшими измерительными приборами, предназначенными для новой науки. Часть из них он разработал сам, все остальное было куплено на его личные деньги.
Выйдя замуж за Лавуазье, Мария Польз не отказалась от своей девичьей фамилии, что не так часто случается и в наши дни; став вдовой, она оставила себе фамилию Лавуазье, несмотря на то что снова вышла замуж — за Бенджамина Томпсона, графа де Румфорда. В своем первом браке Мария быстро поняла, что если она хочет видеть мужа, то должна искать его в лаборатории. Дни активного члена Генерального откупа и Академии наук были заполнены собраниями и написанием отчетов. Но существовали и священные часы: с 6.00 до 9.00 и с 19.00 до 22.00 Антуан работал в лаборатории. Мария решила присоединиться к нему и стала его верным ассистентом, будучи при этом еще и прекрасной хозяйкой дома, способной занять гостей разговором на английском языке, которым она бегло владела. Многие из них были приятно удивлены встрече с очаровательной женой Лавуазье, которая, к своим прочим достоинствам, хорошо разбиралась в таких неженских предметах, как теория флогистона. И это неудивительно: Мария перевела с английского «Очерк о флогистоне и о конституции кислот» Ричарда Кирвана, снабдив перевод собственными комментариями. Кроме того, она переводила многочисленные письма, которыми ее муж обменивался с ирландским ученым. Но без всяких сомнений, наибольшее восхищение у нее вызывал Бенджамин Франклин. Мария нарисовала его портрет, который очень понравился американцу. Когда англичане конфисковали у него этот портрет — Великобритания в то время вела войну с колониями, а Франклин имел вес в повстанческом правительстве, — американский ученый говорил, что почувствовал себя овдовевшим, лишившись столь дорогой компании. Художественные таланты Марии пошли еще дальше: она сыграла жрицу, приносящую флогистон в жертву на алтарь новой науке в комическом спектакле, придуманном Антуаном.

Мария, Антуан и один из помощников. Рельеф XIX века, автор Луи-Эрнест Барриа (музей изящных искусств Гренобля).
Прошло четыре года со того времени, как Мария и Антуан сыграли свадьбу. Детей у них не было, домашними делами занималась тетя Констанция, и Мария не испытывала недостатка во времени, продолжая помогать мужу. Она прилежно ассистировала ему в лаборатории и участвовала в дебатах по химии, которые там проходили. Для нее не составляло труда поддерживать такие разговоры, поскольку к занятиям английским языком и рисунком Мария добавила изучение химии. Сначала этой науке ее обучал супруг, но потом она получила более формальное образование в школах, а также с помощью уроков Буке, молодого помощника Лавуазье.
Лаборатория в Арсенале служила одновременно исследовательским центром и салоном, который посещали самые видные люди эпохи. Среди них были философ Жан-Жак Руссо, математики Жан Антуан де Кондорсе и Пьер Симон де Лаплас, главный редактор «Энциклопедии» Дени Дидро, химик Клод Луи Бертолле, американский политик и ученый Бенджамин Франклин, единственный человек, не носивший белый парик при дворе короля Людовика XVI.
Главным источником сведений о деятельности лаборатории являются рисунки Марии, запечатлевшие ее рабочий день; на одном из них изображен Лавуазье, его помощники и сама Мария, ведущая записи. Другой источник — рассказы тех, кто регулярно или периодически посещал эту лучшую на то время химическую лабораторию Европы, а значит и всего мира. В салоне говорили о философии, искусстве, музыке, театре и политике, но главной темой все же была наука. Лавуазье не просто так занимался оборудованием лаборатории, в которой он мог наиболее точно измерять любые показатели вещества, главным из которых была масса.

РИС. 4
Весы Лавуазье являлись самым ценным инструментом, именно благодаря им он проложил дорогу новой науке. В лаборатории Арсенала были стеклянные и металлические инструменты, печи и другие нагревательные устройства, позволявшие осуществлять любые процессы искусства, включая дистилляцию, окисление, разложение и соединение, описанные другими учеными. Эти операции производились с твердыми веществами, жидкостями или «воздухами», измеряемыми с помощью газометра. Самые важные инструменты, используемые в лаборатории, были нарисованы Марией, и их изображения появились в качестве иллюстраций в главном труде Лавуазье — «Элементарном курсе химии» (1789). А чтобы нарисовать все инструменты, потребовалась бы целая армия художников: при конфискации было насчитано более 13000 приборов...
Так же как было и с предыдущими службами Лавуазье, работа в Управлении порохов и селитр не заставила его забросить изучение химии, особенно с тех пор, как в его распоряжении появилась необыкновенная лаборатория. В течение 1776-1777 годов он продолжал заниматься опытами, которые должны были прояснить природу горения, и для этого Лавуазье много раз повторил эксперимент с получением кислорода из оксида ртути. Он получил известь, нагревая ртуть с помощью прибора, изображенного на рисунке 4 (стеклянная реторта, расположенная на конвенционной печи, содержащая ртуть; ее нижняя часть изогнута и входит в наполненный воздухом колпак). Это был самый известный опыт в истории химии, детально описанный апостериори в его «Элементарном курсе химии». В данном описании, фигурирующем в приложении, мы можем оценить ясность изложения Антуана и обилие деталей, то есть наличие всей необходимой информации для любого ученого, который бы собрался воспроизвести этот опыт. Его результаты схематично можно изложить следующим образом:
Ртуть + удобовдыхаемый воздух =
= оксид ртути.
Оксид ртути - то же количество удобовдыхаемого воздуха =
= ртуть.
Мы сегодня описываем эту реакцию так:
Ртуть + кислород = оксид ртути.
Оксид ртути = ртуть + кислород.
Или, используя усовершенствованные обозначения, предложенные Лавуазье:
Hg (жидкость) + O2 (газ) ↔ HgO (твердое вещество).
Кроме того, Лавуазье объяснил, что атмосфера, известная до этого как «обычный воздух», состоит из в высшей степени удобовдыхаемого воздуха и части, непригодной для дыхания, которая сегодня называется азотом.
В апреле 1777 года Антуан послал в Академию наук первый законченный вариант теории горения. В том же году он представил еще восемь отчетов, в которых описывал процесс образования извести и ее уменьшения в ходе образования металла. Оксид ртути был самым простым примером, демонстрировавшим реакцию, происходившую во время окисления металла и уменьшения извести (что соответствовало потере или приобретению флогистона), для этой реакции не нужен был уголь. Но, как его называли, «в высшей степени удобовдыхаемый воздух» наличествовал во всех «известях» (которые мы сегодня знаем как оксиды), бывших в то время предметом изучения и по большей части нуждавшихся в угле (источник флогистона), чтобы уменьшаться и образовывать металл. Данные работы ознаменовали начало конца теории флогистона.
[...] Сохранять только факты, которые являются истинными данными Природы и которые не могут обманывать; [...] искать истину только в череде опытов и наблюдений.
Антуан де Лавуазье
В 1778 году Лавуазье вынужден был много разъезжать, инспектируя работу заводов по производству пороха и источников селитры. Во время таких путешествий ему на глаза попадалось множество имений, и в одном из них, расположенном во Фрешине, возле Блуа, Антуан решил осуществить свой самый честолюбивый эксперимент по изучению методов улучшения животноводства и сельского хозяйства с помощью научного метода.
Учитывая это новое занятие, в 1778 году, когда Лавуазье купил имение во Фрешине, он представил в Академию наук только один отчет, связанный с изучением горения: описание состава «фиксируемого воздуха», открытого Блэком несколькими десятилетиями ранее и выделенного Пристли и другими учеными. Лавуазье неопровержимо заключил: раз извести (МО) состоят из металла (М) и удобовдыхаемого воздуха (О) и при нагревании извести с углем (С) они образуют металл и «фиксируемый воздух», то этот последний состоит из удобовдыхаемого воздуха и угля.
Более точно:
МО (твердое вещество) + С (твердое вещество) ↔
↔ М (твердое вещество) + СO2 (газ).
В ноябре 1779 года творческий гений Лавуазье развернулся в сторону лингвистики: он создал новое слово. Снова проанализировав результаты своего опыта, он обнаружил воздух, который образовывал все кислоты — кислоту серы, фосфора, угля и азота. Лавуазье решил придумать ему название, которое говорило бы о его способности образовывать кислоты. В итоге появилось слово «оксиген», состоящее из двух греческих корней: οξΰς («кислота») и γενής («рождаю»). Таким образом, оно означало «порождающий кислоту»[1 В русском языке используется слово «кислород», появившееся как калька термина «оксиген» (Примеч. ред.).].
В отличие от Пристли и Шееле, Лавуазье не работал с «соляной кислотой», также известной под названием «кислоты соли», морской кислоты или HCI по номенклатуре Лавуазье (Шееле использовал ее для получения хлора). Из-за этого он совершил ошибку при выборе названия для чистого воздуха: HCI доказывала, что его идея была ошибочна, так как, согласно ей, кислород необходим для образования кислоты. Но ошибка осталась без последствий: вскоре слово «оксиген» утвердилось во всех языках, на которых говорила наука. С этого момента не только химия, но и сама жизнь не могли обходиться без кислорода.
Существует несколько современных работ, которые проясняют происхождение данного понятия. Одна из них — театральная пьеса «Кислород» (2001) химиков Карла Джерасси и Роалда Хофмана, в которой рассказывается о полемике по поводу открытия кислорода, приписываемого Пристли, Лавуазье и Шееле.
Вскоре после смелого предложения слова «оксиген», гениальность которого со временем станет очевидной, в жизни Антуана произошло еще одно событие, на этот раз печальное. В 1781 году умерла его тетя Констанция Пунктис, женщина, заботившаяся о нем после смерти матери. О горе Лавуазье свидетельствует его письмо Бенджамину Франклину:
«Причина, оправдывающая мое опоздание, — такого рода, что, уверен, заслужит Вашего прощения. Я имел несчастие потерять свою тетю, которая стала мне второй матерью и к которой я был нежно привязан. Это грустное событие полностью поглотило меня, и я отложил многие дела».
Лавуазье, будучи членом Академии наук, участвовал в работе порядка сотни комиссий и занимался самыми разными вопросами. Так, в конце 1783 года он изучал аэростаты братьев Монгольфье, сконструированные ими из большого куска ткани. Аэростаты поднимались с помощью горячего воздуха — менее плотного, нежели холодный. Первый полет состоялся без экипажа.
Второй — с бараном, петухом и уткой — был произведен над двором Версаля в присутствии сотен тысяч зрителей, среди которых находились король Людовик XVI и королева Мария-Антуанетта. Но самый важный полет состоялся позднее:
21 ноября 1783 года Франсуа Пилатр де Розье и Франсуа Д’Арланд первыми в истории человечества поднялись в небо на воздушном шаре.
Комиссия Академии в декабре составила отчет, содержавший рекомендации по конструкции аэростата и используемым материалам, а также по наполнявшему его газу (которым мог быть водород, поскольку он намного легче воздуха и не нуждается в нагревании) и по корзине для пассажиров. Пилатр де Розье осуществил еще несколько полетов на все более длинные расстояния и на большей высоте. Он погиб при попытке пересечь Ла Манш в июне 1785 года и стал, таким образом, первой жертвой воздушной катастрофы.

Первый полет людей на воздушном шаре, который совершили Франсуа Пилатр де Розье и маркиз Д’Арланд 21 ноября 1783.
Мы видим один из редких случаев, когда в своих более чем многочисленных документах ученый говорит о чувствах. Но, как и после смерти отца, Антуан не мог надолго позабыть обо всем и оплакивать свою потерю. Хотя основы новой теории горения были заложены, она должна была быть принята научным сообществом. Только сам Лавуазье мог осуществить эту задачу — благодаря уже не своим лабораторным опытам, а докладам в Академии наук. В 1783 году он послал туда свой труд «Размышления о флогистоне» (опубликованный в следующем году), в котором рассматривал предыдущий опыт других ученых и подводил итог собственным исследованиям процесса горения. В данной работе Лавуазье выступил в качестве историка, который очень тщательно, как, впрочем, и всегда, описал все предыдущие проведенные опыты и используемые для объяснения этих опытов теории, вне зависимости от того, был он лично с ними согласен или нет, о чем он уважительно уведомлял читателя. Только однажды Лавуазье позволил себе иронию:
«Химики превратили флогистон в общее начало, которое не имело четкого определения, а следовательно, подходило для любого объяснения, в которое его нужно было включить: это начало то имело вес, то не имело; то представляло собой свободный огонь, то огонь, соединяющийся с земными элементами; то флогистон проникал через поры сосудов, то сосуды были для него непроницаемыми... Истинный Протей, меняющий форму каждое мгновение».
В конце Лавуазье сформулировал цель своего труда:
«[...] все явления горения и обжигания гораздо проще и легче объясняются без флогистона, нежели при помощи него. Я не жду, что мои идеи будут приняты сразу же; человеческий разум устроен так, что те, у кого была своя устоявшаяся точка зрения на устройство Природы, с трудом обращаются к новым идеям; поэтому только время подтвердит или опровергнет изложенное мной мнение; пока же я с огромным удовлетворением вижу, что молодые люди приступают к Науке без предубеждений, что математики и физики основываются отныне на химических истинах и больше не верят во флогистон...»
Генри Кавендиш (1731-1810) разделял стремление Лавуазье к познанию окружающего мира. Но в отличие от французского ученого, который вникал во все вопросы и стремился улучшить все, с чем он соприкасался, Кавендиша интересовали только некоторые ученые из Королевского общества и Королевского института; женщин же он просто не выносил.
Еще меньше его волновала слава, он не стремился попасть в вечность. Зато Кавендиш испытывал подлинный интерес к некоторым вещам, таким, например, как плотность Земли и воздуха, силы, заставляющие притягиваться вещества с противоположным электрическим зарядом, или состав атмосферы, которая, по его убеждению, состояла из множества «электрических тел». Чтобы узнать все это, он провел бесчисленное количество невероятно точных измерений с помощью разработанных им самим приборов. Поскольку ему не нужно было думать о средствах к существованию (несмотря на то что выглядел он как нищий, Кавендиш являлся самым богатым человеком Англии благодаря полученному наследству, составлявшему более миллиона фунтов), он мог все свое время посвящать науке. Однако ученый не спешил публиковать свои исследования: на самом деле лишь малая часть его результатов была обнародована при его жизни. Другие результаты, невероятно достоверные, в таких разных областях знания, как магнетизм, механика, оптика или химия, были обнаружены в его лабораторных записях много лет спустя после его смерти.

Первые опубликованные им работы в области химии касались вещества, именуемого им factotius, то есть газа, который выделялся из твердых тел. Кавендиш получил такой газ в ходе реакции кислоты и металла; он по понятным причинам назвал его «горючим воздухом», а Лавуазье переименовал его в hydrogene (в русском языке «водород»). Кроме того, Кавендиш интересовался одним из «тел», которое привлекало и внимание Лавуазье, — водой. Английский ученый первым открыл, что вода не является простым телом, и правильно определил ее составляющие, хотя и назвал их очень странным образом. Кавендиш умер позже Лавуазье, в 1810 году, и совсем по-другому: в своей постели и в полном одиночестве.

РИС. 5
Прибор, использованный для получения Н2, позволяющий пропустить воду через раскаленное железо.
Хотя публикацией этого труда Лавуазье, казалось, окончательно прояснил явление горения, сама реакция ускользала от его понимания. Никто не знал, что происходит, когда «горючий воздух» (Н2) горит в «обычном воздухе» (02 + N2) или даже в кислороде (02). Казалось, что он исчезает без следа. Английские укротители воздуха — сначала Пристли, а затем Кавендиш — смогли сжечь его, и оба обратили внимание на то, что после горения появляются крошечные капельки росы, но сам газ исчезает и не заменяется никаким другим. Когда Пристли проводил опыт, он заметил, что газы соотносились как 2: 1, но поскольку в своем опыте он пытался понять, имеет ли огонь массу, он не обратил внимания на росу. А Кавендиш заинтересовался ей. Он попробовал ее на вкус, что было обычным делом в ту эпоху, поскольку лаборатории не располагали современными средствами для химического анализа. Например, Шееле попробовал на вкус синильную кислоту, когда получил ее в первый раз. Кавендиш пришел к выводу, что «роса» менее опасна, чем HCN: это простая вода.
Кавендиш представил невероятное объяснение наблюдаемому им явлению: он сказал, что «горючий воздух» (Н2) состоит из флогистона, соединенного с водой, а «дефлогистированный воздух» (O2), названный так Пристли, — на самом деле вода, лишенная флогистона. При зажигании искры в емкости, содержавшей два воздуха, первый выпускал свой флогистон, который поглощался вторым, и появлялась вода, присутствующая в обоих газах. Ему не пришла в голову наиболее очевидная гипотеза о том, что оба воздуха, как бы они ни назывались, во время реакции образовывали новое жидкое вещество.
Лавуазье знал о результатах опытов Кавендиша от его ассистента Благдена, который в июне 1783 года находился в Париже. В отличие от английских ученых, Лавуазье понял, что происходило: вода образовывалась вследствие взаимодействия двух газов:
Н2(газ) + ½O2(газ)→Н2O (жидкость).
Из этого результата он сделал очевидный вывод, разрушивший одну из основ алхимии, которая считала, что вода является одним из начальных элементов. Вода была не простым телом, а соединением. Лавуазье сразу же провел свои опыты и меньше чем через месяц послал в Академию наук записку о результатах получения воды из «горючего воздуха». В этом документе, подписанном также Лапласом, Пристли не был упомянут, равно как и Кавендиш, о результатах которого Лавуазье знал от Благдена. Кавендиш оскорбился и набросился на Лавуазье, обвинив его в незаконном присвоении чужих результатов, что привело к расколу ученых Европы на два лагеря.
Со временем споры утихли, но имя Лавуазье оказалось запятнанным. На самом деле ни Кавендиш, ни Пристли не смогли сделать правильные выводы из своего эксперимента, однако первыми осуществили этот опыт именно они, а Лавуазье только последовал за ними. Хотя в те времена коммуникация была сильно затруднена, над «воздухами» работала очень узкая группа химиков, потому рано или поздно все они узнавали, что сделали и опубликовали их коллеги. Несмотря ни на что заслуга открытия состава воды была приписана Кавендишу, однако за Лавуазье закрепилось «звание», ни много ни мало, отца химии.
Лавуазье продолжил исследования, и чтобы убедиться в том, что он действительно получил воду, он провел опыт наоборот: разложил ее. Ученый довел процесс до конца очень изобретательным способом: он пропускал водяной пар над печью с раскаленным добела железом, используя прибор, схематично изображенный на рисунке 5 (стр. 76). Лавуазье предположил, что раз вода содержит кислород, то он должен поглощаться железом для образования извести. Процесс оказался более сложным, нежели он его представлял, поскольку в воде и извести кислород находится в одном состоянии, то есть как анион (О-), а в воздухе — в другом (О°2) (индексы обозначают количество лишних электронов). Но опыт сработал, потому что железо повело себя как катализатор, разложивший воду на ее составные элементы (Н2 и О2), после чего оно вступило в реакцию с одним из них (О2), образовав (Fe2О3), другой же элемент (Н2) остался свободным.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ