4. Клинические аспекты чумы
4.1 Общая картина патогенеза
Заражение человека чумой может происходить через различные входные ворота: кожу, слизистые оболочки глаза, рото-глотки, дыхательных путей, желудочно-кишечного тракта, что в значительной мере определяет клиническую форму заболевания. Тем не менее независимо от места и характера первичных изменений все формы имеют выраженную тенденцию к генерализации процесса, которая часто приводит к сепсису.
Как указывал В. Н. Лобанов [1956], «в подавляющем большинстве случаев в области заражения не происходит видимых изменений. Правда, известны отдельные вспышки и эпидемии, при которых первичные изменения кожи наблюдались у большого числа больных». К ним, в частности, относятся вспышки, описанные T. Butler [1983]. В общем, по данным Г. П. Руднева [1938], на долю кожной формы чумы приходится лишь 3–4 % всех случаев. Причина этого до сих пор не ясна. Возможно, прав был Н. Н. Жуков-Вережников [1945], который отсутствие местных изменений связывал с «фибринолизином» чумного микроба, препятствующим образованию «более или менее плотной фибринозной структуры воспалительного очага». Действительно, многие исследователи, занимавшиеся патологической анатомией чумы, неоднократно отмечали почти полное отсутствие фибрина в воспалительных очагах.
Из всех кожных пороявений при чуме наиболее примечательным является карбункул. Его развитию предшествует подвижный инфильтрат, довольно отчетливо выступающий над поверхностью кожи. Затем вокруг него образуется обширный отёк. Очаг становится плотным, напряженным, над ним возникает везикула или папула, а позднее он подвергается некрозу.
Согласно Н. Н. Жукову-Вережникову[1945], последующее развитие бубонной чумы осуществляется путем переноса её возбудителя: а) током лимфы от места внедрения в организм до регионарного фагоцитарного барьера — лимфатического узла; б) кровью — от регионарного лимфатического узла до «кровеносного барьера» ретикуло-эндотелиальной системы — селезенки и печени (стадия бактериемии); в) от селезенки и печени до «забарьерных клеточных систем» (генерализация).
Заболевание может остановиться на любой стадии, но все же «чаще имеет тенденция в переходу в третью».
Проникнув в регионарный лимфатический узел, микроб интенсивно размножается и вызывает воспалительный процесс с геморрагической инфильтрацией, который захватывает все соседние лимфатические узлы и прилегающую к ним подкожную клетчатку; образуется своеобразный конгломерат, составляющий первичный бубон первого порядка. Если же Y. pestis, прорвав этот барьер, током лимфы переносится в другие лимфатические узлы и вызывает в них воспаление, то возникают первичные бубоны второго порядка. Число лимфатических узлов, вовлекаемых в патологический процесс, варьирует и зависит от «той площади, с которой собирает лимфу данный узел» [Руднев Г. П., 1970], а их локализация связана с местоположением входных ворот, которые из-за частого отсутствия лимфангитов при чуме иначе выявить трудно. Более тяжёлым считается прогноз при развитии шейных шейных (они чаще бывают у детей), подмышечных и паховых бубонов.
В процессе развития бубонов, наряду с экссудативными изменениями, обычно происходит гиперплазия элементов РЭС, сопровождающаяся некробиозом и некрозом. При этом бубоны буквально заполнены микробами, которых особенно много в субкапсулярных синусах [Высокович В. К., 1897; Кишенский Д. П. и др., 1911; Пожариский И. Ф., 1911; Лобанов В. Н., 1956; и др.]. Аналогичная картина наблюдается в клетчатке, окружающей бубоны. В ней к тому же скапливается большое количество серозного или геморрагического экссудата, расслаивающего ткани. Здесь также видны огромные скопления бактерий, располагающиеся главным образом вокруг сосудов и капилляров. В последующем, если больной не погибает, может начаться нагноение бубонов. Некоторые авторы, например, T. Aoyama [1896], полагают, что это обусловливается не возбудителем, а вторичной микрофлорой. По данным В. Н. Лобанова, гнойная инфильтрация встречается очень редко; напротив, постоянно отмечается полное или почти полное отсутствие полиморфноядерных лейкоцитов. На этом основании он считал, отсутствие нагноения бубонов плохим прогностическим признаком.
Глубокие изменения в стенках кровеносных сосудов и капилляров в первичных бубонах в сочетании с множеством микробов внутри и вокруг них имеют важное патогенетическое значение, как фактор, определяюший бактериемию и развитие сепсиса.
В отличие от первичных бубонов вторичные развиваются гематогенным путем и их появление свидетельствует о начавшейся генерализации процесса. Вполне понятно поэтому, что они могут возникать всюду, где есть лимфатические узлы. Впрочем, тут нельзя не отметить оригинальную точку зрения Г. П. Руднева [1970]: «Бубоны (вторичные, примеч. авт.) могут быть не только бактериогенного (метастатического), но и токсигенного происхождения с отрицательными бактериологическими анализами…». Так или иначе, но изменения во вторичных бубонах бывают менее глубокими и обширными, чем в первичных. Как правило, вторичные бубоны не сопровождаются периаденитами, имеют меньшие размеры и бывают множественными. Причину этого легко понять, если вспомнить, что за генерализацией процесса часто следует летальный исход и вторичные бубоны не успевают полностью «созреть». Помимо вторичных бубонов, показателем начавшейся генерализации инфекции служит вовлечение в процесс печени и селезенки.
Что касается причин генерализации процесса, то здесь многое еще не ясно. Возможно, одна из них кроется в особой вирулентности микроба, преодолевающего на своем пути все барьеры. Иногда генерализация наступает, когда первичные бубоны уже сформировались (вторичный сепсис), а в других случаях она развивается в первые часы или 1 — 2-й день от начала заболевания (первично-септическая форма).
Кроме сепсиса, следствием генерализции является вторичная пневмония. С позиций эпидемиологии это самое серьезное осложнение бубонной чумы, поскольку больной становится непосредственным источником инфекции, причиной возникновения первичной лёгочной чумы с аэрозольным механизмом передачи возбудителя. Недаром Г. П. Руднев [1938] вторичную пневмонию относил к «внешне-диссеминированным» клиническим формам чумы.
Склонность к пневмониям при чуме мы связываем с двумя причинами. Во-первых, ей всегда сопутствует бактериемия, вследствие которой попадающий в кровоток возбудитель прежде всего сталкивается с легочной тканью, где он задерживается лимфатическим аппаратом. Во-вторых, судя по экспериментальным данным [Домарадский И. В., 1966], большую роль играет токсический фактор, для которого легкие являются locus minoris resistantiae. Последнее особенно важно. Иначе чем еще объяснить такие симптомы, как учащенное дыхание, чувство давления в груди во время вдохов, легкое покашливание и рассеянные сухие хрипы в легких даже при неосложненной форме бубонной чумы? С интоксикацией же, скорее всего, связан и отек легких, который «иногда развивается совсем неожиданно и поразительно быстро» [Руднев Г. П., 1938]. На это указывали еще К. Г. Доризо и М. И. Исакович [1912], причём они подчеркивали, что «отёк легких наступал и у таких больных, у которых не было явлений пневмонии». По наблюдениям Wu Lien-Teh и соавт. [1936], в отдельных случаях отёк легких может развиваться раньше, чем появляются бубоны, что расценивали как «пульмонарный» тип первичной пневмонии. Небезынтересно, что подобные поражения легких нередко наблюдаются и при экспериментальной чуме [Донсков В. В., 1944].
Долгое время считали. что основная причина гибели людей от чумы кроется в поражении сердца. «Чума убивает через сердце» — этот тезис красной нитью проходит через работы многих исследователей. Наряду с этим встречаются данные, согласно которым основная причина гибели людей усматривается в поражении сосудов.
Вопрос о том, что поражается в первую очередь — сердце или сосуды, имеет большое практическое значение, поскольку от правильного ответа на него зависит терапия больного. К сожалению, сердечную недостаточность с застоеем крови в венах перед сердцем (выше сердца по току крови) и сосудистую недостаточность с уменьшением поступления крови к сердцу раньше не всегда могли строго разграничивать. Однако, сейчас, когда стали доступны инструментальные методы обследования больных и проведены многочисленные эксперименты на животных [Домарадский И. В., 1966], основную причину расстройства кровообращения при чуме, как и при ряде других инфекций, стали относить к поражению сосудистого аппарата, а изменения деятельности сердца интерпретируют как результат развития cor pulmonale. Итоак, подтверждается мнение многих старых авторов о том, что смерть при чуме наступает в результате коллапса.
Весьма вероятно, что развитие сосудистых расстройств при чуме в значительной мере определяется поражением надпочечников, впервые описанным А. Н.Червенцовым [1904] и позднее служившим предметом изучения на животных В. В. Донсковым [1939]. По данным последнего, помимо разрушения клеток эндотелия капиллиров, в глаза бросаются изменения в клетках паренхимы коры и мозгового вещества надпочечников (зернистая и вакуольная дистрофия). Это особенно интересно в связи с данными А. Г. Кратинова и В. П. Гольмова [1959], согласно которым при смертельной чумной интоксикации у белых крыс в надпочечниках снижается содержание адреналина. К сказанному надо добавить и данные T. C. Montie [1981] о том, что «мышиный» токсин (см. выше) действует как β-адреноблокатор. Таким образом, поражения мозгового вещества надпочечников в сочетании с блокадой β-адренорецепторов токсином и повсеместными глубокими морфологическими изменениями в кровеносных сосудах вполне достаточно, чтобы объяснить причину коллапса при чуме.
В отличие от отечественных авторов, выявивших изменения в корковом веществе надпочечников, N. J. Ehrenkranz и L. P. White [1954] на основании опытов на обезьянах с лёгочной чумой пришли к заключению о том, что кора надпочечников сохраняет свою функцию неизмененной на протяжении всей болезни. Именно с этим они связывают отсутствие терапевтического эффекта от кортизона при чуме у людей и обезьян.
При летальном исходе у больных чумой могут встречаться фибриновые тромбы в капиллярах клубочков извитых канальцев. Это очень сходно с тем, что отмечается в почках при генерализованном феномене Шварцмана, вызванном повторным введением эндотоксинов. Сходство картины поражения почек при чуме и феномене Шварцмана привело M. S. Finegold [1968] к предположению о том, что для больных чумой фатальным фактором является эндотоксемия, влекущая за собой развитие тромбоза в сосудах почек и других органах. Кстати, присутствие специфического эндотоксина в крови больных чумой доказано T. Butler и сотр [1973].
При чуме печени всегда поражается печениь и клинически это выражается по-разному. Чаще на заинтересованность печени указывают её увеличение и умеренный подъем уровня характерных ферментов, например глутамат-аспартат-трансаминазы, и концентрации билирубина в крови, а в тяжёлых случаях — явления печеночной недостаточности. У коматозных больных это даже приводило к ошибочному диагнозу синдрома Рейе [Butler T., 1983].
У некоторых больных при бубонной чуме отмечается спленомегалия, что не удивительно, если вспомнить о роли селезенки как важного барьера на пути распространения чумного микроба.
О состоянии костного мозга при чуме известно не так уж много. Из общих изменений, которые отмечены, обращают на себя внимание гиперплазия, гиперемия, кровоизлияния и обилие бактерий. К этому можно добавить указание М. Б.Станишевского (1911) на изменения клеточного состава костного мозга, выражающиеся в увеличении числа эозинофильных миелоцитов и мегакариоцитов, «иногда до громадного их числа». По мнению А. М. Скородумова и А. А. Стукова [1928], возникающие при бубонной чуме изменения в картине крови — появление мегало-и нормобластов, увеличение числа эозинофилов, палочкоядерных и юных форм) свидетельствуют о «чрезвычайной раздражительности «костного мозга, вызванной «чумным токсином».
Признаки поражения нервной системы являются постоянными спутниками чумы и наблюдаются во всех стадиях болезни. В тяжёлых случаях они иногда настолько выражены, что налагают характерный отпечаток на всю клиническую картину [Афанасьев М. И., Вакс П. Б., 1904; Доризо К. Г., Исакович М. И., 1912; Широкогоров И. И., 1933; Скородумов А. М., 1937; Руднев Г. П., 1938; и др.]. Однако патогенез нарушений функций нервной системы до сих пор изучен слабо. Тем не менее можно смело утверждать, что основную оль при этом играет интоксикация Примечательно, что патологоанатомические изменения мозга у людей, умерших от чумы, обычно неадекватны клиническим нарушениям деятельности ЦНС [Тизенгаузен М., 1911].
Как указывал И. И. Широкогоров [1933], при сравнении картины бубонной чумы при различных эпидемиях обращают на себя внимание " различия в поражении нервной системы, стоящие в зависимости от неодинаковой токсичности микробов» и кроме того, — зависимость степени поражения нервной системы от тяжести заболевания [Златогоров С. И., 1915; Руднев Г. П., 1938].
Остановившись на описании поражений нервной системы, нельзя обойти молчанием такое грозное осложнение её, как менингит, который в старое время вызывал поголовную гибель больных; особенно часто от чумного менингита умирали дети. Поражение мозговых оболочек чаще всего присоединяется лишь через 1–2 нед. от начала заболевания, но возможно и раньше. В последнем случае приходится говорить об особой форме чумы — менингеальной.
Помимо менингита, в качестве осложнений при чуме встречаются невриты, гемиплегии, параплегии, параличи мягкого нёба, лицевого, блуждающего и возвратного нервов с последующими афонией, мутизмом и афазией, а также психозы [Афанасьев М. И., Вакс П. Б, 1904; Широкогоров И. И., 1933; Скородумов А. М., 1937; и др.].
Патофизиологические аспекты экспериментальной чумной интоксикации рассматривались нами ранее [Домарадский И. В., 1966] и хотя с тех пор прошло более 30 лет, добавить к ним даже сейчас почти нечего.
Нарисовав общую картину патогенеза чумы, следует остановиться на частных, но кардинальных вопросах.
Как нам кажется, разобраться во всех особенностях патогенеза чумы можно только в том случае, если помнить, что её возбудитель относится к числу факультативных внутриклеточных паразитов, который обладает механизмами, необходимыми для вхождения в клетки профессиональных фагоцитов и противодействия губительному влиянию внутриклеточных ферментов.
Скорее всего, вхождение чумного микроба в клетки осуществляется по «инициативе» микроба, путем так называемого «parasite-specified endocytosis» [MoulderJ. W., 1985]. Этот процесс не требует от него наличия специализированных органелл, что характерно, например, для малярийного плазмодия, но сопряжен с затратой энергии. Попав внутрь клетки, чумной микроб, чтобы выжить, из двух возможных путей — высвобождение из фаголизосомы и приобретение резистентность к лизосомальным ферментам — выбирает второй. После размножения в клетках и выхода из них, он проникает в новые клетки. Таким образом, выживание внутри профессиональных фагоцитов является характерной особенностью вирулентных штаммов чумного микроба, подмеченной еще И. И. Мечниковым [1903] и подтвержденной Г. С. Кулешой [1915]. Последний писал, в частности: «В некоторых случаях, с самого начала воспаления наблюдается под влиянием агрессивной силы чумных бацилл извращение фагоцитоза, причем тела погибших фагоцитов превращаются в очаги, из которых бациллы прорастают в окружающую ткань».
Надо сказать, что сведения, получаемые от клиницистов и патологоанатомов относительно фагоцитоза при чуме и роли отдельных типов фагоцитов в борьбе с её возбудителем, не всегда однозначны. Однако, по мнению. В. Н. Лобанова [1956], эту неоднозначность нетрудно объяснить, если принять во внимание, что патологоанатомы, исследуя бубоны умерших от чумы людей, не имеют возможности наблюдать ранние изменения. «Явления фагоцитоза, — говорил он, — могут иметь место только в тех случаях, когда изменения не дошли до полного разрушения тканей и когда хотя бы в отдельных участках сохранились скопления пролиферирующих клеток ретикуло-эндотелия». В этой связи более точная информация может быть получена на основании экспериментального изучения взаимоотношений мутантов чумного микроба с фагоцитами нормальных и иммунных животных in vitro и in vivo. Но и здесь мы сталкиваемся с рядом несоответствий и противоречий, в которых предстоит еще разобраться. С одной стороны, бесспорной является принадлежность чумного микроба к числу факультативных внутриклеточных паразитов, о чем мы говорили выше. С другой стороны, широко обсуждается вопрос об «антифагоцитарных» свойствах этого микроорганизма.
К числу основных антифагоцитарных факторов чумного микроба принадлежит FI. Одной из её особенностей является то, что она образуется при 37 °C, но не при 26 °C. Поэтому в организме блох, имеющих температуру окружающей среды, микроб капсулу не образует и, следовательно, может захватываться лейкоцитами. Однако в организме теплокровного животного, после нескольких циклов размножения, оставшиеся живые клетки приобретают капсулу и становятся устойчивыми к фагоцитозу.
Подходы к выяснению механизма антифагоцитарной активности FI были найдены R. C. Williams и соавт. [1972]. По их данным, он может заключаться во взаимодействии FI с термолабильными опсонинами сыворотки, в результате чего компоненты С4 и С2, как и весь комплемент, инактивируются. Возможно, что здесь играет роль также антигенная мимикрия, о которой говорят V. Za'vyalov и соавт. [1996].
Существенное уточнение роли FI в фагоцитозе при чуме получено W. A. Janssen и M. J. Surgalla [1969]. Они показали, что даже бескапсульные вирулентные и авирулентные микробы способны выживать в нейтрофилах и макрофагах после инокуляции в перитонеальную полость морских свинок. Внутриклеточно расположенные микробы продолжали размножаться и после того, как фагоциты извлекали из организма животных и поддерживали in vitro. На этом основании авторы пришли к заключению, что выживание и размножение внутри фагоцитов более существенно для микроба, нежели противодействие захвату фагоцитами. Кстати, условия опытов W. A. Janssen и M. J. Surgalla весьма напоминают те условия, которые возникают при укусе животных блокированными блохами. Сходство усугублялось тем, что образование FI у использованных авторами штаммов наблюдалось лишь после того, как начиналось их размножение в фагоцитах. С этого момента начиналось беспрепятственное распространение бактерий в организме. Указанная последовательность событий согласуется с результатами опытов D. C. Cavanaugh и R. Randell [1959], показавших, что некапсулированные варианты чумного микроба захватываются нейтрофилами и погибают в них, однако часть клеток попадает в мононуклеарные фагоциты, благодаря чему и наступает заражение; если бы фагоцитоз осуществлялся только полиморфноядерными лейкоцитами, то трансмиссивный путь передачи чумы был бы невозможен (или мало эффективен). Не случайно поэтому столько усилий тратится на изучение взаимоотношений чумного микроба именно с макрофагами.
Как установили S. C. Straley и P. A. Harmon [1984a, b], в перитонеальных макрофагах мышей чумной микроб находится внутри фаголизосом и размножается в них, причем для этого не требуются такие детерминанты вирулентности микроба, как способность к пигментообразованию, Vwa или пестицин. Далее выяснилось, что плазмида «вирулентности» требуется чумному микробу не столько для персистенции, сколько для размножения [Charnetzky W. T., Shuford W. W., 1985, 1986]. При этом особое значение имеет сохранение у плазмиды области, которая контролирует зависимость микроба от ионов кальция. Интересно также, что клетки чумного микроба с плазмидой «вирулентности» и без неё не отличались по реакции на перекись водорода и супероксидный анион и что «окислительный взрыв» в случае обоих вариантов чумного микроба был значительное меньшим, чем при фагоцитозе кишечной палочки.
Несмотря на все сказанное, устойчивость чумного микроба к фагоцитозу не является абсолютной. Во-первых, даже в неиммунном организме фагоциты часто с ним «справляются». Во-вторых, как правило, эффективность фагоцитоза существенно возрастает по мере развития иммунитета. Для того чтобы понять причину этого надо вспомнить некоторые особенности клеточного иммунитета, присущего, в частности, и чуме. Мы имеем виду гетерогенность его макрофагального звена. Установлено, что свойства макрофагов варьируют в зависимости от вида и линии животных, от их локализации в данном организме и даже внутри одной и той же ткани; субпопуляции макрофагов существенно различаются по своей морфологии, размерам, фагоцитарной способности, экспрессии на поверхности Fc- и C3-рецепторов, антигенов Ia и дифференциации их по иммунорегуляторной активности [Кашкин К. П., Караев З. О., 1984: Шевак И. М., 1987: Паркер Ч. В., 1989; и др.]. Естественно поэтому, что в организме человека чумной микроб сталкивается с такой же ситуацией. Как показала, в частности, Г. И. Васильева [1990], киллерная способность у альвеолярных макрофагов существенно ниже, чем у перитонеальных, что и объясняет более тяжелое течение легочной чумы[17]. Впрочем, при оценке этих и подобных фактов следует иметь в виду, что опыты in vitro не полностью моделируют, условия, возникающие в организме. Так, по данным T. W. Charnetsky и W. W. Shuford [1985], завершённость фагоцитоза в перитонеальной полости мышей была выше, чем в макрофагах, которые поддерживали in vitro. Очевидно, нужны были еще какие-то дополнительные «опсонизирующие» факторы. На это указывает усиление киллерной активности макрофагов в процессе развития иммунитета, причем большое значение имеет способ вакцинации. По данным Г. И. Васильевой [1990], при подкожной вакцинации животных живой вакциной EV усиление киллерной активности сопровождается изменением «композиции» субпопуляций перитонеальных макрофагов. В то же время у альвеолярных макрофагов при этом наблюдается «секвенционный» характер активации, не затрагивающий бактерицидную активность клеток и не сопровождающийся перераспределением их субпопуляций, хотя то и другое происходит при вакцинации через дыхательные пути.
От клеток макрофагальной системы полиморфноядерные лейкоциты отличаются большей однородностью и отсутствием прямых кооперативных связей с другими звеньями иммунной системы, но и их фагоцитарная активность возрастает по мере развития иммунитета. Здесь же вполне уместно указать, что антимикробный потенциал лейкоцитов — напряженность их окислительного метаболизма, активность миелопероксидазы и степень бактерицидости катионного белка — Zh. M. Isin и B. M. Suleimenov [1987] увязывают с видовой чувствительностью животных к чуме.
Между обоими типами фагоцитов имеется еще одно отличие: макрофаги поглощают клетки чумного микроба независимо от того, при какой температуре они выращиваются (26 °C или 37 °C), тогда как нейтрофилы легче поглощают микробы и «расправляются» с ними, если их культивируют при 37 °C [Burrows T. W., Bacon G. A., 1956a; Cavanaugh D. C., Randall R, 1959; Janssen M. W., Surgalla M. J., 1969].
Относительно недавно появились данные о наличии у Y. pestis пилей адгезии, которые образуются микробом при рН, сравнимом с таковым в фаголизосомах. Образование пилей происходит через 18 ч. от начала контакта «апилированных» клеток штамма EV с монослоем нативных (но не инактивированных) макрофагов из перитонеального экссудата мышей и морских свинок. Очищенные пили обладают цитотоксическим действием и тормозят переваривающую активность макрофагов [Водопьянов С. О. и др., 1985]. Надо отметить, что цитотоксическое действие чумного микроба на макрофаги было уже описано [Goguen J. D. et al.,1986], однако «материальный субстрат», ответственный за этот эффект остался «за кадром». Если данные С. О. Водопьянова и соавт. подтвердятся, то можно будет говорить о наличии у чумного микроба еще одного фактора вирулентности. В то же время они послужат дальнейшим вкладом в идею о том, что свойства бактерий, о которых мы привыкли судить по результатам опытов in vitro, существенно отличаются от свойств, приобретаемых ими in vivo (см. раздел 4.1.3). Однако следует выяснить, какие взаимоотношения существуют между «пилями», описанными С. О. Водопьянов и сотр, и теми, о которых говорится в разделе о pH6Ag.
Предположение о наличии токсина у Y. pestis возникло еще у А. Иерсена вскоре после открытия им этого микроба. «Токсин чумы существует, — писал он, — я мог бы его получить из культур и я думаю его изучить позднее, но теперь (речь шла об эпидемии 1894 г. в Гонконге, примеч. авт.) чума слишком страшна, чтобы мы мечтали о чем-либо другом, как не о приготовлении противочумной сыворотки, не сосредоточившись на механизме её действия» [цит. по Щербачёву Д., 1901]. Тем не менее наличие токсина у чумного микроба было вскоре подтверждено рядом исследователей, из числа которых особого упоминания заслуживают Желтенков [1940, 1946], H. Albrecht и A. Ghon [1898], A. Lustig и G. Galeotti [1897], Markl [1898] и E. Wernike [1898]. Они доказывали наличие токсина разными методами, но общим в их работах было то, что к соответствующим препаратам были чувствительны все лабораторные животные. К сожалению, ни один из описанных тогда методов не был воспроизведен в последующем [подробнее об этом см. у Домарадского И. В., 1966].
Дискуссии вокруг чумного токсина продолжались до начала 50-х годов, когда, казалось, работа E. S. Baker и соавт. [1952] должна была положить им конец. Действительно, очень быстро после этого мышиный токсин (см. раздел 3.6) был очищен до гомогенного состояния и появилась возможность изучить механизм его действия. Однако результаты многочисленных исследований не оправдали надежд.
Как показали опыты S. Kadis и соавт.[1963, 1965] и J. H. Rust и сотр [1963], мышиный токсин ингибирует дыхание митохондрий клеток миокарда, чувствительных к токсину мышей и морских свинок, но не действует на митохондрии миокарда крыс, собак и обезьян, которые к этому токсину резистентны. У чувствительных к токсину животных введение токсина вызывает изменение на ЭКГ сегмента S-T, Все это было расценено как результат торможения переноса электронов на уровне коэнзима Q и нарушения транспорта ионов кальция и неорганического фосфора. Однако для индукции указанных изменений в митохондриях требовались такие дозы токсина, которые сравнимы с летальными дозами для мышей. Поэтому возникло сомнение в том, что действительная причина гибели животных кроется в нарушении метаболизма миокарда. К тому же стало известно, что их смерть при экспериментальной интоксикации наступает на фоне расстройства периферического кровообращения [Hildebrand G. J. et al., 1966]. В итоге T. C. Montie и соавт. [1975], S. D, Brown и T. C. Montie [1977] выдвинули другую гипотезу. Согласно новой гипотезе, мышиный токсин является антагонистом β-адреногенной активности и, вероятно, также антагонистом цАМФ. Основываясь на данных о том, что введение мышам 3 мкг токсина вызывает существенное уменьшение уровня глюкозы и жирных кислот в крови, они постулировали наличие у токсина выраженного инсулиноподобного эффекта. Однако измерение соответствующей активности показало, что при интоксикации в крови она не меняется. Введение отравленным мышам глюкозы или эпинефрина не отражалось на состоянии животных, но введение вместе с токсином дибутирил-цАМФ, глюкагона или кортизона уменьшало токсичность. Кроме того, токсин блокировал способность эпинефрина повышать в крови уровень сахара и свободных жирных кислот. Все это подтвердило мнение о том, что токсин является β-адреноблокатором.
Механизм анти-β-адреногенного действия токсина был подвергнут более подробному анализу. Когда холерный токсин вводится животным, он вызывает повышение уровня цАМФ почти во всех клетках за счёт активации аденилатциклазы. Если одновременно с холерным токсином вводится летальная доза мышиного токсина, то летальность мышей уменьшается. Хотя мышиный токсин предотвращает увеличение концентрации свободных жирных кислот в плазме, индуцируемое эпинефрином, он не оказывает такого эффекта при наличии цАМФ, действующего подобно эпинефрину. Эпинефрин и другие β-адреналовые агонисты в клетках, обладающих β-адреногенными рецепторами, повышают содержание цАМФ. Поскольку токсин блокирует действие эпинефрина, но не цАМФ, предполагается, что точка приложения действия токсина лежит выше локализации аденилатциклазы. Дальнейшие доказательства действия мышиного токсина на цАМФ T. C. Montie [1981] получил в опытах на мышах, которым вводили сыворотку против цАМФ; чувствительность мышей к токсину при этом изменялась.
Для того чтобы лучше понять значение мышиного токсина для патогенеза чумы из вирулентного штамма 358 чумного микроба были селекционированы бескапсульные клоны, нетоксичные для мышей. С одним из таких клонов В. Н. Метлин [1968] провел опыты на мышах и морских свинках, которым вводились разные дозы инфекта (от 2 до 200 Dcl). Против ожидания, почти все подопытные животные погибли от типичной чумы. На этом основании и на основе некоторых других данных В. Н. Метлин пришел к выводу, что «мышиный токсин, «во-первых, не является ведущим фактором в патогенезе чумной инфекции у белых мышей и морских свинок, во-вторых, не определяет вирулентные свойства возбудителя чумы и, наконец, практически не имеет значения в становлении противочумного иммунитета при активной иммунизации указанных видов животных».
Несмотря на то, что опыты В. Н. Метлина были обставлены рядом контролей их результаты считать достаточно убедительными нельзя, так как в них нельзя было исключить реверсии свойств штаммов in vivo. Иначе пришлось бы признать, что в патогенезе чумы не играет роли не только мышиный токсин, но и FI. Для того чтобы разобраться в этом — надо было поставить еще один контроль, а именно исследовать культуры, выделенные от павших животных, на наличие или отсутствие у них обоих факторов. Уже после работы В. Н. Метлина стали известны факты о существовании в природе FI- штаммов чумного микроба, сохраняющих частичную вирулентность, и о выделении бескапсульных штаммов от больных людей и животных [Williams J. E. et al., 1975, 1978]. Не исключено, что то же относится и к «мышиному» токсину.
В общем, истинная роль мышиного токсина при чуме до сих не вскрыта. Неудивительно поэтому, что основное внимание исследователи переключили на чумной эндотоксин (ЛПС).
По данным D. A. Davies [1956], ЛПС чумного микроба обладает пирогенностью для кроликов и убивает мышей, хотя его токсичность намного меньше таковой других ЛПС. Интересно отметить, что очищенный ЛПС другого микроба, который ранее объединялся в один род с чумным микробом и вызывает сходную клиническую картину заболевания у грызунов, а именно Francisella tularensis, столь же мало токсичен (собственные данные).
Последующее изучение ЛПС чумного микроба показало, что in vivo и in vitro он вызывает изменения, которые во многом сходны с таковыми в случае ЛПС других грамотрицательных бактерий, а именно «двугорбую» лихорадку у кроликов, летальный шок, повреждение сосудов и геморрагии в почках, печени и других органах, локализованные и общие реакции Шварцмана у кроликов, желатинизацию крабового лизата и активацию митоза в В-лимфоцитах селезенки мышей [Cocking E. C. et al., 1960; Walker R. V., 1968; Albizo J. M., Surgalla M. J, 1970], Как и в случае других ЛПС, эффекты чумного ЛПС не выявляются после обработки его полимиксином [Butler T. et al., 1973].
При чуме все фагоцитирующие клетки крови, печени и селезенки буквально нафаршированы возбудителями, что способствует высвобождению огромных количеств эндотоксина. Под влиянием эндотоксина мононуклеарные фагоциты начинают синтезировать и секретировать пироген, который действует на гипоталамус, вызывая лихорадку, а тканевой тромбопластин запускает каскад реакций, способствующих внутрисосудистому свертыванию крови. Не остаются безразличными к эндотоксину и белки крови, включая компоненты комплемента и фактор Хагемана. В результате происходят, в частности, образование медиаторов гипотензии и диапедез лейкоцитов.
T. Butler [1983] особое значение придает эндотоксину как фактору, вызывающему местные и общие реакции Шварцмана, о чём уже говорилось выше.
В естественных условиях, при участии блох, заражение происходит внутрикожно. С места входных ворот током лимфы микробы переносятся в регионарные лимфатические узлы, где начинают интенсивно размножаться. В связи с этим лимфатические узлы становятся сенсибилизированными. В последующем, при первых же клинические проявлениях заболевания (лихорадка, озноб) развивается бактериемия, которая сопровождается высвобождением эндотоксина, играющего роль провоцирующего фактора. Лимфатические узлы набухают и подвергаются геморрагическому некрозу, столь характерному для феномена Шварцмана Затем возникают бубоны. Часто однако процесс этим не ограничивается, а развиваются кожные поражения в виде геморрагических высыпаний, струпов и некротических язв, которые можно рассматривать как проявления общей реакции Шварцмана.
Другие явления при чуме (исчезновение гликогена из печени, гипогликемия и повышение остаточного азота крови (также могут быть связаны с эндотоксином [Walker R. W., 1968; Walker R. W. et al., 1966]. Весьма вероятно, что эти изменения вызываются нарушениями функции почек и расстройством углеводного обмена, связанным с выбросом большого количества эпинефрина. При патологоанатомическом исследовании у животных наблюдаются поражения канальцев почек и жировая инфильтрация клеток печени. По данным M. S. Finegold [1968], в сосудах канальцев почек людей, погибших от чумы, часто видны тромбы и некрозы коркового вещества, напоминающие картину при общей реакции Шварцмана у кроликов.
Прямым доказательством участия эндотоксина в патогенезе чумы можно считать наличие его в крови больных в течение всего периода заболевания бубонной чумой, а у некоторых больных даже после клинического выздоровления [Butler T. et al., 1973]. Эндотоксин находили не только в крови, но и в цереброспинальной жидкости — при чумном менингите.
Этот вопрос уже служил предметом специального рассмотрения [Домарадский И. В., 1966]. Однако за истекшие с тех пор три десятилетия загадка осталась неразгаданной. Более того, никому так и не удалось воспроизвести данные авторов, упоминавшихся в начале главы. Поэтому одна из возможностей заключается в продолжении поиска ответ на вопрос с тех позиций, что» истинный» токсин образуется только in vivo и что он является весьма нестойким компонентом микробной клетки.
Многочисленные попытки найти связь между теми или иными свойствами бактерий и их вирулентностью чаще всего заканчиваются неудачей. Скорее всего, как мы неоднократно подчеркивали, это связано с тем, что свойства бактерий, о которых мы судим по результатам опытов in vitro, отличаются от свойств, приобретаемых бактериями in vivo [Домарадский И. В., 1996,1997][18]. Если это так, то факторы вирулентности столь же разнообразны, как и разнообразны видовые особенности микроорганизмов. К сожалению, это мнение разделяется далеко не всеми. Мы говорим «к сожалению», поскольку отрицание специфичности вирулентности, её видовой обусловленности, тормозит решение многих проблем инфекционной патологии. Исходя из этого вирулентность микроба следует рассматривать как функцию его способности адаптироваться к организму хозяина. В естественных условиях бактерии вынуждены перестраивать свой метаболизм таким образом, чтобы можно было противостоять защитным силам организма и чем сильнее выражена эта способность, тем больше вероятность развития инфекции. При этом бактерии приобретают, в частности, способность образовывать капсулу или токсин, которые не нужны им тогда, когда они попадают на искусственные питательные среды, изменять антигенность и даже прибегать к «антигенной» или «молекулярной» мимикрии. Однако чаще всего мы плохо представляем себе те изменения в метаболизме патогенных бактерий, которые помогают им выживать при смене среды обитания. И основной причиной этого являются методические трудности. Поэтому вполне вероятно, что «истинный» токсин, действующий на все виды лабораторных животных, чумной микроб образует только in vivo. Возможным подтверждением этого являются теперь забытые работы английских авторов, в частности, E. C. Cocking и соавт. (1960). Для выделения токсина они использовали клетки чумного микроба из перитонеальной и торокальной полостей 400 морских свинок, погибших от острой чумы и разрушали их ультразвуком. В итоге были получены препараты токсина, которые у морских свинок вызывали картину чумной интоксикации, часто наблюдаемой у людей. Еще одним доводом, свидетельствующим о том, что in vivo чумной микроб образует факторы патогенности (или вирулентности), не выявляемые у него in vitro, могут служить многочисленные данные о LCR-белках, кодируемых плазмидой pCad (cм. раздел 3.8.2). В данном случае особый интерес представляют результаты опытов G. Mazza и соавт. [1985]. Согласно этим результатам, в сыворотках крови иммунизированных животных (мышей, кроликов), как и у людей больных чумой, выявляются антитела по крайней мере к двум антигенам Y. pestis, которые in vitro у чумного микроба отсутствуют; Y. enterocolitica в отличие от чумного микроба синтезируют оба антигена во всех случаях.
Альтернативой сказанному, к чему мы все больше и больше подчас склоняемся, является предположение об отсутствие у чумного микроба мифического «истинного» токсина. В таком случае всю картину интоксикация при чуме можно объяснить потенцированием эффектов мышиного токсина и ЛПС при связывании их различными, но специфическими для каждого из них клетками-мишенями. Подтверждение этого усматривается в результатах недавних опытов В. Зюзина и соавт. [1997]. Ими было установлено, что дозы «мышиного» токсина и ЛПС, которые сами по себе не летальны для белых мышей и морских свинок, при совместном введении вызывают их гибель. Авторы этой работы делают вывод, что «мышиный» токсин и эндотоксин — единый «токсический комплекс», который в организме чувствительного к чуме хозяина» образуется de novo[19].
О большой способности чумного микроба распространяться в организме нетрудно судить хотя бы по данным Е. И. Коробковой [1956], согласно которым уже через 5-10 мин. после накожной или внутрикожной прививки даже вакцинного штамма EV чумной микроб обнаруживается в глубоких слоях кожи, подкожной клетчатке, регионарных лимфатических узлах, крови, легких, печени и селезенке (рис. 12). Естественно поэтому, давно уже возник вопрос о механизмах, обусловливающих такую способность.
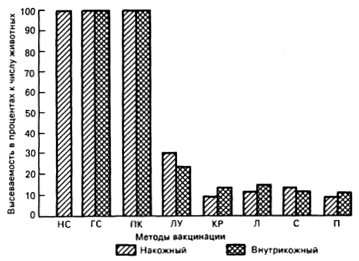
Рис. 12. Высеваемость вакцинного штамма ЕV из наружного (НС) и глубокого (ГС) слоев кожи, подкожной клетчатки (ПК), лимфатического узла (ЛУ), крови (КР), легких (Л), селезенки (С) и печени (П) после 5-минутного воздействия вакцины на скарифицированную кожу с последующим механическим удалением вакцины и иссечения депо вакцины через 5 мин после внутрикожной прививки [Коробкова Е.И., 1956].
E. Jawetz и K. Meyer [1944] показали, что в лизатах авирулентных и вирулентных штаммов чумного микроба содержится фактор, усиливающий проницаемость тканей и капилляров. У живых авирулентных штаммов этот фактор не обнаружен. По утверждению указанных авторов действие «фактора распространения» (ФР) в организме иммунных к чуме морских свинок выражено гораздо слабее, чем в организме неиммунных животных. Поскольку cпециально изучением ФР E. Jawetz и K. Meyer не занимались, каких-либо предположений о его природе они не высказали.
В отличие от американских авторов Е. И. Коробкова [1947] обнаружила ФР даже у цельных клеток чумного микроба, независимо от их вирулентности, хотя наибольшей активностью ФР обладали супернатанты агаровых культур. В то же время в опытах Е. И. Коробковой ФР выявлялся только при использовании неиммунных животных. В последующем Е. И. Коробкова [1950] пришла к выводу, что способность чумного микроба увеличивать площадь распространения красок в коже кроликов и морских свинок обусловлена наличием у него фермента, который она отождествила с гиалуронидазой, однако при тщательной проверке этого выявить гиалуронидазу у Y. pestis я и мои коллеги не смогли. Наши исследования проводились как в опытах in vitro, так и in vivo, с большим числом штаммов чумного микроба и параллельно с Staphylococcus aureus и Сlostridium perfringens, которые этим ферментом заведомо обладают. Скорее всего причина расхождений в результатах наших опытов и опытов Е. И. Коробковой заключались в том, что в её случае отсутствовали необходимые контроли [Домарадский И. В., 1966].
В чём же все-таки причина столь поразительной инвазивности чумного микроба? Весьма вероятно, что одна из причин кроется в наличии у чумного микроба нейраминидазы, обнаруженной Н. Я. Шиманюк и Б. Н. Мишанькиным [1982], которая при определенных условиях может восполнять отсутствие гиалуронидазы. Возможно также, что роль ФР у чумного микроба играют «фибринолизин» — активатор плазминогена, на что указывала еще Г. А. Яромюк[20], и пестицин 1, оказавшийся одной из гидролаз. Впрочем, при тех тяжёлых деструктивных изменениях в организме, в частности в крупных и мелких сосудах, что наблюдается при чуме всеми исследователями, путь для её возбудителя в лимфу и кровь всегда открыт.
Данные о гемолизине чумного микроба столь же противоречивы, как и о факторе распространения. Одно из первых указаний на наличие гемолизина у чумного микроба принадлежит Zinno [1904, цит. по Шурупову И. З., 1906], который работал с 25 культурами разной вирулентности, выделенными во время эпидемии в Неаполе в 1901 г. По его данным, первые признаки гемолиза в бульоне с кровью при 37 °C выявлялись уже через 10–15 ч. после засева среды. Позднее вся среда окрашивалась в красный цвет.
По данным Raybaud и Pelisser [1902, цит по Шурупову И. З.,1906], гемолитическая способность у чумного микроба выражена гораздо слабее (проявляется только через несколько дней) и связана с вирулентностью культур и их происхождением. Сходные результаты получил Г. Д. Белиловский [1904], который к тому же установил, что чумной гемолизин относительно термостабилен (разрушается только при кипячении).
Подобно авторам двух указанных работ И. З. Шурупов [1906] наблюдал первые признаки гемолиза не ранее 6-7-х суток. Однако он не смог подтвердить зависимость гемолитической активности от вирулентности культур. Не удалось это также Е. И. Коробковой [1940], поставившей под сомнение и наличие у чумного гемолизина антигенных свойств и связь его с токсичностью штаммов.
В противоположность приведенным данным, имеются и такие, в которых наличие гемолизина у чумного микроба отрицается [см. Pollitzer R., 1954], а по мнению В. В. Ткаченко [1963], то что считали за «чумной гемолизин» на самом деле может быть высшими жирными кислотами, которые подобно большинству других детергентов, обладают способностью лизировать эритроциты; эти кислоты могут высвобождаться при разрушении клеток чумного микроба in vitro и in vivo. При этом условии находят объяснение два факта: развитие гемолиза в поздние сроки и его характер на плотных средах с кровью β-тип.
Несмотря на противоречивость данных о чумном гемолизине, необходимо отметить, что «лаковую» кровь при чуме констатировали многие, включая Г. Д. Белиловский, а В. Н. Лобанов [1956] постоянно регистрировал множество разрушенных эритроцитов как внутри, так и вне сосудов, и наличие гемосидерина, особенно в печени и слезенке. Косвенным свидетельством гемолиза при чуме служат также развитие у больных желтухи, наблюдавшейся рядом авторов, в частности, Г. П. Рудневым [1938]. Не исключается однако, что причина гемолиза при чуме может крыться не в её возбудителе, а в тех нарушениях метаболизма, которые развиваются в процессе заболевания («опосредованный» гемолиз). Напомним кстати, что чувствительность к «чумному гемолизину» эритроцитов разных видов животных при чуме существенно выше, чем в норме [Белиловский Г. Д., 1904].
4.2. Патолоанатомическая картина
Как подчеркивали И. А. Чалисов и А. Т. Хазанов [1980], у людей, погибших от чумы, было резко выражено трупное окоченение. Мышцы трупа бурого цвета, сухие. Общим фоном патологоанатомических изменений является геморрагический характер поражений различных органов и тканей. В серозных полостях содержится значительное количество транссудата, а В. Н. Лобанов в перикардиальной сумке наблюдал значительное количество крови (150–200 мл). Селезенка увеличена, иногда значительно, дряблая, имеет все признаки «септической». На разрезе ткань темно-красная, пульпа легко соскабливается; отмечается гиперплазия фолликулов, встречаются очаги некроза. В печени обычно определяются изменения в виде зернистой дистрофии и ожирения, а также очаги некроза. В почках — кровоизлияния, зернистая дистрофия; иногда некроз извитых канальцев. В слизистой оболочке желудка и кишечника наблюдаются воспалительные процессы, кровоизлияния и некрозы [Кишенский Д. П. и др., 1911]. В миокарде выявляют зернистую и жировую дистрофию [Заболотный Д. К., 1915; Лобанов В. Н., 1956; Pollitzer R., 1954].
Изменения в кровеносных сосудах, главным образом кровоизлияния, описаны Кишенским Д. П. и соавт. [1911], Широкогоровым [1933], Н. Albrecht и А. Ghon [1898], Изменения происходят как в артерих, так и в венах, и тем в большей степени, чем мельче сосуды [Лобанов В. Н., 1956: Finegold M. S., 1968; Butler T. et al., 1974].
При кожно-бубонной форме чумы на коже появляются геморрагическая и пустулёзная сыпь. Могут быть также первичные и вторичные карбункулы [Чалисов И. А., Хазанов А. Т., 1980]. В таких случаях на разрезе обращают на себя внимание обильное пропитывание тканей кровянистой жидкостью, а при микроскопии — наличие гнойного или серозного экссудата, эритроцитов, некробиоз или некроз элементов РЭС, поражение сосудов и обилие микробов [Лобанов В. Н., 1964]. На разрезе ткань первичных бубонов по внешнему виду напоминает сгустки крови, лежащие в отёчной, разрыхленной клетчатке. Иногда в них выявляются участки некроза или гнойного расплавления. В отдаленных лимфатических узлах — внутренних и периферических — воспалительное изменение выражена менее резко.
При первичной и вторичной формах пневмонии очаги в легких плотноваты на ощупь, на разрезе они несколько выбухают и имеют гладкую, иногда слегка зернистую поверхность и красный, серый или серо-красный цвет. Число очагов колеблется от 1–2 до нескольких, сильно варьируют их размеры. В процесс вовлекается плевра, расположенная над очагами воспаления в лёгочной ткани. Слизистая оболочка трахеи и крупных бронхов резко гиперемирована, покрыта пенистой кровянистой жидкостью. Важно еще раз указать, что к числу характерных признаков чумы вообще и чумной пневмонии в частности ранее относили отсутствие фибрина [Высокович В. К., 1897; Кулеша Г. С., 1915: Wu Lien-Teh et al., 1936]. Только после начала применения современных методов антибактериальной терапии в экссудате пневмонических очагов стали обнаруживать фибрин, причем в значительных количествах, что ныне может затруднять дифференциацию чумной пневмонии от крупозной [Чалисов И. А. и Хазанов А. Т., 1980].
Гистологическая картина в легких зависит от стадии заболевания [Лобанов В. Н., 1964]. У умерших в ранние сроки межальвеолярные перегородки утолщены из-за полнокровия. Просветы альвеол заполнены экссудатом, иногда со значительной примесью эритроцитов. В альвеолах вокруг сосудов и капилляров — множество чумных бактерий. Позднее альвеолы заполняются клеточными элементами, преимущественно нейтрофилами. Стенки капилляров еще больше утолщаются, становятся гомогенными и нередко разрушаются. Полнокровие усиливается, развивается стаз, эндотелий подвергается дистрофическим изменениям. В некоторых участках сосудов возникают некрозы стенок. Наконец, в картине изменений начинают доминировать признаки некроза, который распространяется на стенки альвеол, капилляров и других сосудов, следствием чего являются очаги кровоизлияний. В трахее и бронхах при микроскопическом исследовании отмечаются очаги некроза с обильным скоплением микробов.
При септической форме чумы отмечаются патологоанатомические изменения, характерные для сепсиса, без каких-либо признаков, присущих только чуме [Лобанов В. Н., 1964]. Геморрагический синдром — кровоизлияния в кожу, серозные оболочки и внутренние органы) выражен особенно резко [Чалисов И. А., Хазанов А. Т., 1980].
4.3. Клиническая картина
Среди известных классификаций клинических форм чумы, по нашему мнению, наибольший интерес представляет классификация Г. П. Руднева [1938], в которой клинические формы рассматривается с эпидемиологической точки зрения. Это вполне оправдано, поскольку при каждой клинической форме должна быть особая тактика подхода к больному.
Согласно классификации Г. П. Руднева следует различать следующие клинические формы чумы:
А. Преимущественно локальные формы (обычно периферические с относительно скудной внешней диссеминицией):
1) кожную,
2) бубонную,
3) кожно-бубонную.
Б. Внутренне-диссеминированные или генерализованные формы:
1) первично-септическую,
2) вторично-септическую.
В. Внешне-диссеминирующие формы:
1) первично-лёгочную,
2) вторично-лёгочную,
3) кишечную.
Естественно, указанная схема условна, так как «один и тот же больной по характеру течения своего заболевания может переходить из одной группы в другую (исключая, конечно, первично-септическую и первично-лёгочную формы)» [Руднев Г. П., 1938]. Однако клинические формы чумы в этой схеме располагаются в порядке возрастания опасности заболевания для окружающих, хотя при любой форме чумы требуется тщательное соблюдение всех мер личной профилактики медицинского персонала
Ниже приводятся данные, касающиеся общих аспектов и характерных признаков заболевания, заимствованные в основном из работ М. И. Афанасьева и П. Б. Вакса [1904], К. Г. Доризо и М. И. Исаковича [1912], С. И. Златогорова [1915], Г. П. Руднева [1938, 1970, 1972], Wu Lien-Teh и соавт. [1936], а также T. Butler [1983].
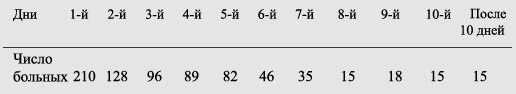
Инкубационный период чумы — 3–6 дней (по международным карантинным правилам — 6 дней); в исключительных случаях до 8-10 сут. и даже больше. Описаны также случаи, особенно внутрилабораторного и секционного заражения или в разгар первично-лёгочной чумы, когда инкубационный период длился всего несколько часов (табл. 19).
Характерно, что заболевание чумой начинается без продромального периода, проявляется внезапно, обычно с сильного озноба и быстрого повышения температуры тела до 38 °C и выше. Типичные признаки заболевания: озноб, сменяющийся лихорадкой («жаром»), сильная головная боль и головокружение, резкая слабость, бессонница, боли в груди и мышцах, тошнота, иногда рвота. Больные могут быть заторможены, находиться в состоянии оглушения; в других случаях сознание полностью сохранено или возникает психомоторное возбуждение с бредом или галлюцинациями. В бреду больные особенно беспокойны, часто вскакивают с постели, стремятся убежать. Из-за шатающейся походки, гиперемии лица и конъюнктив, а также невнятной речи они нередко напоминают пьяных. Лицо становится синюшным, черты его, особенно при тяжёлых формах, заострены, порой появляется выражение ужаса («facies pestica»). На лбу выступают крупные капли пота («роса чумы», по Г. П. Рудневу). Кожа горячая и сухая на ощупь. Могут появляться множественные петехии и даже геморрагии. На трупах они становятся тёмно-багровыми, что и послужило основанием называть чуму «чёрной смертью»[21]. Язык покрывается белым налётом, как бы «натёрт мелом» [Руднев Г. П., 1938]. Иногда появляется тремор языка. Слизистая оболочка полости рта сухая. Зев гиперемирован, с мелкими кровоизлияниями. Миндалины увеличены, изъязвлены. Печень и селезенка увеличены. У тяжёлобольных отмечается кровавая рвота; рвотные массы иногда имеют вид кофейной гущи. В моче — примесь крови и белка. Может развиваться олигурия.
Уже в первые часы, как следствие интоксикации, появляются симптомы поражения сердечно-сосудистой системы: границы сердца расширены, тоны глубокие, тахикардия, пульс дикротичный или нитевидный, артериальное давление сильно понижено, одышка, у некоторых больных — чейнастокса дыхание. На ЭКГ чаще всего бывает синусовая тахикардия, иногда с изменением интервала ST-T (уменьшение зубца T). У некоторых больных обращает на себя внимание преждевременные сокращения предсердий, а также высокий зубец Р и отклонение оси вправо. Эти изменения трактуются как указание на cor pulmonale, хотя изменений легких может и не быть [Butler T., 1983]. Смерть наступает при прогрессирующей циркуляторной недостаточности, часто с отеком легких.
Наряду с описанной картиной известны случаи, когда у больных до самой смерти самочувствие было хорошим и они умирали в полном сознании [Златогоров C. И., 1915]. Иногда с самого начала заболевание приобретает абортивный характер, протекает легко и процесс ограничивается местными изменениями, о которых говорится ниже («pestis minor» или «амбулаторная форма чумы» по Г. П. Рудневу). Обычно такие случаи отмечаются в начале и конце эпидемий [Pollitzer R., 1954].
Помимо общих проявлений чумы, развиваются поражения, свойственные различным формам заболевания.
При кожной форме чумы, наблюдающейся сравнительно редко (в 3–4 %) и, как правило, переходящей в кожно-бубонную, изменения на коже проявляются последовательно — в виде пятен, папул, везикул, пустул и язв, но врачи чаще встречаются с двумя последними. Пустулы обычно напоминают карбункул, отличающийся значительной болезненностью, которая резко усиливается при пальпации, что важно для диагностики. Когда пустула лопается, образуется долго не заживающая язва, оставляющая после себя рубец. Патогномичным для чумы Г. П. Руднев [1938] считает отсутствие лимфангитов, хотя другие авторы, например М. И. Афанасьев и П. Б. Вакс [1904], Ч. И. Хенцинский [1911], К. Г. Доризо и М. И. Исакович [1912], их наблюдали. Однако, как подчеркивает Г. П. Руднев, в этих случаях скорее всего имелись не первичные, а вторичные лимфангиты, т. е. «исходящие из бубона, а не направляющиеся к нему».
Пустулы и язвы могут возникать также вторично, на фоне других кожных проявлений, описанных выше. Очевидно, то что T. Butler, [1983] называл «пурпурой», относится к этой же категории поражений. По его данным, гистологическая картина в местах расположения пурпуры напоминает таковую при феномене Шварцмана и её развитие связывается с действием эндотоксина (сравните с данными M. S. Finegold [1968]).
Заслуживает упоминания необычный случай кожной формы чумы, о котором сообщил H. Dürk [1904]. Речь шла о человеке, укушенном крысой во время сна в область виска. Через 2 дня он заболел и у него сразу же возникли изменения на месте укуса. Эти изменения быстро нарастали, началось глубокое омертвление тканей. Все это закончилось сепсисом и больной умер. Диагноз чумы был подтвержден бактериологически.
При бубонной форме чумы бубоны (резко болезненные припухания лимфатических узлов) служат кардинальным симптомом. Бубоны, чаще единичные, располагаются вблизи от входных ворот инфекции и могут служить некоторым указанием на то, каким образом заразился человек. Считается, что бубоны на нижних конечностях и в паховой области появляются от укусов блох, тогда как подмышечные бубоны чаще указывают на контакт больного с зараженными животными (грызунами, верблюдами, козами и др.), а цервикальные чаще бывают обусловлены употреблением в пищу мяса больных животных (табл. 20).

Ранний признак намечающегося бубона — сильнейшая болезненность из-за которой больные принимают неестественные, вынужденные позы. Кожа над образующимся бубоном в начальном периоде не изменена, затем, по мере увеличения бубона, краснеет, натягивается, становится гладкой и блестящей. Сами бубоны сначала прощупываются в виде небольших уплотнений. а в дальнейшем лимфатические узлы сильно увеличиваются и в процесс вовлекаются окружающие ткани. Узлы сливаются в конгломераты, лишь изредка сохраняющие признаки бугристой дольчатости. Болезненный и плотный конгломерат лимфатических узлов постепенно размягчается. появляются участки флюктуации. Раньше на 8-13-й день болезни бубоны часто вскрывались самопроизвольно с выделением большого количества густого зеленовато-жёлтого гноя. Однако при современной терапии вскрытие бубонов происходит редко, обычно наступает полное их рассасывание и склерозирование.
Приведенное описание бубонов основывается в основном на классических данных, поэтому небезынтересно указать на два новых факта. О первом сообщили T. L. Stahly и J. D. Shoop [1975]. При обследовании человека больного чумой с помощью радиоактивного галлия они обнаружили повышенное поглощение изотопа в области аксиллярного бубона, а когда развился менингит, то и в оболочках мозга. Второе сообщение принадлежит N. N. Thuat и N. D. Tiep [1970]. Эти авторы у некоторых больных обнаружили подкожную эмфизему вблизи бубонов. Причина эмфиземы осталась невыясненной.
Какой-либо типичной температурной кривой при кожной, бубонной и кожно-бубонной формах чумы нет (рис. 13). Тяжесть болезни и состояние больного определяются степенью интоксикации. Симптомы болезни нарастают (до 4-5-го дня) и затем постепенно стихают, но неблагоприятный исход болезни может наступить на любом этапе, даже на фоне лечения. Наряду с этим, течение чумы может затянуться до месяца и более («хроническая» чума). Тогда у больных развиваются кахексия и облысение, появляются вторичные бубоны. От первичных бубонов они отличаются множественностью и меньшей болезненностью; кроме того, вторичные бубоны, как правило, не спаяны с кожей и между собой, а периаденит отсутствует или нерезко выражен. Важно что из пунктатов бубонов таких больных чумной микроб может выделяться в течение года [Pollitzer R., 1954].

Рис. 13. Типы температурных кривых больных бубонной чумой [Wu Lien-Teh et al., 1936]. Температура — по шкале Фаренгейта (37 °C соответствуют 98,6°F).
Как указывалось выше, в начальных стадиях чумы отмечаются симптомы поражения желудочно-кишечного тракта, которые подчас могут даже доминировать в картине заболевания. Тогда, помимо тошноты и рвоты, к ним присоединяются диарея и боли в животе. В подобных случаях клиническая картина напоминает острые кишечные инфекции [Hull H. P. et al., 1986] — «кишечная форма чумы». В связи с этим интересно описание подобной картины С. И. Златогоровым [1915]: «Болезнь протекает при повышенной температуре и напоминает собой холерину. Испражнения имеют характер рисового отвара и содержат большое количество бацилл, течение болезни кратковременное, в некоторых случаях затягивается до двух недель (наши наблюдения в Чифу) и обычно кончается смертью». Тут же следует отметить следующее. Хотя Г. П. Руднев (1970) сначала и отнёс подобные случаи к самостоятельной форме «внешне-диссеминирующей чумы», однако в последующем он согласился с теми, кто расценивал их «как осложнение какой-либо другой её формы» [Руднев Г. П., 1970].
Из осложнений при описанных формах чумы на первое место надо поставить пневмонию — вторичную чумную пневмонию). Присоединение пневмонии, встречающейся примерно в 5-10 % случаев, а иногда и чаще [Mann J., 1979], резко ухудшает общую картину заболевания. Клинически это выражается новым повышением температуры тела, резкими колющими болями в груди, появлением кашля с выделением кровавой мокроты, содержащей большое число чумных микробов. По данным объективного исследования, процесс характеризуется как лобулярная, реже псевдолобарная пневмония. При выздоровлении разрешение процесса происходит очень медленно [Руднев Г. П., 1970]. Описан случай, когда после пневмонии очаги уплотнения заместились полостями [Florman A. et al., 1986], Следует подчеркнуть, что в эпидемиологическом отношении вторичная чумная пневмония также опасна, как и первичная.
Среди других осложнений бубонных форм чумы необходимо назвать менингит, который нередко развивается даже на фоне лечения антибиотиками. У взрослых присоединение менингита резко ухудшает прогноз [Butler T., 1983], тогда как у детей менингит носит более доброкачественный характер [Becker T. et al., 1987]. Примечательно, что менингит чаще развивается у лиц с аксиллярными бубонами (табл. 21). Клинически менингит выражается в виде лихорадки, головных болей и явлении менингизма. В цереброспинальной жидкости регистрируется плеоцитоз с преобладанием нейтрофилов и часто множество клеток возбудителя чумы. Заслуживает внимания указание T. Butler на то, что в некоторых случаях чумной менингит может протекать по типу первичного заболевания, когда предшествующие лимфадениты выявить не удается.

У больных, ослабленных бубонными формами чумы, возможны также осложнения неспецифического характера, включая пневмонии, рожу, флебиты, обострение туберкулеза, малярии, дизентерии и др.
Наиболее опасной в эпидемиологическом отношении и исключительно тяжёлой клинической формой болезни является первичная лёгочная чума. До начала эры антибиотиков летальность при этой форме достигала 80-100 %, но и сейчас еще она требует к себе пристального внимания. На основании клинических признаков было принято различать две стадии заболевания — до появления кашля и выделения мокроты и с начала выделения мокроты. Однако, как указывал Г. П. Руднев [1972], «далеко не всегда можно установить грань перехода, когда потенциальные распространители становятся действующим источником заразы». На этом основании он различал три основных периода лёгочной чумы: период начального лихорадочного возбуждения, период разгара болезни и сопорный (терминальный) период, с «прогрессирующей одышкой, цианозом, иногда комой». Для окружающих наиболее опасен второй период, характеризующийся обильным выделением чумного микроба при кашле с мокротой.
Как уже подчеркивалось, болезнь обычно начинается без продрома. В этом отношении весьма показательны наблюдения за лицами, которые попадали под врачебный контроль сразу же после контакта с больными [Лобанов В. Н., 1956].
Согласно наблюдениям Г. П. Руднева [1938,1972], на фоне общих признаков заболевания возникают режущие боли в груди и сильная одышка. Кашель может появляться как с начала заболевания, так и позднее, причем количество мокроты сильно варьирует (до «целых тазов»), хотя подчас она и отсутствует. В начале мокрота вязкая, затем становится пенистой, жидкой, ржавой, иногда со значительной примесью свежей крови. Жидкая консистенция мокроты — один из характерных признаков лёгочной чумы.
В фазе разгара болезни, в зависимости от стадии развития пневмонии, при перкуссии обнаруживаются очаги притупления, диффузные или сливающиеся, а при аускультации определяются влажные или сухие хрипы, жесткое дыхание.
В терминальной фазе развивается сопорозное состояние, нарастает одышка, лицо больного становится синюшным, «как лицо задыхающегося человека, изнуренного непосильной борьбой» [Руднев Г. П., 1970] Некоторые больные впадают в кому, иные же погибают во время неоднократных попыток встать и убежать.
Многие авторы [Златогоров С. И., 1915; Лобанов В. Н., 1956: Руднев Г. П., 1972; и др.] особое внимание обращают на скудность объективных данных, что не вяжется с крайне тяжёлым состоянием больных и патогномично для первично-лёгочной чумы. По результатам наблюдений Г. П. Руднева [1972], объективные данные позволяют рассматривать процесс как плевропневмонию, лобулярную или псевдолобарную пневмонию
В прежнее время продолжительность жизни при первично-лёгочной чуме колебалась от 1-го дня до 5 сут. [Златогоров С. И., 1915; Руднев Г. П., 1938], а Wu Lien-Teh и соавт.[1936] на основании анализа 1126 случаев оценили её как 1,8 дня. Но ныне положение изменилось и если антибактериальная терапия начинается не позднее 24 часов с момента появления первых признаков, то подавляющее большинство больных выздоравливают [Benenson A., 1970].
Последняя форма чумы — первично-септическая, с большей или меньшей частотой наблюдалась почти при всех эпидемиях [Минх Г. Н., 1898; Кашкадамов В., 1901; Шунаев В. В., 1933; Christie, 1918; Hill, 1912; и др.] и встречается в настоящее время [Washington R. et. al., 1979; Hull H. P. et. al., 1987]. Для этой формы чумы типичны многочисленные кровоизлияния в кожу и слизистые оболочки. Клинически септицемия проявляется также в виде гематурии, кровавой рвоты и поноса, носовых и лёгочных кровотечений. Другой типичный признак — отсутствие поражений кожи, лимфатических узлов и легких. Могут наблюдаться признаки менингоэнцефалита. Раньше эта форма быстро приводила к гибели больных, По сообщению Г. М. Минха [1898], во время эпидемии чумы в Ветлянке имелись случаи почти внезапной смерти. Однако и сейчас еще летальность при этой форме чумы достаточно высока, особенно среди больных моложе 30 лет [Hull H. P. et al., 1987].
Для врачей интересно будет узнать, что клиническая картина первично-септической чумы может быть очень сходной с синдромом Рейе [Washington R. et al., 1979].
Вторичный сепсис, представляющий собой осложнение при бубонных формах чумы, отличается от первичного наличием вторичных бубонов и также протекает очень тяжело.
Наконец, следует упомянуть о фарингеальной форме чумы, на которую особое внимание обратили во Вьетнаме во время эпидемий в 60-70-х годах. Клинически она напоминает обычные острые тонзиллиты с пораженим передних шейных лимфатических узлов. При этом в мазках и посевах из зева и содержимого бубонов обнаруживают возбудитель[22].
Возникновение фарингеальной чумы обусловлено заглатыванием или вдыханием чумного микроба. Во Вьетнаме это заболевание в подавляющем большинстве случаев наблюдали у женщин, среди которых сохранился обычай искать друг у друга головных вшей и блох и давить их зубами.
4.4. Дифференциальный диагноз
Диагностика типичных форм чумы во время её вспышек не представляет затруднений, но выявление первых случаев, особенно развивающихся атипично, часто приводит к ошибкам, что подчеркивают многие авторы, как в нашей стране, так и за рубежом. В этой связи для диагностики чумы колоссальное значение имеет не только клинический, но и эпидемиологический анамнез. Совершенно необходимо, чтобы медицинский персонал, работающий на территориях природных очагов чумы или в местах возможного заноса её — в морских портах, международных аэропортах, санитарно-контрольных пунктах на границах и т. п.), постоянно помнил об этой грозной инфекции. Обязательно надо выяснять, не находился ли заболевший в эндемичном по чуме районе и какие виды работ там выполнял (пас скот, охотился за зайцами или сурками, занимался отловом сусликов, разделывал верблюдов), не было ли заболеваний с летальным исходом среди родственников, соседей и знакомых, откуда приехал заболевший. В последнем случае рекомендуется уточнить, когда заболел пациент и каковы начальные симптомы.
Чаще всего чуму приходится дифференцировать пневмонии разной этиологии, туляремии, сибирской язвы, цереброспинального эпидемического менингита сыпного тифа, брюшного тифа и псевдотуберкулёза. Кроме того, в тропиках и в случае прибывания лиц из жарких стран, следует помнить о малярии, лихорадке денге и возвратном тифе.
Для постановки правильного диагноза надо иметь в виду следующие факты. При бубонной чуме доминирует тяжелое общее состояние, не соответствующее степени местных проявлений. Отмечается сильная болезненность при пальпации области пораженных лимфатических узлов, наличие бубона с быстро развивающимся периаденитом и сращением с окружающей клетчаткой, отсутствие лимфангитов, что отличает чумной бубон от аденитов другого происхождения, в частности от «чумоподобного» заболевания — туляремии. Мы подчеркиваем это, поскольку очаги туляремии, особенно на территории СНГ и США, нередко накладываются на очаги чумы [Butler T., 1983]. Туляремийные бубоны более резко очерчены, не спаяны с окружающими тканями, менее болезненны (как и язвы), сопровождаются первичным лимфангитом, а само заболевание протекает намного легче и в неосложненных случаях заканчивается выздоровлением.
При острых гнойных лимфаденитах банальной этиологии (стафилококковой или стрептококковой) чаще наблюдаются воспалительные гнойные процессы в местах входных ворот инфекции. Общее же состояние обычно легче, температура тела ниже и нет столь резких функциональных нарушений сердечно-сосудистой и центральной нервной систем.
Кожные проявления при сибирской язве напоминают чумные, но они не болезненны («локальная анестезия»); дополнительные высыпания пузырьков вокруг тёмноокрашенного ли даже черного струпа типичны для сибирской язвы. Еще более характерны для сибирской язвы значительная, иногда резкая, отёчность и наличие ясных лимфангитов. Общие реакции при сибирской язве выражены слабее При постановке диагноза важную роль играют лабораторные исследования, так же как при септической и кишечной формах сибирской язвы, до некоторой степени, сходных с одноименными формами чумы.
Значительные трудности для диагностики представляют редкие случаи pestis minor. При подозрительном эпидемиологическом анамнезе в постановке диагноза может способствовать бактериологическое исследование пунктатов увеличенных лимфатических узлов, содержимого везикул, крови [Wu Lien-Teh et al., 1936; Pollitzer R., 1954].
Наиболее затруднен диагноз в случаях чумной пневмонии и дифференциации её от крупозной и гриппозной пневмоний. Так, иногда мокрота больного лёгочной формой чумы может вначале иметь желтоватый или ржавый цвет, характерный для крупозной пневмонии; мокрота при крупозной пневмонии подчас приобретает вид «чумной мокроты», имеющей жидкую консистенцию в отличие от вязкой мокроты при крупозной пневмонии. Некоторое дифференциально-диагностическое значение имеет herpes labialis. не свойственный чуме. Но основным отличием чумной пневмонии является несоответствие общего тяжёлого состояния больного слабовыраженным изменениям в легких, высокая инфекциозность и частота летальных исходов в первые дни болезни. Для отличия лёгочной чумы от тяжёлых гриппозных пневмоний могут служить присущие последним гнойная мокрота, риниты и иногда наличие герпеса, а также длительное течение.
Лёгочная форма сибирской язвы может быть очень похожей на чумную пневмонию и приводить к быстрому детальному исходу. Отличительными признаками первой служат катаральные явления в верхних дыхательных путях и более выраженные объективные изменения в легких с обязательным вовлечением плевры[23]. Во время вскрытия при лёгочной форме сибирской язвы обращает на себя внимание серозный или серозно-геморрагический медиастинит, которого обычно нет при чумных пневмониях.
Лёгочная форма туляремии отличается от чумной пневмонии заметно более легким течением и, по крайней мере, как считали раньше, благоприятным исходом. При летальном же исходе в легких находят очаги казеозной пневмонии; бывают отдельные мелкие очаги, но могут поражаться и большие участки и даже целые доли. В альвеолах содержится фибринозный или фибринозно-гнойный экссудат. В то же время при чуме макроскопически видимых некрозов в легких, как правило, не бывает, не обнаруживаются также казеозные очаги и абсцессы, а серозно-геморрагический экссудат обычно не содержит фибрина [Кулеша Г. С., 1915; Лобанов В. Н., 1956].
С 70-х годов появилась необходимость, главным образом в США, лёгочную чуму дифференцировать от болезни легионеров, при которой диспноэ и диарея встречаются гораздо чаще, чем при пневмониях другой этиологии. При этом T. Butler [1983] подчеркивает наличие у больных легионеллезами антител, дающих перекрёстные реакции с таковыми у переболевших чумой, туляремией и лептоспирозами.
Необходимо напомнить, что больные сибирской язвой, туляремией и легионеллезами не заразны для окружающих.
Граница между чумой и тифами — брюшным и возвратным, устанавливается в общем легко [Руднев Г. П., 1970]. Что же касается сыпного тифа, то при тяжёлых формах дифференциация между ним и чумой — довольно трудная задача. Одномоментное появление сыпи на 4-5-й день болезни и положительная реакция Вейля-Феликса отличают сыпной тиф от первично-септической формы чумы, однако при быстротечном сыпном тифе основанием для дифференциации от чумы могут служить данные эпидемиологического анамнеза и вскрытия умерших, хотя и на секции без бактериологического анализа диагноз не всегда возможен [Лобанов В. Н., 1956]. Напомним, что вспышки сыпного тифа на фоне эпидемий чумы неоднократно приводили к диагностическим ошибкам.
При цереброспинальном эпидемическом менингите, преимущественно в начальном его периоде, имеется ряд сходных с чумой симптомов. Из числа отличительных признаков эпидемического менингита Г. П. Руднев [1970] особо выделяет весьма частое появление герпеса, типичное положение больного с запрокинутой головой, гиперестезии, положительные симптомы Кернига и Брудзинского, обычно сохраненное сознание, анизокорию и характерные изменения цереброспинальной жидкости. Как указывалось выше, менингеальные явления при чуме заканчиваются без неврологических осложнений и в основном встречаются у детей [Becker T. et al., 1987].
Особо следует остановиться на дифференциации септической формы чумы от лихорадки денге, клиническое течение которой имеет много общего с чумой: внезапное начало, высокая температура тела, головные боли, особенно в затылочной части, боли в глазных яблоках, мышцах, позвоночнике и суставах, напряженная походка, гиперемия конъюнктивы, тошнота, рвота, тахикардия, кожные высыпания, увеличение и болезненность лимфатических узлов, обложенный язык. Отличительными признаками лихорадки денге можно считать двугорбый характер температурной кривой (понижение её на 2-3-й день с последующим новым повышением), более легкое течение и почти всегда благоприятный исход [Кассирский И. А., Плотников Н. Н., 1964]. Естественно, что для России лихорадка денге является экзотической инфекцией.
Сложнее дифференцировать септическую форму чумы от пернициозной малярии. По мнению Wu Lien-Teh и соавт. [1936], в решении вопроса может помочь обнаружение в крови паразитов, однако в полевых условиях проведение анализа весьма затруднительно, да к тому же при пернициозной малярии плазмодии выявляются далеко не всегда [Pollitzer R., 1954]. Надо также иметь в виду возможность смешанных инфекций — возникновение чумы на фоне малярии. Однако во всех случаях подозрения на чуму рекомендуется начинать соответствующую терапию, не дожидаясь результатов бактериологических исследований, а у больных, которые раньше лечились от малярии, продолжать профилактику её приступов [Pollitzer R., 1954; Benenson A., 1970].
Остановимся также на дифференциации чумы от генерализованных форм псевдотуберкулёза — «скарлатиноподобной лихорадки» и токсико-септической. Необходимость в этом стала очевидной относительно недавно, после того, как были зарегистрированы эпидемические вспышки псевдотуберкулёза на Дальнем Востоке [Сомов Г. П. и др., 1990], где занос чумы из-за рубежа весьма вероятен (в частности, из Вьетнама и Маньчжурии). При многих общих симптомах начального периода (внезапность заболевания, головная боль, высокая температура тела, тошнота и рвота, боли в мышцах, повышенная возбудимость или заторможенность и др,) псевдотуберкулёз отличают от чумы следующие признаки:
— неконтагиозность инфекции и в общем благоприятный исход;
— скарлатиноподобная сыпь и сначала обложенный, а затем «малиновый» язык;
— частые рецидивы на фоне шелушения кожи;
— абсолютная или относительная брадикардия у большинства больных на фоне высокой температуры тела;
— боль в горле при глотании, гиперемия зева, налёты на миндалинах, реже — насморк, кашель, точечные энантемы на слизистой оболочке мягкого нёба и сухие хрипы в легких, а у некоторых больных с тяжёлым течением процесса — притупление при перкуссии и влажные хрипы в легких;
— отсутствие бубонов или кожных поражений;
— высокая частота изменений со стороны опорно-двигательного аппарата.
В табл. 22 приводятся данные, подтверждающие наличие в России тех инфекций, которые следует иметь в виду при постановке диагноза чумы. При этом необходимо помнить, что статистика инфекционной заболеваемости у нас далеко не полная и не всегда достоверна, что объясняется рядом объективных причин. Из их числа укажем на пелену секретности, приподнятую совсем недавно, и слабую лабораторную базу на большей части России, оставшуюся в наследство от Советского Союза. К этому добавим, что перечень инфекций, от которых приходится отличать чуму, например бубонную, гораздо больше указанного нами и включает даже такие заболевания, как инфекционные мононуклеозы, цитомегаловирусные инфекции и токсоплазмоз.

В заключение мы снова обращаем внимание на факт, мимо которого раньше проходили или не считали важным, а именно на «фарингеальную чуму» [Butler T.,1983], часто протекающую с мало характерными симптомами и потому особенно опасную для окружающих. Это заставляет тщательно обследовать всех больных с фарингитами и шейными лимфаденопатиями, подозрительных с позиций эпидемиологов.
4.5. Лечение
До появления современных антибактериальных препаратов лечение чумы было неблагодарной задачей. В прежнее время для этой цели рекомендовали различные химические препараты — карболовую кислоту, формальдегид, электригол, иод и др., но они оказались малоэффективными или совсем неэффективными [Руднев Г. П., 1938; Николаев Н. В., 1968; Wu Lien-Teh et al., 1936]. То же относится к бактериофагам, использование которых не дало однозначных результатов [Д'Эрель Ф., 1935; Руднев Г. П., 1938; Wu Lien-Teh et al., 1936].
Вскоре после того, как в 1894 г. А. Иерсен открыл чумной микроб, для лечения больных стали применять противочумную сыворотку. Предлагались разные варианты получения противочумных сывороток, однако существенной пользы от них никому получить не удалось [Руднев Г. П., 1938; Жуков-Вережников Н. Н., 1940; Wu Lien-Teh et al., 1936; Pollitzer, 1954]. Не помогло и использование специфического гамма-глобулина. Все это еще указывает на то, что гуморальный фактор в иммунитете против чумы существенной роли не играет. Тем не менее Комитет экспертов ВОЗ по чуме [1971] счёл полезными дальнейшие усилия по получению антитоксических сывороток, которые могли бы дать эффект при лечении больных с «тяжёлым токсикозом».
Положение резко изменилось с появлением сульфаниламидных препаратов, большой опыт по применению которых при лечении бубонной чумы был накоплен в Индии. По обобщенным данным S. C. Sеаl [1958], наилучшие результаты были получены при применении сульфадиазина (выздоравливало свыше 80 % больных) и сульфамерезина (87,4 %). Однако сульфаниламиды оказались неэффективными при лечении легочной и септической форм чумы, да и при бубонной форме результаты не всегда были благоприятными [Николаев Н. И., 1968]. Поэтому их пытались комбинировать с противочумной сывороткой и метиленовой синью, что иногда приводило к успеху [Жуков-Вережников Н. Н. и др., 1949]. В настоящее время сульфаниламидные препараты (триметоприм-сульфаметоксазол, сульфатон и др.) рекомендуются только для лечения бубонной чумы и в тех случаях, когда отсутствуют антибиотики. При этом следует соблюдать обычные меры предосторожности, назначая 3–4 г бикарбоната натрия при каждой даче сульфаниламидов [Комитет экспертов ВОЗ по чуме, 1971].
Сейчас основными средствами лечения всех форм чумы являются антибиотики. История их внедрения описана Н. И. Николаевым [1968] и R. Pollitzer [1954].
Из числа антибиотиков на первом месте по-прежнему стоит стрептомицин. Ни один другой препарат не был эффективнее его или менее токсичным. На основании опыта, полученного во время эпидемий во Вьетнаме, T. Butler [1983] рекомендует вводить стрептомицин внутримышечно по 15 мг на 1 кг массы тела 2 раза в день в течение 10 сут. При таком лечении у большинства больных быстро наступает улучшение и температура падает уже на 3-й день. Риск вестибулярных осложнений и потери слуха при этом минимален. В России рекомендуют вводить стрептомицин 2 раза в день по 1–3 г в день на протяжении 7-10 дней при бубонной чуме и по 3 г в день в течение 10 дней при септической форме [Наумов А. В., Самойлова Л. В., 1992].
При повышенной чувствительности к стрептомицину применяют препараты тетрациклинового ряда. Их можно вводить как парентерально (тетрациклин), так и перорально (доксициклин). Т. Butler предпочитает лечение тетрациклином (по 2–4 г в день в течение 10 дней), а в России применяют доксициклин (дневная доза 0,2–0,4 г в течение 11–14 сут.), иногда в комбинации с рифампицином [Наумов А. В., Самойлова Л. В., 1992].
При чумном менингите показан хлорамфеникол, который легко преодолевает гематоэнцефалический барьер. Применение этого препарата предпочтительнее также на фоне выраженной гипотензии. В обоих случаях хлорамфеникол вводят ежедневно внутривенно сначала по 25 мг/кг массы тела («ударная» доза), а затем 3 раза по 15 мг/кг. После клинического улучшения препарат продолжают давать per os до 10-го дня от начала лечения. При появлении изменений в костном мозге дозы хлорамфеникола можно снижать (до 30 мг/кг в день). Впрочем, при использовании хлорамфеникола изменения в костном мозге встречаются крайне редко [Butler T., 1983].
Помимо уазанных антибиотиков для лечения чумы показаны также сизомицин и гентамицин (парентерально), римфампицин и хиноксидин (перорально), но все же лучше применять стрептомицин.
В литературе неоднократно поднимался вопрос о целесообразности комбинации антибиотиков — иногда даже в сочетании с противочумной сывороткой) при лечении лёгочной и септической форм чумы, однако Николаев получал хороший эффект от применения только повышенных доз стрептомицина. В комбинированном лечении не видит также необходимости T. Butler [1983].
Как уже подчеркивалось (см. раздел 3), диагноз чумы следует неприменно подтверждать бактериологическим исслеованием. Поэтому укажем, что забор материала для исследования нужно проводить до начала антибактериальной терапии. Иначе результаты анализа могут оказаться негативными. Что же касается определения чувствительности выделенных культур к антибиотикам, то в этом необходимости мы не видим, хотя это и предписывается российскими инструкциями [Наумов А. В., Самойлова Л. В., 1992]. Ведь если не считать трудно объяснимые находки G. E. Murray и соавт. [1984], то сведениями о резистентности природных изолятов мы не располагаем. Отсутствие же эффекта от применения того или иного терапевтического агента или повышение температуры тела после её первоначального падения обычно указывает не на повышенную устойчивость к нему Y. pestis, а на развитие осложнений, вызванных другой микрофлорой [Benеnson A., 1970]. В таких случаях назначают пенициллины (ампициллин) или иные средства в зависимости от особенностей возбудителя, вызвавшего осложнение. Отметим кстати, что хотя пенициллин на чумной микроб не действует, для лечения чумы и предотвращения неспецифических осложнений можно применять большие дозы ампициллина [Butler T., 1983].
Разумеется, что помимо этиотропной терапии при чуме необходимо также симптоматическое лечение. При выраженной интоксикации больным вводят гемодез, полиглюкин, реополиглюкин, сухую или нативную плазму крови. При отсутствии этих препаратов назначают глюкозу и изотонический раствор. Введение жидкостей, как подчеркивают А. В. Наумов и Л. В. Самойлова [1992], нужно контролировать с учётом диуреза, состава электролитов и рН крови, а в случае задержки жидкости в организме необходимо применять мочегонные средства (лазикс, фуросемид и др.).
При нарушении деятельности-сердечно-сосудистой системы больным чумой назначают корамин, кофеин, камфору, эфедрин или адреналин. Кроме того, больные нуждаются в витаминах группы B (B1, B2), аскорбиновой кислоте, витамине К, а также в антигистаминных препаратах (десенсибилизирующая терапия) — димедроле, пипольфене или тавегиле. Тяжёло больным с явлениями кислородной недостаточности назначают окигенотерапию. Местные лечебные мероприятия, включая хирургическое вмешательство, показаны при бубонной и кожной формах чумы [Руднев Г. П., 1970].
Помимо отсутствия клинических симптомов заболевания, критерием выздоровления больных является отрицательные результаты поисков возбудителя в мокроте, крови и пунктатах из бубонов на 3-й, 4-й и 6-й дени после окончания лечения [Николаев Н. И., 1968].
4.6. Дополнительные замечания по диагностике чумы
Необходимо обратить внимание читателя на важность лабораторной диагностики чумы, при которой решающее слово принадлежит не врачу или эпидемиологу, а лабораторной службе [Комитет экспертов ВОЗ по чуме, 1971]. Она необходима для подтверждения всех случаев заболевания, особенно спорных или в начале вспышки среди людей, определения источника заражения, установления границ очага, решения вопросов об объеме противоэпидемических мероприятий и их отмене; не меньшее значение она имеет при обследованиях природных очагов и для контроля за последними. Основное значение при этом мы придаем бактериологическим исследованиям, поскольку только выделение культуры Y. pestis является бесспорным доказательством чумы. Все остальные методы, будь то ускоренные, серологические, а теперь и молекулярно-биологические, пригодны лишь для рекогносцировки и постановки предварительного или ретроспективного диагноза. Тут же укажем, что клинический и биохимический анализы крови имеют весьма ограниченную ценность. В этом легко убедиться, познакомившись с множеством противоречивых данных [Домарадский И. В., 1966; Butler T., 1983]. К ним следует прибегать только для контроля за состоянием больных или если при заболеваниях, от которых дифференцируют чуму, имеются характерные изменения.
Отрицательный ответ лаборатории при наличии клинических и эпидемиологических указаний на наличие чумы не исключает проведения соответствующих мероприятий [Руднев Г. П., 1972].
Для лабораторного исследования используют пунктаты бубонов, отделяемое язв, кровь, мокроту, секционный материал, органы и кровь животных, воду, пробы почвы из нор грызунов [Bahmanyar M., Cavanaugh D. C., 1976] и даже пробы воздуха из помещений, где лежат больные с «чумной пневмонией» [Николаев Н. И., 1968]. Иногда исследуют также частицы одежды или смывы с предметов, загрязненных больными. Сейчас усиленно рекомендуют подвергать лабораторному исследованию также материал из зева больных и лиц, бывших в контакте с ними. Описание методики отбора, доставки в лабораторию и подготовки материалов для исследования можно найти в специальных руководствах, например, А. В. Наумова и Л. В. Самойловой [1992] или M. Bahmanyar и D. C. Cavanaugh [1976]. Отметим лишь, что забор материала должен проводиться с соблюдением строгих мер предосторожности, особенно в тех случаях, когда имеется подозрение на легочную чуму.
Несмотря на то, что в диагностике чумы основное место мы отводим бактериологическим методам, необходимо все же остановиться и на других.
В настоящее время серологические методы исследований прочно вошли в практику во всем мире, в чём немалая заслуга работников противочумной системы СНГ [Сучков Ю. Г., 1963]. Серологические методы пригодны для массовых обследований и получения предварительных результатов; они доступны для работы в любых условиях и сравнительно недороги, чем выгодно отличаются от бактериологических методов. Роль серологических реакций особенно велика, когда необходима постановка ретроспективного диагноза у людей, лечённых антибиотиками, при стертых формах чумы или смешанных инфекциях [Bahmanyar M., Cavanaugh D. C., 1976]. Однако повторяем, что серологические методы могут давать «осечки». Одна из причин этого заключается в том, что все или почти все серологические реакции основаны на наличии у чумного микроба FI и, если у микробов FI нет, то с помощью серологических реакций обнаружить их нельзя. С другой стороны, специфичность антител неабсолютна и поэтому возможна «гипердиагностика». Об одном таком случае говорилось в разделе 3.9.2. Со вторым случаем столкнулись в Японии: при обследовании R. norvegicus было отловлено несколько крыс, дававших положительные реакции на чуму, однако изолировать от них её возбудителя так и не удалось [Suzuki T., Hotta S., 1979].
Из числа серологических реакций для широкой практики наибольший интерес представляют сейчас различные варианты гемагглютинационного теста, вытеснившие реакции агглютинации и связывания комплемента (первая — малоспецифична, вторая — слишком сложна) [Леви М. И. и др., 1964].
Для выявления чумного микроба применяют реакцию пассивной гемагглютинации (РПГА), в которой диагностикумом служат формалинизированные бараньи эритроциты, сенсибилизированные антителами к FI (нередко моноклональными), а для определения антител к чумному микробу используют РПГА с «антигенным» диагностикумом. Подробности подготовки проб к анализу, постановки реакций и учёта результатов содержатся в руководствах А. В. Нумова и Л. В. Самойловой [1992], Леви М. И. [1995], M. Bahmanyar и D. C. Cavanaugh [1976], и др.
Наряду с гемагглютинационными тестами, за последние годы все шире начинают применять различные варианты иммуноферментного анализа (ИФА). Эти методы отличаютcz относительнjq простотjq выполнения, доступность. и стабильностью реагентов, объективным учётом результатов и возможностью автоматизации. В 1982 г. на экспериментальных животных, заражённых чумой, под бактериологическим контролем была проведена сравнительная оценка ИФА и РПГА. Как показали опыты, информативность ИФА оказалась намного выше. Радиоиммунный метод [Наумов А. В., Самойлова Л. В., 1992] скажем лишь, что интереса для практики он не представляет.
Остановимся на молекулярно-биологических методах диагностики, из числа которых сейчас наибольшего внимания заслуживает гибридизация. При прочих равных условиях, молекулярная гибридизация предпочтительнее других методов в следующих случаях:
— при изучении микроорганизмов, которые трудно культивировать (вирусы, возбудители лепры или туберкулёза, лептоспиры, микоплазмы и пр.) или которые быстро меняют антигенную структуру (возбудители гриппа и ящура, кампилобактер, нейссерии и др.);
— когда иммунитет носит преимущественно клеточный характер;
— при наличии в исследуемых объектах нежизнеспособных бактерий данного вида, даже в присутствии посторонних микроорганизмов;
— если возникает необходимость быстро дать ответ о лекарственной резистентности;
— когда надо решить вопрос, не прибегая к опытам in vivo, обладает ли штамм вирулентностью или токсигенностью.
Для диагностики возбудителя чумы предложены полинуклеотидные зонды, в частности относительно небольшой (900 пар оснований) фрагмент pPst [McDonough K. A. et al., 1988]. Было показано, что этот зонд пригоден для выявления чумного микроба у блох и в органах животных [Thomas et al., 1989]. С его же помощью K. A. McDonough и S. Falkow [1989] смогли найти объяснение роли плазмокоагулазы и фибринолизина в экологии чумного микроба. Сходный зонд (pLD625) получен также мною совместно с А. Л. Мельниковым [а. с. СССР, № 284593 от 11.10.88, с приоритетом от 27.10.87]. Поскольку оба зонда получены из pPst, присущей только чумному микробу, они обладают высокой специфичностью.
Относительно недавно сконструирован также олигонуклеотидный зонд [Kapperud G. et al., 1990]. Это стало возможным после расшифровки нуклеотидной последовательности гена вирулентности yopA на pCad [Forsberg A. et al., 1987; Skurnik M. и Wolf-Watz H., 1989]. В отличие от зонда на основе pPst этот зонд обладает групповой специфичностью — выявляет вирулентные штаммы Y. pestis, Y. pseudotuberculosis и Y. enterocolitica. Тем не менее в сочетании с зондом на основе pPst олигонуклеотидный зонд может помочь повысить эффективность поиска возбудителя чумы в природных очагах, особенно в межэпизоотический период.
До сих пор применению молекулярной гибридизации в полевой практике мешает необходимость маркировки зондов радионуклидами [Наумов А. В., Самойлова Л. В., 1992] и связанная с этим трудность регистрации результатов. Поэтому мы разработали другой метод маркировки зондов, включая олигонуклеотидные. Принцип его заключается в гаптенизации азотистых оснований в составе зондов, получении к ним специфических антител и регистрации результатов, как при ИФА. Этот принцип не нов, но в сочетании с некоторыми особенностями его реализации он приобрел определенную оригинальность, позволяющую рассчитывать на возможность его широкого применения [а. с. СССР, № 1637336 от 3.05.89 и № 1659487 от 2512.88].
В последнее время в практику исследований на чуму начинают внедрять полимеразную цепную реакцию (ПЦР), которая лишена многих недостатков, присущих гибридизации, и позволяет в течение нескольких часов определить единичные клетки возбудителя.
В заключение упомянем еще об одном ускоренном методе выявления чумного микроба, обладающем большой разрешающей способностью. Мы имеем в виду реакцию нарастания титра фага [Домарадский И. В. и др., 1957]. Принцип метода основан на том, что титр индикаторного фага резко, на несколько порядков, возрастает в присутствии живых бактерий — его хозяев, и не изменяется в контрольных пробах, где этих бактерий нет. К недостаткам метода можно отнести необходимость титрования фага по методу Грация, однако сейчас предложены модификации метода, которые лишены этого недостатка, хотя и нуждаются еще в доработках [Апарин Г. П., Голубинский Е. П., 1989; Голубинский Е. П. и др., 1992].
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ