17 ЛЕКАРСТВА И ДРУГИЕ БИОЛОГИЧЕСКИЕ МЕТОДЫ ЛЕЧЕНИЯ
В этой главе рассматриваются вопросы применения лекарств, электросудорожной терапии (ЭСТ) и психохирургических методов лечения. Психологическая терапия будет обсуждена в следующей главе. Такое разделение удобно для описания методов лечения, однако оно не означает, что при рассмотрении плана лечения отдельного пациента эти два метода альтернативны; наоборот, во многих случаях показано их одновременное использование. В этой книге способы сочетания различных методов терапии рассматриваются при описании лечения отдельных синдромов. Это важно помнить при чтении данной и следующей глав.
Мы акцентируем внимание прежде всего на клиническом применении лекарств, поскольку предполагается, что основы психофармакологии читателю уже известны. Адекватное знание механизма действия лекарств важно для рационального их применения, но следует высказать некоторые предостережения. Клиницист не должен считать, что терапевтический эффект психотропных препаратов полностью объясняется их известными в настоящее время фармакологическими свойствами. Например, существенное запаздывание терапевтического эффекта антидепрессантов и антипсихотических средств указывает на то, что быстрое действие этих соединений на нейротрансмиттеры (нейромедиаторы) является только первым звеном в цепи биохимических изменений.
Это не означает, что фармакологические механизмы, достаточно глубоко изученные со времени введения этих средств в практику в 1950-х годах, неважны для понимания их терапевтического действия. Наоборот, они подлежат все более серьезному учету при назначении и употреблении этих лекарств.
Общие вопросы
ФАРМАКОКИНЕТИКА ПСИХОТРОПНЫХ СРЕДСТВ
Прежде чем психотропные средства смогут оказать терапевтический эффект, они должны достичь мозга в адекватных количествах, а это зависит от их абсорбции, метаболизма, экскреции и проникновения через гематоэнцефалический барьер. Дадим краткий обзор этих процессов. Читатель, который никогда не изучал этого вопроса, может обратиться к монографии Goldstein et al. (1974).
Психотропные лекарства, вообще говоря, легко всасываются из кишечника, поскольку они липофильны и не сильно ионизированы при физиологическом уровне pH. Как и другие лекарства, они быстрее всасываются из пустого желудка и в меньших количествах абсорбируются у пациентов с усиленной перистальтикой кишечника, синдромом недостаточности всасывания или последствиями частичной гастрэктомии.
Большинство психотропных средств в печени подвергаются метаболизму, который начинается при прохождении лекарства через печень по портальной системе на пути от кишечника. Эта «первая фаза» метаболизма уменьшает количество действующего в организме препарата. Вот почему при введении лекарства, например хлорпромазина, через рот необходимы большие его дозы по сравнению с интрамускулярным введением. Степень такого метаболизма в печени у разных людей различна. На метаболизм влияют и другие лекарства, применяемые одновременно, поскольку они могут стимулировать действие энзимов в печени (например, барбитураты) или ингибировать его (например, ингибиторы моноаминоксидазы). Некоторые лекарства — к ним относится и хлорпромазин — сами стимулируют свой метаболизм, особенно при длительном применении. Не все лекарственные метаболиты неактивны. Так, хлорпромазин превращается в 7-оксидериват, который обладает терапевтическим действием, а также в сульфоксид, который неактивен. Поскольку хлорпромазин, диазепам и многие другие психотропные лекарства порождают множество метаболитов, измерение концентрации этих препаратов в плазме крови не дает достаточно оснований для оценки терапевтического эффекта.
Психотропные средства распределяются в плазме, причем большинство из них связываются с протеинами. В частности, диазепам, хлорпромазин и амитриптилин связаны почти на 95 %. Как высоколипофильные, они легко переходят из плазмы в мозг, а также проникают в жировые ткани, откуда высвобождаются медленно, в течение длительного времени после того, как пациент перестал принимать лекарство.
Большинство психотропных средств и их метаболитов выводятся из организма в основном почками. Если функция почек нарушена, выделение замедляется, поэтому необходимо назначать уменьшенную дозу лекарства. Для препаратов со щелочной или кислой реакцией почечная экскреция зависит от pH мочи. Например, амфетамин, который является слабой щелочью, выделяется быстрее, если моча имеет кислую, а не щелочную реакцию. Литий фильтруется пассивно и частично реабсорбируется по тому же механизму, что и натрий. Эти два иона конкурируют при абсорбции: реабсорбция лития усиливается при ослаблении реабсорбции натрия, и наоборот. Определенные фракции липофильных препаратов, в том числе хлорпромазина, частично выделяются с желчью и вторично попадают в кишечник, откуда также частично реабсорбируются. Таким образом, определенная часть лекарства повторно совершает путь между кишечником и печенью.
Под воздействием описанных механизмов концентрация в плазме лекарств, применяемых в стандартной дозе, у разных пациентов существенно колеблется. Десятикратные различия наблюдались при применении антидепрессанта нортриптилина. Поэтому можно было бы ожидать, что измерение концентрации циркулирующих лекарств в плазме поможет клиницисту подбирать дозы. Но в силу множества обстоятельств это бывает редко. Во-первых, потому, что соотношение между концентрацией в плазме и клиническим эффектом у разных людей различно. Во-вторых, психотропные лекарства связываются преимущественно с протеинами плазмы. Обычно измеряется общая концентрация лекарства, но более важна именно свободная фракция, а соотношение свободной и связанной фракций у разных пациентов совершенно различно. В-третьих, многие лекарства (как уже упоминалось) имеют метаболиты, одни из которых обладают терапевтическим действием, а другие — нет. Отдельные методы измерения концентрации слишком специфичны: определяется только сам препарат, а не его активные метаболиты; другие способы дают слишком общую картину (одновременно определяются все метаболиты — как активные, так и неактивные). Поэтому действительно полезны, да и то лишь для предупреждения токсических эффектов, только рутинные измерения концентрации в плазме простейшего психотропного средства — карбоната лития.
Альтернативой измерению концентрации лекарств в плазме может быть определение фармакологических свойств, ответственных за терапевтический эффект. Этот путь испробован при изучении нейролептиков — измерялась их блокирующая дофаминовые рецепторы активность. Эти методы остаются пока экспериментальными.
Концентрация лекарственных веществ в плазме крови изменяется в течение суток, повышаясь непосредственно после приема дозы и впоследствии снижаясь в темпе, который неодинаков для различных препаратов и для разных больных. Период времени, в течение которого происходит такое снижение после однократного приема лекарства, колеблется от нескольких часов для карбоната лития до нескольких недель для медленно выделяющихся из организма препаратов, в частности некоторых парентерально вводимых нейролептиков. Знание этих различий позволяет принять наиболее рациональное решение при подборе интервала между приемами доз.
Если одновременно вводятся два психотропных средства, то одно из них может либо усилить, либо затруднить действие другого. Их взаимное влияние может возникать вследствие изменений абсорбции, связывания с протеинами, метаболизма или экскреции. Возможно взаимодействие фармакодинамических процессов.
Для психотропных средств взаимодействие, обусловленное влиянием на абсорбцию, редко имеет какое-либо значение, хотя следует отметить замедление абсорбции хлорпромазина антацидами. Взаимодействия, вызванные связыванием с протеинами, встречаются редко, хотя метаболит трихлоруксусной кислоты может «оторвать» варфарин от альбумина. Взаимодействия, влияющие на метаболизм, весьма важны. Это, например, торможение метаболизма симпатомиметических аминов ингибиторами моноаминоксидазы и интенсификация метаболизма хлорпромазина и трициклических антидепрессантов барбитуратами, индуцирующими соответствующие энзимы. Взаимодействия, обусловленные влиянием на почечную экскрецию, наиболее важны для лития, выделение которого усиливается ацетазоламидом, аминофиллином и бикарбонатом натрия. Фармакодинамическое взаимодействие может быть представлено антагонизмом гуанетидина и трициклических антидепрессантов.
Как правило, отдельное лекарство может быть применено, чтобы вызвать ряд эффектов, наступающих при комбинации нескольких препаратов. Например, многие трициклические антидепрессанты обладают и анксиолитическими свойствами. Желательно по возможности избегать комбинаций психотропных лекарств. Если же такая комбинация нужна, важно учитывать возможные взаимодействия упомянутых лекарств.
Многие психотропные лекарства в течение нескольких дней не оказывают своего полного эффекта. Например, антидепрессанты могут применяться до трех недель для достижения терапевтического эффекта. После отмены лекарств часто наблюдается длительный период, когда их действие продолжается. Что же касается некоторых препаратов, то приспособление отдельных тканей к их отмене требует времени, с чем и связаны клинические проявления синдрома абстиненции. Среди психотропных средств чаще всего такой эффект вызывают снотворные и анксиолитики. После отмены снотворных восстановительные процессы в клиническом плане сопровождаются нарушениями сна, а в физиологическом — увеличением фазы быстрых движений глаз (REM-сна). Такие явления развиваются, например, при отмене больших доз нитразепама. Отмена меньших доз вызывает только нарушения сна без изменения REM-фазы (Adam et al. 1976). Если же симптомы не оцениваются как следствие отмены лекарства, то они могут ошибочно интерпретироваться как непосредственное проявление нарушения сна, требующее дальнейшего применения снотворных. Симптомы абстиненции также возникают при резкой отмене бензодиазепинов, которые больной принимал в дневное время (см.).
Лучше применять достаточно известные лекарства с хорошо изученными терапевтическими и побочными эффектами. Клиницист должен хорошо знать небольшое количество лекарств, входящих в основные группы: два или три антидепрессанта, два-три нейролептика и т. п. Только в этом случае он может выбирать необходимую дозу, учитывая побочные эффекты. (Рекомендации к выбору лекарств можно найти в следующих частях этой главы.) Кроме того, хорошо известные лекарства обычно дешевле, чем новые препараты.
Выбрав лекарство, врач должен выписать его в необходимой дозе. Ни в коем случае нельзя заменять лекарство или добавлять другие без достаточно серьезных оснований. Вообще, если нет терапевтического эффекта от применения назначенного больному лекарства, то нет оснований рассчитывать, что другой препарат той же терапевтической группы окажется более эффективным (при условии, что первый применялся в адекватных количествах). В то же время, поскольку обычно главное препятствие при выборе адекватной дозы лекарства — это прежде всего вызываемые им побочные явления, иногда целесообразно заменить одно лекарство другим из этой же терапевтической группы с иной выраженностью побочных явлений, например один трициклический антидепрессант заменить другим, обладающим менее сильным холинолитическим эффектом.
Некоторые лекарства выпускаются в виде комбинации различных препаратов в одной таблетке, например трициклический антидепрессант в сочетании с небольшой дозой фенотиазинового нейролептика. Ценность таких комбинированных препаратов сомнительна. Если требуется применение двух лекарств, лучше назначать эти лекарства по отдельности, чтобы был возможен адекватный подбор доз каждого из препаратов.
При назначении лекарства необходимо определить его дозу, интервал между приемами доз и примерную длительность лечения. Дозы обычно применяемых лекарств будут приведены далее в этой главе. Дозы других лекарств можно найти в изданиях British national formulary или в иных соответствующих справочниках. В пределах диапазона терапевтических доз конкретная индивидуальная доза лекарства должна быть установлена с учетом тяжести симптомов, возраста и веса больного, а также других факторов, которые могут повлиять на метаболизм лекарства (например, других применяемых лекарств, болезни почек и др.).
Затем необходимо установить интервал между приемами лекарства. Психотропные средства часто применяются три раза в день, несмотря на то, что длительность их действия позволяет ограничиться двумя приемами без нежелательного снижения концентрации лекарства в крови в период между ними. Чем реже назначен прием лекарства, тем точнее амбулаторные больные будут выполнять назначение. В больнице же менее частое применение лекарств позволяет ухаживающему персоналу больше внимания уделять психологическим факторам лечения. Некоторые препараты, такие как анксиолитики, необходимы для немедленного эффекта в большей степени, чем для длительного действия. Поэтому их не следует давать через регулярные интервалы: целесообразно прибегать к ним лишь тогда, когда обычно у больного возникает ухудшение и ожидается наибольшая выраженность симптомов. Длительность лечения зависит от болезни, которую лечат; эти вопросы рассматривались в главах, посвященных клиническим синдромам.
Прежде чем впервые назначить больному лекарство, врач должен провести с ним беседу, разъяснив, какие эффекты могут возникнуть при первом приеме лекарства, например сонливость или сухость во рту, а также сообщить, сколько времени пройдет до появления терапевтических результатов и каковы будут их первые проявления (в частности, улучшение сна после начала применения трициклического антидепрессанта). Врач обязан перечислить сопутствующие лечению серьезные побочные эффекты, о которых больной должен немедленно сообщить ему (например, появление тремора после приема лития). Наконец, нужно указать, Как долго больному следует принимать назначенное лекарство. Для некоторых препаратов, таких как анксиолитики, эта информация должна предостеречь больного от слишком длительного применения лекарства. В других случаях, когда, например, применяются антидепрессанты, необходимо предостеречь больного от преждевременного прекращения приема лекарства.
Многие больные не принимают назначенные им лекарства. Проблема усложняется при лечении амбулаторных больных, но и в больницах некоторые пациенты находят способы не принимать лекарства, которые им выдает медперсонал.
Пациент, соглашаясь на прием того или иного лекарства, должен быть уверен в необходимости его употребления, освободиться от необоснованных опасений относительно вредности этого лекарства, а также знать, как его принимать. Каждое из этих условий нелегко выполнить при лечении психически больных. Так, многие больные шизофренией и тяжелой депрессией часто не признают себя больными, требующими лечения, а другие просто не желают вылечиться. Пациенты с бредовыми идеями могут не доверять врачу, а ипохондрические больные боятся побочных эффектов. Тревожные больные часто забывают прописанную дозу и частоту приема лекарств. Поэтому неудивительно, что многие психически больные не принимают лекарств так, как они им назначены. Важно, чтобы клиницист не упускал из виду эту проблему. Время, затраченное на разъяснение больному ошибочности его опасений, — это рационально использованное время, способствующее укреплению контакта врача с больным. (Подробный обзор по вопросу о согласии больного на лечение см. у Haynes et al. (1979).)
В последние 30 лет было создано много безопасных и эффективных препаратов для лечения психических заболеваний. К сожалению, их бесспорная эффективность при лечении тяжелых форм заболеваний привела к ненужному их назначению в легких случаях, когда выздоровление возможно и без применения медикаментов. Эти лекарства, как безопасные, назначают на длительное время вместо того, чтобы ограничиться более разумным кратковременным их применением. Эти проблемы в основном касаются использования лекарственных средств для лечения бессонницы, тревоги и депрессивного настроения. Все три симптома являются важным компонентом психических заболеваний, но в своих наиболее легких проявлениях они встречаются также в повседневной жизни практически здорового человека. Насколько распространенной практикой стало применение анксиолитических и антидепрессивных лекарств, установлено при учете всех назначений, сделанных в общей практике при лечении 40 тыс. пациентов (Skegg et al. 1977). Было обнаружено, что психотропные средства назначались значительно чаще, чем любые другие лекарства. Среди пациентов, зарегистрированных в соматическом отделении, почти 10 процентам мужчин и более чем 20 процентам женщин в течение года хотя бы один раз назначался психотропный препарат. Среди женщин в возрасте 45–49 лет не менее одной трети получали такое назначение.
Отметим, что, с одной стороны, тревожит излишнее употребление психотропных препаратов из-за непомерно широкого их назначения, а с другой — не меньшее беспокойство вызывает тот факт, что очень много назначаемых препаратов больные не принимают. Nicholson (1967) в течение шести дней собирал неиспользованные лекарства от 500 больных по месту их проживания. Он обнаружил 36 тыс. таблеток, в том числе около 5 тыс. успокаивающих средств и транквилизаторов, свыше 2 тыс. — снотворных и 750 таблеток антидепрессантов. Неиспользованные лекарства — угроза для детей и потенциальный источник для отравления как самого больного, так и других людей. Ввиду этого пациентам не следует давать больше лекарств, чем им требуется, и необходимо выяснять, использованы ли уже имеющиеся препараты, прежде чем выписывать новые.
Дети редко нуждаются в назначении лекарств по поводу психических нарушений. Если все же они в этом нуждаются, соответствующие дозы должны устанавливаться после ознакомления с новейшими рекомендациями современных справочных изданий (например, British national formulary). Лечение пожилых пациентов, которые нередко весьма чувствительны к побочным реакциям и у которых могут быть нарушения функций почек и печени, важно начинать с малых доз.
Особые проблемы возникают при назначении психотропных лекарств беременным ввиду риска тератогенеза. Этот риск, далеко не одинаковый для различных лекарственных препаратов, будет обсужден далее при описании действия лекарств. Здесь дадим только некоторые общие рекомендации. Анксиолитические и седативные препараты редко необходимы в начале беременности, обычно достаточно ограничиться психологическими методами лечения. Если же применение лекарств необходимо, следует учесть, что бензодиазепины, как установлено, не обладают тератогенным действием. Если необходимо употребление антидепрессантов, очевидно, лучше назначать давно применяемые препараты, такие как имипрамин и амитриптилин, которые, как установлено, также не обладают тератогенным действием. Никогда не следует применять лекарств, даже если они и признаны безопасными, которые только недавно введены в употребление. Очень редко имеет смысл назначать нейролептики в начале беременности. Но если пациентка их уже употребляет, необходимо сопоставить риск рецидива заболевания в случае, если препарат будет отменен, с риском его тератогенного действия и принять ответственное, взвешенное решение. В настоящее время нет данных о том, что эти лекарства повреждают плод, но, как уже отмечалось, степень неопределенности возрастает с назначением более новых лекарств и падает, когда применяются давно проверенные препараты. Поэтому разумно по возможности избегать употребления этих лекарств в первую треть беременности (Edlung, Craig 1984). Не следует начинать лечение карбонатом лития на ранних сроках беременности, но некоторые пациентки беременеют в период, когда они уже принимают это лекарство. Имеются данные о том, что употребление лития ведет к повреждениям плода, особенно поражая сердце (см.). Поэтому следует отменить прием этого лекарства, а для контроля аффективных нарушений назначить (если это необходимо) нейролептики или трициклические препараты, поскольку их применение менее рискованно. Принимающие литий в поздние сроки беременности должны по возможности прекратить его прием перед родами и в любом случае не принимать очередных доз во время родов. Необходимо часто измерять концентрацию лития в сыворотке крови и избегать применения диуретиков.
Ввиду того, что тератогенное действие новых психотропных препаратов с абсолютной точностью оценить нельзя, целесообразно по возможности избегать их применения в ранние периоды беременности. Следует рекомендовать женщинам детородного возраста, нуждающимся в приеме психотропных средств, пользоваться надежными методами контрацепции, с тем чтобы не забеременеть до тех пор, пока не отпадет необходимость применять эти лекарства.
Психотропные препараты нужно с большой осторожностью назначать женщинам, кормящим грудью. Диазепам и другие бензодиазепины легко переходят в молоко и могут вызывать заторможенность, сонливость и гипотонию у новорожденных. Нейролептики и антидепрессанты также, хотя и в меньшей степени, чем диазепам, проникают в молоко. Легко поступает в молоко карбонат лития, и концентрация препарата в сыворотке крови у новорожденных приближается к уровню его концентрации в крови матери, поэтому кормление грудью в таких случаях противопоказано. (См. обзор в «Drugs and Therapeutics Bulletin» (1983), а также у Loudon (1987).)
В первую очередь нужно установить, принимает ли больной лекарство в назначенной дозе. Пациент мог не понять данных ему инструкций или не соблюдать их, боясь, что полная доза повлечет за собой неблагоприятные эффекты. Некоторые пациенты опасаются, что при регулярном употреблении лекарства у них сформируется зависимость от него, другие могут избегать приема лекарства по иным причинам, в частности, шизофреники нередко не хотят лечиться, потому что не считают себя больными, а депрессивные больные — потому, что не верят в возможность облегчения. Если врач убедился, что лекарство применяется правильно, он должен выяснить, не принимает ли больной еще какие-либо лекарства (например, барбитураты), которые могут влиять на метаболизм психотропного препарата. Наконец, он должен еще раз убедиться в правильности диагноза и лечения, прежде чем принять решение о повышении дозы, если это необходимо.
После испытаний на животных новые лекарственные средства должны быть оценены в отношении их клинического применения. Лекарство следует употреблять с осторожностью и в дозах, достаточных для достижения терапевтического эффекта без побочных явлений. Необходимо провести контрольные клинические исследования, при которых препарат (при использовании двойного слепого метода) сравнивается с плацебо или с другим (стандартным) лекарством. Информацию о методах клинических испытаний можно найти в работе Harris и Fitzgerald (1970). В этом разделе рассматривается только несколько важных вопросов, о которых необходимо помнить, читая о результатах испытаний новых психотропных средств. Эти вопросы касаются отбора больных, методов лечения и оценки.
Больные
При оценке результатов клинических испытаний клиницист должен решить, насколько отобранные больные типичны для всей группы, в которой имеется данное нарушение (например, больные шизофренией представляют собой весьма разнообразную группу), и насколько они соответствуют тем пациентам, которых он намерен лечить (например, хронических шизофреников, подлежащих реабилитации). Процедура отбора больных частично описывается исследователями, но некоторые ее стороны отражаются недостаточно четко. Так, если клиническое испытание ограничено амбулаторными больными, необходимо установить, какие именно (по характеру своего заболевания) больные направлены местным общепрактикующим врачом в соответствующую клинику. Например, важно знать, направляют ли туда большинство больных депрессивными расстройствами или только тех, у кого не наблюдалось улучшения после применения антидепрессантов. В последнем случае речь будет идти о проводимом на базе больницы испытании с резистентными к терапии больными.
Важно найти ответ на следующие вопросы: как устанавливался диагноз и употреблялись ли для этого стандартные и общепринятые диагностические методы; сколько больных из общего числа первоначально направленных для испытания были отсеяны; сколько пациентов из включенных в группу испытуемых затем выбыли и были заменены другими? Требуется также решить еще одну проблему: каково было бы состояние больных без лечения? Этот вопрос особенно относится к тем случаям, когда делается заключение о результатах исследования, в котором не использовалось плацебо. Если у больных, которые применяли новые лекарства, улучшение было таким же, как и при лечении стандартным препаратом, можно полагать, что у больных, отобранных для исследования, наблюдался высокий уровень спонтанных ремиссий. В конце необходимо установить, были ли больные в сравниваемых группах отобраны на основе случайного распределения (т. е. без тенденциозного подбора. — Ред.).
Лечение
Первый вопрос касается дозировки, интервалов между дозами; нужно также выяснить, все ли больные получали одинаковое количество препарата и допускалось ли одновременно применение других лекарств. Важно решить, проводилось ли лечение достаточно длительное время. Почти все клинические испытания предусматривают меры для обеспечения того, чтобы ни пациенты, ни персонал не были информированы о терапии, получаемой каждым из больных («двойной слепой метод»). Идентичные таблетки не всегда позволяют достичь указанной цели, потому что побочные эффекты, такие как сухость во рту, тремор, постуральная гипотензия, могут дать ключ к идентификации одного или нескольких препаратов. Ввиду этого важно изучать частоту и характер побочных эффектов, о которых сообщают пациенты каждой группы.
Важно также знать, какие меры приняты для обеспечения того, чтобы больные принимали назначенные им лекарства. Эти меры включают в себя пересчитывание всех таблеток, остающихся после окончания каждого периода лечения; измерение уровня содержания лекарства в плазме крови; введение в таблетку маркера, такого как рибофлавин, который легко определяется в моче (легче, чем само лекарство).
Оценка
При выборе метода оценки для клинического испытания должен соблюдаться определенный баланс между требованиями точности и надежности, с одной стороны, и уместностью данной методики в клинической практике — с другой. Психологические тесты могут быть надежными и точными, но их обычно сложно применить в повседневной клинической практике для оценки результатов испытания. Психиатрические схемы для оценок менее надежны и точны, однако более удобны. Важно также решить, достаточно ли чувствительны используемые методы оценки в пределах изменений состояний, которые ожидаются во время испытания: так, методы оценки, применимые в случае тяжелых депрессий у пациентов, лечение которых проводится в больнице, могут не соответствовать состоянию больных с легкими формами депрессии в общей практике. Время проведения оценок также должно быть учтено. Например, были ли они начаты достаточно рано и продолжались ли достаточно долго. Наконец, должны быть рассмотрены и вопросы адекватности статистических методов. Если сообщается о наличии статистически значимых изменений, требуется решить, достаточно ли они велики для обоснования введения нового метода лечения.
Классификация лекарств, применяемых в психиатрии
Лекарства, оказывающие воздействие главным образом на психопатологические симптомы, называются психотропными. Психиатры часто используют и две другие группы лекарств: антипаркинсонические, применяемые для устранения побочных явлений психотропных препаратов, и противоэпилептические средства.
Психотропные лекарства подразделяются на пять групп (табл. 17.1). Анксиолитические средства уменьшают тревогу. Иногда их называют также малыми транквилизаторами, поскольку они действуют успокаивающе, но обычно недостаточно сильно, чтобы купировать возбуждение у больных тяжелой шизофренией или выраженной манией (лекарства, которые эффективны в таких случаях, иногда называют большими транквилизаторами). В больших дозах анксиолитики вызывают сонливость, поэтому их определяют также как анксиолитически-седативные средства. В еще больших дозах они вызывают сон, так что группа анксиолитиков частично перекрывается с группой снотворных. Антипсихотические средства контролируют ряд симптомов шизофрении, мании и органических психозов. Как уже указывалось, они иногда называются большими транквилизаторами. В связи с характерным побочным действием их называют также нейролептиками (этот термин принят в отечественной психиатрии. — Ред.). Следующую группу представляют антидепрессанты, которые купируют симптомы депрессивного расстройства, хотя и не влияют на настроение здоровых людей. Лекарства, действующие на настроение здоровых людей, называются стимуляторами центральной нервной системы. Они редко применяются в психиатрической практике.
Таблица 17.1. Классификация лекарств, обычно применяемых в психиатрии
а) Психотропные средства
• Анксиолитики
• Снотворные
• Антипсихотические (нейролептики)
• Антидепрессанты
• Стимуляторы
б) Другие средства
• Антипаркинсонические
• Антиэпилептические
Не все лекарства, применяемые в психиатрии, входят в эту схему. Карбонат лития обладает умеренным антидепрессивным действием (см.) и купирует симптомы мании, но в основном он применяется для предупреждения рецидивов этих состояний. Дисульфирам и карбамид-цитрат кальция используются при лечении алкоголизма. Гормоны и витамины употребляются для некоторых специальных целей, а антибиотики — для лечения нейросифилиса и других инфекционных поражений мозга. Однако приведенная схема классификации полезна, поскольку она соответствует British national formulary — стандартному источнику информации о лекарственных средствах.
Пять основных групп психотропных средств будут далее рассмотрены по порядку: для каждой группы будут даны характеристики терапевтического действия, фармакологии, основных доступных препаратов, фармакокинетики, нежелательных реакций (как тех, которые возникают при терапевтических дозах, так и токсического действия при чрезмерно больших дозах) и противопоказаний. Относительно употребления лекарств каждой группы в повседневной клинической практике будут даны общие рекомендации, а их специфическое применение для лечения отдельных расстройств описано в главах, где обсуждаются эти расстройства. Лекарства, которые имеют ограниченное применение в лечении какого-либо одного расстройства, например дисульфирам при алкоголизме, рассматриваются в главах, посвященных соответствующим клиническим синдромам.
Анксиолитики
Препараты, являющиеся анксиолитическими в малых дозах, вызывают сонливость и сон, если применяются в больших дозах. Прописывают эти средства очень широко и нередко без достаточных оснований. Прежде чем их назначать, всегда следует выяснить источники тревоги и попытаться воздействовать на них. Важно также иметь в виду, что определенная степень тревоги может формировать у больных мотивацию к принятию мер для решения проблем, порождающих эту тревогу. Поэтому полное купирование тревоги на короткое время не всегда благоприятно для больного в дальнейшем. Анксиолитики наиболее полезны, если их применять в течение короткого времени для того, чтобы помочь больному преодолеть кризис либо справиться с конкретной проблемой. Толерантность, по-видимому, раньше или позже развивается по отношению ко всем анксиолитическим средствам. Поскольку в настоящее время наиболее широко применяемыми анксиолитиками являются бензодиазепины, они довольно подробно будут рассмотрены первыми. Другим препаратам уделено меньше внимания. Во время чтения этого раздела важно помнить, что психологические методы лечения также могут применяться для борьбы с тревогой (см.).
Фармакология
Бензодиазепины действуют анксиолитически, седативно, а в больших дозах вызывают и снотворный эффект. Они обладают также миорелаксирующим и противосудорожным действием. Их фармакологический эффект реализуется через специфические рецепторы, расположенные в супрамолекулярном комплексе с рецепторами ГАМК. Бензодиазепины усиливают нейротрансмиссию ГАМК, опосредованно изменяя активность других нейротрансмиттерных систем, в частности норадренергической и серотонинергической.
Доступные препараты
Исследования в коммерческих лабораториях привели к созданию множества препаратов на основе бензодиазепиновой структуры, но все полученные лекарства сходны по действию. Клиницисту в его практике необходимы только два препарата: один — кратковременного, а другой — длительного действия. Кратковременно действующие соединения — сюда входят оксазепам, лоразепам, темазепам и триазолам — наиболее показаны в случаях, когда необходимо кратковременное действие. Как уже отмечалось, лекарства кратковременного действия, видимо, чаще вызывают зависимость и должны назначаться с осторожностью. Соединения длительного действия (диазепам, хлордиазепоксид, нитразепам, клобазам, хлоразепат и др.) более соответствуют тем случаям, когда необходимо продолжительное действие. Хорошей комбинацией двух препаратов является лоразепам в дозе 3–10 мг в день, разделенной на несколько приемов, и диазепам 6–30 мг в день, также в несколько приемов. Обычно применяют нитразепам в качестве снотворного, но в общем более целесообразно использовать препарат с меньшей длительностью действия, чтобы избежать остаточных явлений на следующий день. Альпразолам считается более эффективным, чем другие бензодиазепины, для снятия панических приступов, но при сравнительных испытаниях альпразолама и других бензодиазепинов в эквивалентных дозах заметного его превосходства не отмечено (см.).
Фармакокинетика
Бензодиазепины всасываются быстро. Они крепко связываются с протеинами плазмы и благодаря липофильности легко проникают в мозг. Они метаболизируются в большое число соединений, многие из которых обладают собственным терапевтическим эффектом; например, среди продуктов метаболизма диазепама имеются темазепам и оксазепам. Выделяются в основном в виде конъюгатов с мочой (Schwartz 1973 — обзор).
Нежелательные эффекты
Бензодиазепины хорошо переносятся. В случаях применения их как анксиолитиков их главное побочное действие связано с седативными свойствами больших доз, что может привести к атаксии и сонливости (особенно у пожилых) и изредка — к спутанности мышления. Легкая степень сонливости, нарушение координации движений и способности к оценке ситуаций могут затруднить управление транспортными средствами и работу с потенциально опасными механизмами, тем более что люди, испытывающие такое воздействие, не всегда осознают это (Betts et al. 1972). Поэтому при назначении бензодиазепинов, особенно длительного действия, больных необходимо предупредить об этих опасностях, а также о потенцировании такого эффекта алкоголем. Назначающий эти препараты должен помнить, что подобные явления особенно часты у пожилых, а также у пациентов с поражениями функций почек и печени. Хотя бензодиазепины при некоторых обстоятельствах уменьшают напряжение и агрессию, в определенных дозах они могут привести к высвобождению агрессивности, подавляя сдерживающие начала у больных с тенденциями к агрессивному поведению (DiMascio 1973). В этом отношении они подобны алкоголю. Об этом эффекте следует помнить, назначая их женщинам, склонным к плохому обращению с детьми.
Токсические эффекты
У бензодиазепинов мало токсических эффектов. Больные выздоравливают после больших передозировок, поскольку эти лекарства не угнетают дыхания и не снижают давления, как это свойственно барбитуратам. Не было сообщено убедительных данных об их тератогенном действии, но желательно все же не назначать эти препараты в первой трети беременности, если нет достаточно веских показаний к их применению. Церебральная атрофия была отмечена при компьютерной томографии у некоторых больных, длительно принимавших бензодиазепины, но не было доказано, что она вызвана препаратами, а не сопутствующими болезни факторами (Lader et al. 1984).
Взаимодействие с другими лекарствами
Бензодиазепины, как и другие седативные анксиолитические средства, потенцируют эффект алкоголя и других угнетающих центральную нервную систему средств.
Эффекты отмены
Ныне общепризнанно, что при длительном применении бензодиазепинов развивается физическая зависимость, частота которой определяется препаратом и дозой. Испытывают ее от 5 до 50 % больных, принимающих эти препараты более шести месяцев (Hallstrom 1985). Зависимость приводит к синдрому абстиненции, характеризующемуся тревогой, бессонницей, тошнотой и рвотой, тремором и повышенной чувствительностью к перцептивным стимулам. В тяжелых случаях сообщается об эпилептических припадках (Petursson, Lader 1984). Поскольку многие из этих симптомов схожи с симптомами тревожных расстройств, иногда трудно решить, чем они обусловлены — отменой бензодиазепинов или обострением тревожного расстройства, по поводу которого и было назначено лекарство (Rodrigo, Williams 1986).
Симптомы абстиненции обычно развиваются в течение двух или трех дней после отмены кратковременно действующих бензодиазепинов и семи дней после отмены препаратов длительного действия. Эти симптомы обычно продолжаются от трех до десяти дней. Чаще они наблюдаются при отмене препаратов с более коротким периодом полувыведения (Tyrer et al. 1981). Если бензодиазепины применялись длительно, то перед отменой лучше снижать дозы постепенно в течение нескольких недель (Committee on the Review of Medicines 1980). В таком случае явления абстиненции можно свести к минимуму или даже избежать их вообще.
Антагонисты бета-адренорецепторов
Эти препараты облегчают некоторые нейровегетативные симптомы тревоги, такие как тахикардия, почти наверняка благодаря периферическому эффекту (Bonn et al. 1972). Они более всего подходят для тревожных больных, основными симптомами которых являются учащенное сердцебиение или тремор, не поддающиеся лечению бензодиазепинами. Обычно используется пропранолол в дозе 40 мг три раза в день. Противопоказания: блокада сердца, систолическое кровяное давление ниже 90 мм рт. ст. или частота пульса менее 60 ударов в минуту; бронхоспазм в анамнезе; метаболический ацидоз, например при диабете и после длительного голодания, как при anorexia nervoza. Необходима большая осторожность, когда наблюдаются признаки сердечной недостаточности. Антагонисты бета-адренорецепторов у некоторых больных могут преципитировать недостаточность сердечной деятельности; их не следует назначать больным с блокадой атриовентрикулярного узла, поскольку они снижают проводимость в А-V узле и пучке Гиса. Эти средства могут вызвать тяжелый бронхоспазм, обострить синдром Рейно и перемежающуюся хромоту. При диабете они могут вызвать гипогликемию. Некоторые препараты, взаимодействуя с бета-блокаторами, могут усиливать их неблагоприятное побочное действие. Поэтому важно установить, какие другие лекарства принимаются одновременно, и определить по специальным справочникам, нет ли сведений о наличии вредных взаимодействий.
Производные фенотиазина
Их иногда назначают больным, когда требуется анксиолитическое действие. В дозах, которые не приводят к побочным эффектам, они терапевтически обычно не более эффективны, чем бензодиазепины. Несмотря на это, фенотиазины с анксиолитическим действием иногда показаны двум группам пациентов: тем, у кого в связи с длительно существующей тревогой развилась зависимость от других лекарств, и больным с агрессивными чертами личности, плохо реагирующим на растормаживающее действие других анксиолитиков.
Трициклические антидепрессанты
Эти препараты используются для лечения тревоги, сопровождающей депрессивные расстройства. Иногда седативные трициклические антидепрессанты употребляются благодаря их анксиолитическому действию на пациентов, не страдающих депрессивными расстройствами. Эти препараты также целесообразно использовать для лечения больных с хроническими тревожными состояниями, не поддавшимися лечению бензодиазепинами. Применение имипрамина для лечения панических атак описано в гл. 7 (см.).
Барбитураты и другие седативные анксиолитики
В прошлом барбитураты широко использовались в качестве анксиолитиков. Хотя барбитураты и эффективны, но обычно они вызывают зависимость, поэтому их не следует применять по данному показанию. Седативный антигистаминный препарат гидроксизин иногда употребляется для снижения тревоги, но он обладает холинолитическим побочным эффектом и не имеет явных преимуществ как анксиолитик по сравнению с бензодиазепинами. Производные пропандиола, такие как мепробамат, также не имеют преимуществ перед производными бензодиазепина и обладают более сильным седативным эффектом в дозах, необходимых для снижения тревоги.
Нежелательные эффекты соответствуют тем, которые имеются и у бензодиазепинов, и обычно проявляются при дозах, необходимых для анксиолитического действия. Барбитураты могут вызвать раздражительность, сонливость и атаксию. В больших дозах седативные анксиолитики вызывают токсические эффекты в виде угнетения дыхания и снижения кровяного давления. Это особенно опасно в случае применения барбитуратов. Взаимодействие этих препаратов с другими сходно с наблюдаемым при применении бензодиазепинов. К тому же барбитураты взаимодействуют с кумариновыми препаратами, уменьшая их антикоагулирующее действие. Они усиливают также метаболизм трициклических антидепрессантов и тетрациклина. Симптомы абстиненции сходны с возникающими при отмене бензодиазепинов, которые описывались ранее. После прекращения применения барбитуратов наиболее выраженные проявления абстиненции таковы: психическое напряжение, потливость, тремор, раздражительность, а после отмены больших доз — судорожные припадки. Потому не следует прекращать прием барбитуратов внезапно, особенно если применявшиеся дозы были большими.
До назначения анксиолитического средства всегда следует выяснить причину тревоги. Для большинства больных внимания к их жизненным проблемам, возможности поговорить о своих переживаниях, поддержки, оказанной врачом, бывает достаточно, чтобы снизить тревогу до переносимого уровня. Если же требуется анксиолитик, он должен быть назначен на короткое время (как правило, не более чем на три недели), а затем постепенно отменен. Важно помнить, что зависимость особенно часто развивается у людей, имеющих проблемы с алкоголем. Если лекарство принималось в течение нескольких недель, пациент должен быть предупрежден, что он может испытывать напряжение после отмены препарата.
Препаратом выбора является один из бензодиазепиновых транквилизаторов. Кратковременно действующие препараты показаны, если тревога преходящая, длительно действующие — при тревоге, продолжающейся в течение всего дня. Врач должен иметь знания и опыт применения хотя бы одного препарата из каждой группы, преимущественно наиболее дешевого, а также тщательно изучить его действие Другие препараты необходимо применять для решения специфических задач, описанных ранее: блокаторы бета-адренорецепторов — при тахикардии и треморе, вызванных тревогой и не поддающихся лечению бензодиазепинами; фенотиазины — для больных, плохо реагирующих на растормаживающее действие седативных анксиолитиков (например, крайне агрессивных больных), и для больных, ставших зависимыми от них; седативные трициклические антидепрессанты в малых дозах — для больных с длительной хронической тревогой, не поддающейся лечению другими препаратами. Ингибиторы моноаминоксидазы обладают анксиолитическим действием, но их не следует применять из-за риска несовместимости с другими лекарствами и с некоторыми пищевыми продуктами (см.).
Снотворные
Снотворными являются лекарства, улучшающие сон. Многие седативные анксиолитики также действуют как снотворные (они были рассмотрены в предыдущем разделе). Снотворные средства назначаются широко и, как правило, на длительное время. Это отражает частоту жалоб на бессонницу. Mendelson (1980) установил, что около трети взрослого населения Америки сообщают о нарушениях сна, а треть из них рассматривают эти нарушения как серьезную проблему. Бессонница чаще наблюдается у женщин и у пожилых людей.
Идеальное снотворное должно увеличивать продолжительность и улучшать качество сна без остаточного действия на следующее утро. Оно должно действовать, не изменяя структуры сна и без явлений абстиненции при прекращении его приема. К сожалению, ни одно лекарство не соответствует всем этим требованиям. Нелегко создать препараты, которые воздействуют на сон в течение всей ночи, а затем выводятся в такой степени, чтобы к утру не осталось седативного эффекта. Более того, отмечаются изменения электрофизиологических характеристик сна как во время приема большинства лекарств, так и в течение нескольких ночей после их отмены. Так, снотворные средства воздействуют на характеристику ЭЭГ; они подавляют сон с быстрым движением глаз (rapid eye movement — REM) во время приема, а после их отмены длительность REM-сна увеличивается, что может продолжаться несколько недель. Эти последние изменения нередко отражены в сообщениях о нарушениях сна.
В настоящее время наиболее часто употребляемые снотворные — это производные бензодиазепина. В прошлом чаще всего прописывали барбитураты, но теперь их применяют весьма редко. Среди других доступных соединений наиболее употребляемыми являются хлоралгидрат, хлорметиазол и глутетимид.
Среди бензодиазепинов наиболее часто в качестве снотворных употребляются нитразепам, флуразепам, темазепам и триазолам. Первые два, являясь препаратами длительного действия, способны вызывать побочные эффекты. Последние два — препараты кратковременного действия, которые наиболее подходят для лечения бессонницы при затрудненном засыпании. Любые другие бензодиазепины можно использовать в качестве снотворного, принимая однократно на ночь. Барбитураты для удобства подразделяются на соединения кратковременного, среднего и длительного действия. Только среднедействующие применимы в качестве снотворных; кратковременно действующие барбитураты используются для анестезии, а длительно действующие — при эпилепсии. Барбитураты, которые употребляются в качестве снотворных, включают амилобарбитон, амилобарбитон натрия (амитал-натрий), бутобарбитон и квиналбарбитон. При передозировке барбитураты опаснее бензодиазепинов, поскольку быстрее вызывают угнетение дыхания. Ввиду этого в качестве снотворных они не рекомендуются.
Из других снотворных средств нужно назвать хлоралгидрат, который иногда назначают детям и пожилым людям. Этот препарат раздражает слизистую желудка, поэтому его следует разводить соответствующими (обволакивающими) веществами. Дихлоралфеназон родствен хлоралу, но менее раздражающий. Хлорметиазола эдизилат — снотворное средство, обладающее противосудорожными свойствами. Поэтому многие считают его пригодным для предупреждения симптомов абстиненции у алкоголиков. Но такое мнение ошибочно, поскольку это лекарство, как и другие снотворные, способно вызвать зависимость. Глутетимид, хотя он и эффективен в качестве снотворного, при передозировке токсичен и поэтому может назначаться только в небольших дозах (British Medical Journal 1976).
Метаболизм и экскреция бензодиазепинов были описаны ранее. Барбитураты, другая важная группа снотворных, по характеру метаболизма и экскреции несколько различаются. Длительно действующие барбитураты в большей степени водорастворимы и менее липофильны, чем среднедействующие соединения, и поэтому в основном выводятся почками в неизмененном виде. Среднедействующие соединения в большой степени подвергаются метаболизму в печени и затем выводятся как сложные гидроксильные соединения. Барбитураты индуцируют энзимы, которые их самих метаболизируют, а также индуцируют энзимы печени, участвующие в метаболизме других лекарств (см. далее).
Наиболее важным нежелательным эффектом снотворных является их последействие, выражающееся в том, что больной на следующий день ощущает вялость и сонливость. Психологические тесты на быстроту реакции показали ее замедленность вечером следующего дня после однократной ночной дозы барбитурата или длительно действующего бензодиазепина (Bond, Lader 1973). Человек с такой замедленной реакцией, не всегда отдавая себе в этом отчет, может представлять угрозу при работе с потенциально опасной техникой либо при вождении автотранспортных средств, управлении поездами или самолетами. Люди, которые плохо спят, после тяжелой ночи также высказывают подобные жалобы и без приема снотворных, однако эти субъективные ощущения не сопровождаются сравнимыми нарушениями, выявляемыми при выполнении психологических тестов. Жалобы больных могут отражать причину бессонницы (например, депрессия или чрезмерное употребление алкоголя накануне) в большей степени, чем сам по себе недостаток сна.
Барбитураты и дихлоралфеназон не должны назначаться больным, страдающим острой перемежающейся порфирией.
Наиболее важным является взаимодействие снотворных лекарств с алкоголем. Сначала они потенцируют действие друг друга, иногда в опасной степени. После длительного употребления развивается перекрестная толерантность. Длительное злоупотребление алкоголем, как известно, повреждает печень и, таким образом, увеличивает чувствительность к снотворным, нарушая их метаболизм. Эффект длительно действующих бензодиазепинов, потенцируя действие алкоголя, может проявляться и на следующий день после приема лекарства (Saario et al. 1975). Барбитураты увеличивают метаболизм других лекарств, включая антикоагулянты, трициклические антидепрессанты и тетрациклин. Взаимодействие хлорметиазола и алкоголя особенно опасно и может закончиться смертью вследствие паралича дыхания. Поэтому когда это лекарство употребляется во время алкогольной абстиненции, требуется тщательное наблюдение. Хлорметиазол ни в коем случае не должен назначаться людям, которые продолжают употреблять алкоголь.
Перед назначением снотворных лекарств важно выяснить, действительно ли пациент плохо спит, и если да, то каковы причины. Многие люди неверно представляют себе, сколько часов они должны спать. К примеру, не все знают, что длительность сна уменьшается в среднем и пожилом возрасте. Некоторые имеют привычку «вздремнуть» днем и все же желают по-прежнему долго спать ночью. Другие просят назначить им снотворное уже тогда, когда они плохо спали одну или две ночи, например в период путешествия. Такие кратковременные нарушения сна компенсируются продолжительным сном в последующие ночи, но бодрость после пробуждения от такого полноценного сна может уменьшаться за счет остаточного действия снотворных. Если употребление снотворного в подобных случаях вообще может быть оправдано, то лучше применить кратковременно действующий бензодиазепин.
К обычным причинам нарушения сна относятся злоупотребление кофеином и алкоголем, боль, кашель, зуд и одышка, тревога и депрессия. Если причина известна, то следует устранить ее, а не пытаться воздействовать на бессонницу. Если после тщательного исследования применение снотворного представляется необходимым, следует назначать его только на несколько дней. Врач должен объяснить это больному, предупредив его, что после отмены снотворного сон в течение нескольких ночей может быть беспокойным, но это не должно подтолкнуть к возобновлению приема лекарства.
Назначение снотворных детям не оправдано, кроме особых случаев ночных страхов и сомнамбулизма. Снотворные должны также с большой осторожностью прописываться пожилым. У них возможны проявления спутанности; более того, поднимаясь ночью с постели, они могут получить травму. Многие пациенты часто страдают длительными состояниями зависимости от снотворных, назначавшихся им в больнице ради «рутинного ночного успокоения». Назначение этих лекарств никогда не должно быть рутинным; оно должно быть продиктовано реальной необходимостью и непременно прекращаться перед выпиской больного из стационара.
Антипсихотические средства (нейролептики)
Этот термин относится к лекарствам, которые уменьшают психомоторное возбуждение и воздействуют на некоторые симптомы шизофрении, не вызывая заторможенности, спутанности и сонливости. Иначе такие препараты называют нейролептиками (этот термин принят в русскоязычной литературе. — Ред.), антишизофреническими средствами и большими транквилизаторами. Ни один из этих терминов не является вполне удовлетворительным. Слово «нейролептик» характеризует скорее побочные эффекты, чем лечебное действие лекарств; словосочетание «большие транквилизаторы» не соответствует наиболее важному клиническому действию; определение «антишизофренические» предполагает более специфическое действие, чем то, которое эти лекарства оказывают на самом деле. Термин «антипсихотические» употребляется на том основании, что он встречается в British national formulary.
Нейролептики применяются для уменьшения галлюцинаций, бреда, ажитации и психомоторного возбуждения при шизофрении, органических психозах или мании, а также для профилактики рецидивов шизофрении. Хлорпромазин, введенный в практику в 1952 году, позволил достичь значительного прогресса в лечении шизофрении, открыв дорогу к созданию многих психотропных средств, которые теперь широко применяются.
Нейролептики обладают способностью блокировать дофаминовые рецепторы. Этим можно, вероятно, объяснить их терапевтическое действие, причем данное предположение поддерживается тесной связью между выраженностью их антидофаминергического эффекта in vitro и степенью присущего им терапевтического действия. Это также подтверждается тем фактом, что из двух стереоизомеров флупентиксола альфа-изомер, блокирующий рецепторы дофамина, обладает терапевтическим действием, тогда как бетаизомер не блокирует их и не оказывает терапевтического действия (Johnstone et al. 1978). Как альфа-, так и бета-изомеры блокируют норадренергические ихолинергические рецепторы. Указанные антиадренергические и антихолинергические свойства ответственны за многие побочные эффекты этих лекарств, в то время как антидофаминергическое действие на базальные ганглии обусловливает экстрапирамидные побочные эффекты. Лекарства, дающие меньше побочных экстрапирамидных эффектов, обладают антихолинергическим эффектом, т. е. имеют как бы «встроенное» (в их химическую структуру) антипаркинсоническое действие.
Ныне существует большая группа нейролептических препаратов. Некоторые из них (например, хлорпромазин) являются производными фенотиазина. Они различаются строением боковой цепочки, например, и радикалом во втором положении (табл. 17.2). Другие являются производными тиоксантена (тиотиксен, флупентиксол), бутирофенона (галоперидол) (табл. 17.3) или дифенил бутилпиперидина (пимозид). Эти различные препараты в клинике отличаются один от другого в большей степени своими побочными действиями, чем терапевтической активностью. Обзор соотношений между структурой и функциями дан Shepherd et al. (1968).
Фенотиазины разделяются на три группы в зависимости от боковой цепочки, прикрепленной к 10-й позиции R2 (табл. 17.2). Аминоалкиловые соединения, такие как хлорпромазин, наиболее седативны и оказывают умеренное экстрапирамидное побочное действие. Пиперидиновые соединения, в частности тиоридазин, имеют еще меньшее экстрапирамидное действие по сравнению с препаратами первой группы. Производные пиперазина (трифлуоперазин или флуфеназин) наименее седативны и чаще дают выраженный экстрапирамидный эффект. Однако они и наиболее терапевтически активны.
Тиоксантены по структуре подобны фенотиазинам (см. табл. 17.2 и 17.3), отличаясь только наличием атома углерода в противоположность атому азота в 10-й позиции. По свойствам они также сходны с фенотиазинами. Бутирофеноны имеют совершенно иную химическую структуру (см. табл. 17.3). Они обладают выраженным антипсихотическим действием, часто вызывают экстрапирамидный синдром, а их седативный эффект незначителен. Бутилпиперидины, из которых пимозид чаще всего применяется в клинической практике, близки по структуре к бутирофенонам. Их наиболее существенным отличием является больший период полураспада, что позволяет принимать препарат только один раз в день.
Таблица 17.2. Основная структура производных фенотиазина и ее варианты

Тип соединения: Аминоалкилы (алифатические производные)
Пример: Хлорпромазин
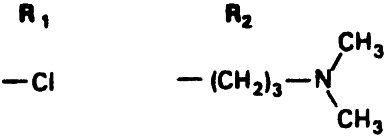
Тип соединения: Пиперидины
Пример: Тиоридазин

Тип соединения: Пиперазины
Пример: Трифлуоперазин
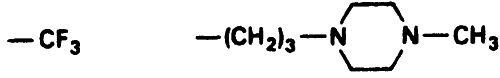
Пример: Флуфеназин

Таблица 17.3. Примеры структуры производных тиоксантена (а) и бутирофенона (б)
а) Флупентиксол

б) Галоперидол

Более подробный перечень имеющихся в настоящее время нейролептиков представлен в табл. 17.4, хотя и он далеко не полон. Отметим, что клиницисту вполне достаточно знать лишь небольшое количество таких лекарств (эту мысль поясним далее).
Таблица 17.4. Перечень нейролептиков
Фенотиазины:
а) с алифатической боковой цепочкой
• Хлорпромазин
• Промазин
б) с пиперидиновой боковой цепочкой
• Тиоридазин
• Мезоридазин
• Перициазин
• Флуспирилен
в) с пиперазиновой боковой цепочкой
• Трифлуоперазин
• Перфеназин
• Флуфеназин
• Прохлорперазин
• Тиопропазат
Тиоксантены
• Тиотиксен
• Флупентиксол
• Клопентиксол
• Хлорпротиксен
Бутирофеноны
• Галоперидол
• Трифлуперидол
• Спироперидол
• Дроперидол
Дифенилбутилпиперидины
• Пенфлуридол
Азепины
• Клозепин
Индолы
• Оксипертин
• Молиндон
Замещенные бензамиды
• Сульпирид
Препараты, истощающие запасы моноаминов
• Резерпин
• Тетрабеназин
Медленно высвобождающиеся депо-препараты употребляют в случаях, когда лекарство назначено для предупреждения рецидивов, однако нет твердой уверенности в том, что пациент будет принимать его регулярно. Эти препараты включают энантат флуфеназина, флуфеназин-деканоат, флупентиксол-деканоат и клопентиксол-деканоат, а также флуспирилен. Все они, кроме последнего, употребляются в масляном растворе. Флуспирилен представляет собой водную суспензию и обладает более коротким, чем другие препараты, сроком действия. Имеются сообщения, что флупентиксол может повышать настроение, но это не доказано.
Из множества имеющихся препаратов чаще всего применяется хлорпромазин (аминазин), когда требуется более седативное средство; если же седативное действие нежелательно, выбирают трифлуоперазин или галоперидол; если необходимо применение депо-препарата, останавливаются на флуфеназин-деканоате. Промазин или тиоридазин показаны для пожилых пациентов, когда необходимо уменьшить риск развития экстрапирамидных побочных реакций и избежать холинолитического побочного эффекта. Для лечения мании более предпочтителен галоперидол, поскольку он обладает меньшим седативным действием, чем большинство фенотиазинов. Хлорпромазин и галоперидол могут вводиться внутримышечно для получения быстрого эффекта у резко возбужденных больных.
Нейролептики хорошо всасываются, преимущественно в тощей кишке. В основном их метаболизм происходит в печени. Если препарат принимается per os, то часть его подвергается метаболизму на пути через портальную систему в общую систему циркуляции (первая стадия метаболизма). Хлорпромазин на 75 % метаболизируется именно таким образом, у флуфеназина пропорция даже выше; в то же время у галоперидола и пимозида она значительно ниже. Распад хлорпромазина сложен, около 75 метаболитов обнаружено в крови или моче. Два основных метаболита — это 7-оксихлорпромазин, еще обладающий терапевтической активностью, и сульфоксид хлорпромазина, уже не обладающий ею. Комбинации активных и неактивных метаболитов встречаются также и у других нейролептиков. Это затрудняет интерпретацию клинической значимости концентрации лекарственного вещества в плазме, именно поэтому в клинике ее почти не используют. Хлорпромазин индуцирует энзимы печени, усиливающие его собственный метаболизм. Такой метаболизм усиливается также барбитуратами и некоторыми антипаркинсоническими средствами (особенно орфенадрином). Другие лекарства (особенно имипрамин и амитриптилин) затрудняют метаболизм хлорпромазина, конкурируя за соответствующие энзимы.
Нейролептики, столь многочисленные и различные, имеют широкий спектр нежелательных побочных эффектов, которые в основном связаны с их антидофаминергическими, антиадренергическими и антихолинергическими свойствами (табл. 17.5). Подробные сведения о таких эффектах, присущих отдельным препаратам, можно найти в British national formulary или в других подобных справочных изданиях. Здесь приводится информация об основных типах побочных эффектов, иллюстрируемая примерами, относящимися к некоторым наиболее распространенным лекарствам.
Таблица 17.5. Некоторые нежелательные эффекты нейролептиков
Антидофаминергические эффекты
• Острая дистония
• Акатизия
• Паркинсонизм
• Поздняя дискинезия
Адренолитические эффекты
• Постуральная гипотензия
• Задержка эякуляции
Холинолитические эффекты
• Сухость во рту
• Уменьшение потоотделения
• Затрудненное мочеиспускание или задержка мочи
• Запоры
• Нечеткость зрения
• Преципитация глаукомы
Другие эффекты
• Сердечная аритмия
• Увеличение веса тела
• Аменорея
• Галакторея
• Гипотермия
Изменение чувствительности
• См. в тексте
Экстрапирамидные эффекты
Они связаны с антидофаминергическим действием нейролептиков в базальных ганглиях. Как уже отмечалось, терапевтический эффект также связан с антидофаминергическим действием, но преимущественно в других отделах мозга, а не в базальных ганглиях. Поэтому до сих пор не удалось создать нейролептики без побочных экстрапирамидных эффектов.
Экстрапирамидные нарушения можно разделить на четыре группы. Острая дистония развивается быстро после начала лечения, особенно у молодых людей. Чаще всего это наблюдается в случае применения бутирофенонов и фенотиазинов пиперазиновой группы. Наиболее частые проявления — тортиколлиз, выпадение языка, гримасы, опистотонус и странные клинические проявления, которые могут быть приняты за истероидное поведение. Эти явления можно контролировать бипериден-лактатом, осторожно вводимым внутримышечно в количестве 2–5 мг, а в наиболее тяжелых случаях — медленным внутривенным введением. Акатизия — это неприятное ощущение напряжения в теле и постоянное стремление двигаться, из-за чего больной не может оставаться в покое. Это явление обычно наблюдается в первые две недели лечения нейролептиками, но может развиться и через несколько месяцев. Акатизия ненадежно купируется антипаркинсоническими средствами, но в случаях, когда она возникает на ранней стадии лечения, указанные нарушения обычно исчезают при уменьшении дозы применяемых лекарств. Описаны также редкие поздние случаи акатизии, при которых не наблюдается быстрой реакции на уменьшение дозы. Их трудно отличать от поздней дискинезии (Munetz, Cornes 1982).
Обычный побочный эффект — паркинсоновский синдром, проявляющийся как акинезия, амимия, отсутствие содружественных движений при ходьбе; наблюдаются также ригидность, интенционный тремор, а в более тяжелых случаях — специфическое нарушение походки и общая скованность. Этот синдром часто развивается в течение нескольких недель после начала терапии и затем иногда постепенно проходит даже без снижения дозы нейролептика. Симптомы паркинсонизма могут быть сняты применением антипаркинсонических средств. В то же время неправильно назначать антипаркинсонические средства профилактически всем больным, поскольку не все в дальнейшем будут в них нуждаться. Более того, эти лекарства сами по себе могут оказывать нежелательное действие на некоторых больных; например, они иногда вызывают острый органический синдром и, возможно, повышают частоту поздней дискинезии.
Этот последний синдром, поздняя дискинезия, особенно серьезен, поскольку, в отличие от других экстрапирамидных эффектов, не всегда исчезает после прекращения применения лекарств. Он характеризуется жевательными и сосательными движениями, гримасничаньем, хореоатетоидными движениями и возможной акатизией (Barnes, Braude 1985). Более всего поражается лицо, однако также могут быть затронуты конечности и дыхательные мышцы. Иногда этот синдром наблюдается у пациентов, не принимавших нейролептиков. Клинические наблюдения показывают, что чаще всего он встречается у больных, которые принимали нейролептики в течение многих лет. В то же время обзор, выполненный специальной службой Американской психиатрической ассоциации (American Psychiatric Association 1987), приводит к заключению, что ни величина дневной дозы, ни продолжительность лечения не являются главными определяющими факторами. Поздняя дискинезия чаще бывает у женщин, у пожилых людей и у больных с диффузными поражениями мозга (см.: Kane, Smith 1982 — обзор факторов риска и данных о частоте поздней дискинезии). Примерно в половине случаев поздняя дискинезия проходит после прекращения приема лекарств. Частоту синдрома в различных исследованиях определяют по-разному, однако он, очевидно, развивается у 20–40 % больных шизофренией, принимавших нейролептики пролонгированного действия (Marsden, Jenner 1980). Но какова бы ни была его распространенность, уже само существование этого синдрома должно ограничивать длительность лечения и удерживать от назначения больших доз нейролептиков.
Природа этого синдрома неизвестна, но, возможно, это результат сверхчувствительности к дофамину вследствие продолжительной блокады дофаминовых рецепторов. Это объяснение согласуется с тем наблюдением, что обострение поздней дискинезии может быть обусловлено тремя факторами: во-первых (что нередко случается), отменой нейролептиков; во-вторых, действием антихолинергических антипаркинсонических лекарств (предположительно ввиду еще большего нарушения баланса между холинергическими и дофаминергическими системами в базальных ганглиях); в-третьих, употреблением L-ДОФА и апоморфина (у некоторых больных). Но имеются и другие наблюдения, не подтверждающие приведенного объяснения.
Были испробованы многочисленные способы лечения поздней дискинезии, но ни один из них не оказался универсально эффективным. Поэтому важно свести к минимуму вероятность развития этого синдрома, ограничивая длительность лечения нейролептиками и по возможности избегая больших доз препаратов даже для тех больных, которые действительно в них нуждаются. В то же время необходимо внимательное наблюдение за малейшими нарушениями моторики у всех больных, которые долго получали нейролептики. Если дискинезия все же развивается, то нейролептики должны быть отменены (при условии, что психическое состояние больного это позволяет). Хотя дискинезия сразу после отмены лекарства может обостриться, во многих случаях улучшение наступает в течение нескольких месяцев. Если дискинезия не исчезает или же необходимо продолжать антипсихотическую терапию, то с целью устранить или смягчить нарушения моторики следует осторожно испробовать препарат, относящийся к одной из групп, о которых уже сообщалось. Можно также испытать последовательно лекарства из каждой группы. В эти группы входят такие антагонисты рецепторов дофамина, как галоперидол и пимозид, дофамин-истощающие препараты, например тетрабеназин.
Читателю рекомендуется также обратиться к работам МасКау и Sheppard (1979), где дан обзор по вопросам лечения поздней дискинезии, Maisden и Jenner (1980), где приводится дополнительная информация о патофизиологии поздней дискинезии и других экстрапирамидных побочных эффектов нейролептиков, и к Stahl (1986) — для ознакомления с информацией о естественном течении поздней дискинезии.
Адренолитические эффекты
Они включают постуральную гипотонию с рефлекторной тахикардией, заложенность носа и задержку эякуляции. Влияние на кровяное давление обычно обнаруживается после внутримышечного введения, а у пожилых больных — при любом способе введения.
Холинолитические эффекты
Они проявляются в ощущении сухости во рту, затруднении мочеиспускания и задержке мочи, запорах, снижении потоотделения, нечеткости зрения и изредка — в преципитации глаукомы.
Другие эффекты
Иногда сообщается о сердечных аритмиях. Изменения на ЭКГ обычно характеризуются удлинением интервалов QT и сглаженностью T-волн. Описывается снижение настроения, но это трудно определить, поскольку у больных шизофренией бывают депрессивные состояния. Некоторые больные набирают вес во время приема нейролептиков, особенно хлорпромазина. У некоторых женщин развиваются галакторея и аменорея. У пожилых существенным нежелательным эффектом может быть гипотермия. Некоторые фенотиазины, в особенности хлорпромазин, приводят к учащению припадков у эпилептиков. Длительное применение хлорпромазина может вызвать повышенную чувствительность к свету и накопление пигмента в коже, роговице и хрусталике. Тиоридазин в особенно больших дозах (более 800 мг в день) может вызвать дегенерацию сетчатки. Редкими патологическими реакциями могут быть холестатическая желтуха и агранулоцитоз.
Каких-либо тератогенных свойств у этих лекарств не обнаружено, однако их применение на ранних стадиях беременности должно быть очень осторожным.
Это весьма серьезное нарушение возникает у очень немногих больных, принимающих нейролептики, особенно сильнодействующие. В большинстве опубликованных случаев этот синдром связан с применением нейролептиков при шизофрении, иногда — при мании, депрессивных нарушениях и органических психических расстройствах. Начало чаще всего, но не всегда, наблюдается в первые 10 дней лечения. Клиническая картина характеризуется быстрым развитием (обычно в 24–72 часа) тяжелых двигательных, психических и вегетативных расстройств. Существенным двигательным нарушением является генерализованная мышечная гипертония. Напряжение мышц шеи и грудной клетки может привести к дисфагии и диспноэ. Психические симптомы проявляются в акинетическом мутизме, ступоре и нарушении сознания. Гиперпирексия развивается на фоне вегетативных нарушений в виде неустойчивого кровяного давления, тахикардии, чрезмерного потоотделения, слюнотечения, недержания мочи. В крови могут повыситься уровни креатинин-фосфокиназы, а также количество лейкоцитов. Возможны такие вторичные явления, как пневмония, тромбоэмболия, сердечно-сосудистый коллапс и почечная недостаточность. Смертность составляет от 15 % (Kellam 1987) до 20 % (Caroff 1980). Этот синдром может длиться одну-две недели после прекращения приема нейролептика per os, а в случае применения пролонгированных препаратов, возможно, в два-три раза дольше. Выживающие больные поправляются без остаточных явлений.
Дифференциальный диагноз должен проводиться между энцефалитом и (в некоторых странах) тепловым ударом. До появления нейролептиков подобные нарушения описывались как кататония, иногда — острая летальная кататония. Причина неизвестна.
Это состояние, очевидно, может развиться при приеме любого нейролептика, но во многих описанных случаях применялись галоперидол или флуфеназин. Причина может быть связана с длительной блокадой дофаминовых рецепторов, но тот факт, что такое состояние встречается весьма редко, необъясним. Лечение симптоматическое: наибольшее значение имеют прекращение приема лекарства, снижение температуры, сохранение баланса жидкости и лечение интеркуррентной инфекции. Никакое лекарственное лечение не дает надежных результатов. Диазепам может употребляться для снижения мышечной ригидности, может также использоваться дантролен — лекарство, применяемое при злокачественной гипертермии. Употреблялись бромокриптин, амантадин и L-ДОФА, но не настолько часто, чтобы можно было сделать определенные выводы об их эффективности. Описаны случаи, когда больным, у которых развился синдром во время приема нейролептика, после разрешения острого эпизода и нормализации состояния был снова назначен тот же препарат, причем повторное его применение не вызвало осложнений (Caroff 1980). Однако если нейролептик вновь назначается, следует начинать со слабодействующего препарата типа тиоридазина, вначале принимаемого в небольшой дозе. (Обзор, посвященный синдрому, см. у Shalev, Munitz (1986) и Kellam (1987).)
Существует мало противопоказаний, и они для разных лекарств различны. До назначения любого из этих лекарств следует обратиться к British national formulary или к соответствующему другому справочному изданию. Противопоказания включают myasthenia gravis, болезнь Аддисона, глаукому, данные о наличии (в настоящее время или в прошлом) угнетения функции костного мозга — все эти заболевания могут обостриться при употреблении нейролептиков. Больным с заболеваниями печени не следует назначать хлорпромазин, а другие препараты должны применяться осторожно. Осторожность необходима также при заболеваниях почек, сердечно-сосудистых нарушениях, паркинсонизме, эпилепсии и тяжелых инфекциях.
Нейролептики должны применяться в подобранных индивидуально для каждого пациента дозах, причем эти дозы периодически следует уточнять или изменять. Для детей используются меньшие дозы, равно как и для пожилых, а также пациентов с повреждениями мозга, эпилепсией или соматическими заболеваниями. Дозировка отдельных лекарств приведена в British national formulary и других соответствующих изданиях или в литературе, издаваемой фирмами — производителями лекарств. Указания об относительных дозах ряда распространенных препаратов, применяемых per os, даны в табл. 17.6. Некоторые практические рекомендации о наиболее широко употребляемых лекарствах приведены также в последующих разделах.
| Таблица 17.6. Приблизительное соотношение доз некоторых нейролептиков[43] | |
|---|---|
| При приеме внутрь: | |
| хлорпромазин | 100 |
| тиоридазин | 100 |
| трифлуоперазин | 5 |
| флуфеназин | 2 |
| галоперидол | 2 |
Употребление нейролептиков в неотложных случаях
Нейролептики применяются для купирования психомоторного возбуждения, агрессивности и других нарушений поведения, возникающих при шизофрении, мании или органических психозах. Если больной резко возбужден или крайне агрессивен, начальная доза должна быть достаточно большой, чтобы такое поведение контролировать. Наиболее приемлем хлорпромазин ввиду его седативного эффекта; кроме того, он дает меньше дистонических реакций, чем такие лекарства, как галоперидол. Принятой для молодого и физически здорового взрослого человека является доза хлорпромазина в 100–200 мг per os; если важен немедленный эффект, то вводят внутримышечно 50–100 мг в зависимости от веса и степени опасности поведения больного. Соответствующая доза галоперидола при внутримышечном введении составляет 10–30 мг. Если назначается большая доза, необходимо внимательно следить за возможным гипотензивным действием, а также могут потребоваться антипаркинсонические средства для предотвращения экстрапирамидных нарушений. Дозы, приведенные ранее, должны быть соответственно уменьшены для детей и подростков, пожилых и физически больных, людей невысокого роста, а также для злоупотребивших алкоголем. Так, для пожилого больного в состоянии резкого возбуждения достаточно 25 мг хлорпромазина per os. Перед назначением дозы препарата целесообразно обратиться к British national formulary или инструкциям производителей лекарства.
При ведении больного в остром состоянии есть несколько практических моментов, о которых следует упомянуть. Хотя на ранних стадиях заболевания нелегко различать манию и шизофрению как причину нарушенного поведения, необходимо попытаться отличить их от органического поражения мозга или от вспышки агрессии у патологической личности. Среди органических поражений важно помнить о постприпадочном состоянии у эпилептика, последствиях травмы черепа, транзиторной глобальной амнезии и гипогликемии. Люди с патологией личности в результате стресса могут вести себя в высшей степени ненормально, особенно если одновременно употребляют алкоголь или наркотики. Если возбуждение имеет органическую причину, необходимо лечить его симптоматически. При этом любые лекарства следует назначать осторожно и по возможности принимать меры для лечения первичного расстройства. Если пациент употребил алкоголь, не следует забывать о возможном его потенцирующем действии на седативные эффекты нейролептиков. Нейролептики, которые могут провоцировать припадки (например, хлорпромазин), нельзя назначать больным в постприпадочном состоянии.
Для постановки диагноза должен быть собран подробный анамнез с помощью информаторов и самого пациента. Не следует оставаться наедине с пациентом, уже проявившим агрессию, хотя бы до того, как будет установлен диагноз. Тот, кто беседует с больным, должен сделать все возможное, чтобы его успокоить. Если он уже не опасен, можно отменить физическое ограничение и отпустить санитаров. Если лечение медикаментами необходимо, а больной от него отказывается, то прежде чем начать лечение, следует получить разрешение на применение принудительных мер согласно соответствующей части Закона о психическом здоровье. Если такое законное разрешение получено, требуется успокаивающая инъекция, причем врач должен пригласить достаточное количество помощников, чтобы эффективно противодействовать сопротивлению больного. Они должны действовать умело и решительно, чтобы обезопасить больного; полумеры могут сделать его еще более агрессивным. Когда пациент станет более спокойным, необходимо измерить кровяное давление и систематически делать это в дальнейшем, особенно если, нейролептическое средство вводится внутримышечно. (См. также.)
Лечение острого эпизода
Когда все необходимые неотложные меры приняты (а в менее острых случаях — с самого начала), проводится лечение более умеренными дозами одного из наименее седативных нейролептиков. Может быть назначен трифлуоперазин в дозе 15–30 мг в день, разделенной на несколько приемов, или галоперидол, по 10–15 мг в день, также в несколько приемов. Последнее лекарство часто назначается маниакальным больным из-за менее выраженных седативных побочных явлений. На ранних стадиях лечения дозы и время приема должны при необходимости корректироваться ежедневно до тех пор, пока наиболее острые симптомы не будут взяты под контроль. В дальнейшем обычно предпочтителен двукратный прием лекарства в течение дня. Серьезное внимание должно быть обращено на возможные острые дистонические реакции на начальном этапе лечения, особенно при применении больших доз, а в ходе дальнейшего лечения — также на паркинсонические побочные явления: если они возникают, следует назначить корректоры (см. следующий раздел). Для пожилых и соматически больных важно следить за температурой и кровяным давлением для выявления возможной гипотермии или постуральной гипотензии.
Если проявления заболевания не поддаются лечению в течение семи-десяти дней, необходимо прогрессивно увеличивать дозу до тех пор, пока либо не проявится терапевтический эффект, либо не возникнут опасные побочные явления. В последнем случае приходится заменять одно лекарство другим, с иным набором побочных реакций (например, если хлорпромазин вызвал серьезную постуральную гипотензию, то его заменяют галоперидолом). Нежелательные побочные явления представляют собой единственное основание для замены одного нейролептика другим. Если полная доза одного препарата не дает терапевтического эффекта, вероятность того, что другой препарат будет эффективнее, весьма мала.
Лечение после острого эпизода
Эпизоды мании или острого органического психического расстройства обычно проходят в течение недель. С другой стороны, больные шизофренией часто нуждаются в лечении на протяжении многих месяцев или лет. Такая поддерживающая терапия может быть продолжением, но в меньших дозах, того перорального лечения, которое проводилось в остром периоде. В то же время больные шизофренией часто не принимают своих лекарств регулярно, ввиду чего употребляются препараты с постепенным высвобождением из депо. Они назначаются в виде внутримышечных инъекций. В начале лечения применяют пробную дозу, чтобы выяснить, вероятны ли серьезные побочные реакции при употреблении полной дозы; для флуфеназин-деканоата пробная доза составляет 12,5 мг. Поддерживающая доза затем определяется методом проб и ошибок. Обычно это доза 25–50 мг каждые 2–4 недели, причем желательно начинать с дозы в 25 мг каждые три недели. Важно определить наименьшую дозу, которая контролировала бы симптомы. Поскольку со временем она может снижаться, следует регулярно сопоставлять ее действие на симптоматику и побочные реакции. Нет необходимости постоянно давать антипаркинсонические препараты; если же они нужны, то лишь на несколько дней после инъекции депо-препарата (когда концентрация его в плазме крови наиболее высока).
Другим инъекционным препаратом замедленного действия является флупентиксол-деканоат. Сообщалось, что он в меньшей степени вызывает снижение настроения, чем флуфеназин, но эти сообщения не были подтверждены.
Информативный обзор, посвященный проведению долгосрочного антипсихотического лечения в психиатрии, предложен Shepherd и Watt (1977).
Атипаркинсонические средства
Хотя эти препараты не применяются в психиатрии непосредственно для лечения психических расстройств, они часто необходимы для коррекции экстрапирамидных побочных явлений нейролептиков.
Из группы средств, применяемых при лечении идиопатического паркинсонизма, для лечения вызванных нейролептиками экстрапирамидных симптомов применяются холинолитические препараты.
Существует много холинолитических препаратов, и нет убедительных критериев для выбора одного из них. Чаще всего в психиатрической практике применяются синтетические холинолитики — бензгексол (циклодол), бензтропин и проциклидин, а также антигистаминный препарат орфенадрин, который, по некоторым данным, обладает также свойством повышать настроение. Для лечения острой дистонии показано применение инъекционного препарата биперидена.
В больших дозах эти препараты могут вызывать острый органический синдром, особенно у пожилых. Их антихолинергическое действие может суммироваться с таким же действием нейролептиков, что приводит к преципитации глаукомы или к задержке мочи (у мужчин с гипертрофией простаты). Возникают также сонливость, сухость во рту, запоры. Эти эффекты имеют тенденцию к снижению при продолжении приема препарата. Имеются некоторые указания на то, что антипаркинсонические препараты повышают вероятность развития поздней дискинезии при длительном лечении нейролептиками.
Антипаркинсонические средства могут активизировать энзимы печени, метаболизирующие нейролептики, ввиду чего содержание последних в плазме может снижаться.
Как уже упоминалось, антипаркинсонические средства не следует применять рутинным образом, поскольку они увеличивают риск поздней дискинезии. Пациенты, получающие инъекции нейролептиков пролонгированного действия, нуждаются обычно в применении антихолинергических препаратов только в течение нескольких дней после инъекции (если вообще нуждаются). Были сообщения о возникновении зависимости от бензгексола (циклодола), — возможно, в связи с его повышающим настроение действием (см., например, Harrison 1980). Обычной практикой является назначение бензгексола в дозе 5–15 мг в день (в 3–4 приема) или орфенадрина в дозе 50–100 мг три раза в день.
Антидепрессанты
Антидепрессанты обладают терапевтическим действием при депрессивном расстройстве, но не вызывают немедленного повышения настроения, как это происходит при приеме амфетамина. Сообщалось, что антидепрессивными свойствами обладают две группы лекарств. Одна из них представлена трициклическими антидепрессантами и соответствующими родственными соединениями. Первый из этих препаратов — имипрамин — клинически испытывался Kuhn (1957). Другая группа состоит из ингибиторов моноаминоксидазы; несмотря на многолетнее употребление, их антидепрессивное действие продолжает дебатироваться. В этой главе вначале описываются трициклические и родственные им соединения, затем — ингибиторы моноаминоксидазы и, наконец, — L-триптофан, соединение с весьма неопределенными антидепрессивными свойствами.
Фармакология
Трициклические антидепрессанты называются так, поскольку их химическая формула содержит три связанных кольца, к которым присоединена боковая цепочка. Их антидепрессивные свойства зависят от срединной кольцевой структуры, а сила действия и седативные свойства обусловлены отличиями в боковой цепочке. Если прибавляется четвертое кольцо, препарат называется тетрациклическим. Клиницист может рассматривать тетрациклические лекарства не как отдельную группу, а скорее как вариант трициклических препаратов. Было произведено много разновидностей трициклических и тетрациклических лекарств, в основном по коммерческим соображениям. Они незначительно различаются по своему терапевтическому действию, хотя различия в их побочных эффектах должны учитываться клиницистом. Считалось, что терапевтическое действие этих лекарств связано с их общим свойством увеличивать поступление норадреналина или серотонина на рецепторы постсинаптических нейронов посредством блокирования обратного захвата этих нейротрансмиттеров в пресинаптические нервные окончания. Однако у некоторых антидепрессантов (например, иприндола и миансерина) этот эффект не очень сильный, и в любом случае он наступает раньше и быстрее, чем терапевтический эффект (который проявляется через две недели или более). Известно, что антидепрессанты обладают и другими фармакологическими эффектами, помимо торможения обратного захвата медиаторов из синаптической щели. Эти эффекты характеризуются снижением чувствительности альфа-2-адренергических ауторецепторов (стимуляция этих рецепторов снижает выброс норадреналина в синаптическую щель, а блокада повышает его), уменьшением постсинаптической бета-адренергической чувствительности и усилением серотонинергической функции. Интегральное действие этих эффектов трудно определить. Таким образом, терапевтический эффект, несмотря на многолетние исследования, не может быть вполне объяснен. (См.: Heninger et al. 1983а — обзор.)
Доступные препараты
Множество имеющихся соединений могут быть разделены на трициклические, тетрациклические и другие. Трициклические соединения, в свою очередь, делятся на производные аминобензила, дибензилциклогептана и аминостилбена. Но клиницист прежде всего интересуется фармакологическими различиями, а не структурными. Между тем, что бы ни утверждали производители, нет убедительных данных о том, что какой-либо препарат действует быстрее остальных.
«Стандартные» антидепрессанты
Амитриптилин обладает выраженным седативным действием, а также антидепрессивными свойствами. Поэтому он пригоден для лечения депрессивной симптоматики, сочетающейся с тревогой или возбуждением. Выпускается также препарат с замедленным высвобождением (лентизол), который можно применять один раз в день, но амитриптилин сам по себе действует длительно и может назначаться один раз в день. Поэтому не рекомендуется применять пролонгированные формы препарата. Имипрамин (мелипрамин) используется для лечения заторможенной депрессии благодаря меньшему седативному действию по сравнению с амитриптилином.
Другие антидепрессанты
К ним относятся дотепин, доксепин, иприндол, лофепрамин, миансерин, флуоксетин, тразодон и тримипрамин. Из них миансерин имеет менее выраженное антихолинергическое действие и меньший кардиотоксический эффект. Поэтому он более пригоден для лечения депрессии у больных с заболеваниями сердца, хотя не установлено, что его антидепрессивный эффект столь же выражен, как у амитриптилина. Иприндол, лофепрамин, тразодон и, по-видимому, доксепин менее кардиотоксичны, чем имипрамин. Флувоксамин и флуоксетин являются селективными блокаторами обратного захвата серотонина. Они, возможно, менее кардиотоксичны (и менее седативны), чем стандартные антидепрессанты, но могут вызывать тошноту, тревогу и анорексию. При применении флувоксамина отмечались судороги, поэтому следует избегать его назначения эпилептикам. Препараты, менее седативные, чем стандартные антидепрессанты, — дезипрамин, мапротилин, лофепрамин и нортриптилин.
Кломипрамин (анафранил), имеющий сильное влияние на обратный захват серотонина, по некоторым сообщениям, обладает специфическим терапевтическим действием на симптомы навязчивости, но полной уверенности в этом нет. Лекарство применялось внутривенно, но такая практика не рекомендуется из-за опасности сердечной аритмии.
Антидепрессанты быстро всасываются и длительно метаболизируются печенью. Они обладают длительным действием и должны назначаться один раз в день. Пациенты резко отличаются друг от друга по интенсивности абсорбции и метаболизма антидепрессантов. Как сообщалось, при назначении одной и той же дозы нортриптилина у разных пациентов наблюдалась десятикратная разница его концентрации в крови. Поэтому дозу следует устанавливать индивидуально в зависимости от клинической эффективности и побочных реакций. Измерения концентрации лекарства в крови могут иметь значение при отсутствии реакции на обычную дозу. При использовании нортриптилина получены данные, что как при слишком большой, так и при слишком малой дозе клинический эффект оказывается недостаточным (Asberg et al 1971). В то же время наличие этого «терапевтического окна» не подтверждается в отношении амитриптилина (Coppen et al. 1978) и, возможно, оно вообще не наблюдается у других препаратов. Концентрации антидепрессантов в молоке матери соответствуют концентрациям в плазме.
Они многочисленны и значительны (табл. 17.7). Их можно разбить на пять групп. Вегетативные эффекты: сухость во рту, нарушенная аккомодация, затруднение мочеиспускания, ведущее к задержке мочи, запоры, изредка приводящие к илеусу, постуральная гипотензия, тахикардия, усиленная потливость. Из них наиболее серьезны задержка мочеиспускания, особенно у пожилых мужчин с гипертрофией простаты, и обострение глаукомы; к наиболее распространенным симптомам относятся сухость во рту и нарушенная аккомодация. Иприндол и миансерин обладают наименьшим холинолитическим побочным действием. Психические побочные эффекты: утомляемость и сонливость при приеме амитриптилина и других препаратов сильного седативного действия; бессонница при употреблении имипрамина; острые органические синдромы; у больных с биполярным типом аффективного расстройства может быть спровоцирована мания.
Таблица 17.7. Некоторые нежелательные побочные эффекты трициклических антидепрессантов
Вегетативные (кроме сердечно-сосудистых)
• сухость во рту
• нарушенная аккомодация
• затруднение мочеиспускания
• запоры
• потливость
Сердечно-сосудистые
• тахикардия
• гипотензия
• изменения на ЭКГ
• желудочковые аритмии
Неврологические
• мелкий тремор
• нарушения координации
• головные боли
• мышечные подергивания
• эпилептические припадки
• периферическая невропатия
Другие
• кожные высыпания
• холестатическая желтуха
• агранулоцитоз
Кардиоваскулярные эффекты — тахикардия и гипотензия — развиваются почти всегда. Электрокардиограмма часто показывает увеличение интервалов PR и QT, угнетение сегментов ST и уплощение волн Т. Иногда развивается желудочковая аритмия, чаще у больных с заболеваниями сердца. Эти симптомы, по-видимому, менее выражены при применении миансерина и тразодона. Неврологические эффекты: мелкий тремор, нарушения координации, головная боль, мышечные подергивания, эпилептические припадки у предрасположенных пациентов, изредка — периферическая невропатия. Другие эффекты: аллергические кожные высыпания, легкая холестатическая желтуха, изредка — агранулоцитоз. При использовании миансерина отмечалась, хотя и весьма редко, лейкопения (Committee on the Safety of Medicines 1981), ввиду чего производители препарата рекомендуют при его применении регулярно проверять количество лейкоцитов в крови. Тератогенный эффект не был отмечен у женщин, но все же при беременности, особенно в первой ее трети, антидепрессанты следует назначать с осторожностью.
Отменяют антидепрессанты постепенно. Резкая отмена может вызвать тошноту, тревогу, чрезмерное потоотделение и бессонницу.
При передозировке трициклические антидепрессанты вызывают множество побочных эффектов, иногда очень серьезных. В таких случаях необходима срочная помощь специалистов в больнице общего профиля, но психиатр должен знать основные признаки передозировки. Они могут быть изложены следующим образом. Сердечно-сосудистые эффекты включают фибрилляцию желудочков, нарушение проводимости и низкое кровяное давление. Частота пульса может быть повышенной или пониженной, что в определенной степени зависит от нарушения проводимости. Нарушение дыхания ведет к респираторной недостаточности. Возникающая гипоксия увеличивает возможность сердечных осложнений. Может развиться аспирационная пневмония. Осложнения со стороны центральной нервной системы таковы: возбуждение, мышечные подергивания, судороги, галлюцинации, делирий, кома. Могут развиться пирамидные и экстрапирамидные симптомы. Парасимпатические симптомы — это сухость во рту, расширение зрачков, затуманенность зрения, задержка мочеиспускания, пирексия. Большинство больных нуждаются только в наблюдении и уходе, но особенно важен контроль за сердечной деятельностью, а при аритмии необходима срочная помощь специалиста в отделении интенсивной терапии. Трициклические антидепрессанты задерживают опорожнение желудка, поэтому при передозировке его необходимо промыть в течение нескольких часов после приема чрезмерной дозы препарата. Промывание должно проводиться с особой осторожностью, чтобы предотвратить возможность аспирации желудочного содержимого. Если это необходимо, перед промыванием в трахею вводится интубационная трубка с надувной манжетой.
Сердечно-сосудистые побочные эффекты трициклических антидепрессантов, описанные ранее, в комплексе с их кардиотоксическим эффектом при передозировке позволили предположить, что трициклические антидепрессанты могут быть опасными для пациентов с заболеваниями сердца. Данные противоречивы: Британская служба мониторинга лекарств (British drug monitoring system) связывает некоторые смертельные случаи при поражениях сердца с амитриптилином (Coull et al. 1970), но такая же система в Соединенных Штатах не подтверждает этой связи (Boston Collaborative Drug Surveillance Program 1972). Трициклические антидепрессанты обладают холинолитическим и хинидиноподобным действием и ослабляют сократительную функцию миокарда. Эти лекарства, таким образом, могут нарушать сердечную деятельность. Однако Veith et al. (1982) не обнаружили воздействия трициклических антидепрессантов на функцию левого желудочка (как в покое, так и после физической нагрузки) у депрессивных пациентов с хроническим заболеванием сердца.
Как уже отмечалось, возможно, что антидепрессанты без выраженного холинолитического действия (такие, как миансерин или тразодон) более безопасны, чем другие антидепрессанты, однако это не доказано. Orme (1984) пришел к выводу, что любые антидепрессанты в общем безопасны для больных с легкими сердечными заболеваниями, но при тяжелых поражениях сердца (например, инфаркт миокарда, сердечная недостаточность, электрокардиографически подтвержденная блокада пучка Гиса или блокада сердца) трициклические антидепрессанты могут применяться только с очень большой осторожностью.
Метаболизм трициклических антидепрессантов конкурентно тормозится производными фенотиазина и усиливается барбитуратами (но не бензодиазепинами). Трициклические антидепрессанты усиливают прессорный эффект норадреналина, адреналина и фенилефрина путем торможения их обратного захвата (Boakes et al. 1973), и это может осложнить применение местной анестезии при стоматологических операциях или в других случаях хирургического вмешательства. Трициклические антидепрессанты препятствуют также действию гипотензивных препаратов бетанидина, клонидина, дебризоквина и гуанетидина. Но они не взаимодействуют с бета-адреноблокаторами, употребляемыми для лечения гипертонии. В качестве альтернативы миансерин может применяться для лечения больных депрессией, которые страдают также и гипертонией, поскольку он взаимодействует только с клонидином. Взаимодействие трициклических антидепрессантов с ингибиторами моноаминоксидазы рассматривается далее.
Противопоказания включают агранулоцитоз, тяжелое поражение печени, глаукому и гипертрофию простаты. Эти лекарства необходимо весьма осторожно назначать эпилептикам, пожилым, а также пациентам после коронарных тромбозов.
Клиницист должен быть хорошо знаком с двумя «стандартными» препаратами, один из которых обладает более выраженным седативным действием. Амитриптилин (более седативный) и имипрамин (менее седативный) отвечают этим требованиям и тщательно исследованы во многих клинических испытаниях. Врач должен также знать препарат, который имеет мало антихолинергических побочных эффектов и менее кардиотоксичен, чем остальные; можно выбрать, например, миансерин, хотя пока нет уверенности в том, что его антидепрессивное действие столь же сильно, как у амитриптилина. Нет смысла менять один трициклический препарат на другой в надежде получить терапевтический эффект, если один из них такого эффекта уже не дал; нет также смысла в назначении одновременно двух или более этих препаратов (комбинирование трициклических антидепрессантов и ингибиторов моноаминоксидазы рассматривается далее). Не дают преимуществ и препараты, содержащие сочетание антидепрессанта и нейролептика — производного фенотиазина. Ажитация обычно так же хорошо поддается контролю седативным антидепрессантом. Если необходимо поддержать его действие производным фенотиазина, то лучше давать эти лекарства раздельно, чтобы установить адекватные дозы каждого из препаратов независимо.
Если депрессивному больному необходимо гипотензивное средство, то лучше, если для этой цели используется диуретик, соответствующий бета-адреноблокатор (такой как пропранолол) или комбинация этих двух препаратов. Если это невозможно, требуется тщательно измерять кровяное давление не реже чем раз в неделю, поскольку другие гипотензивные средства могут вступать во взаимодействие с трициклическими препаратами, о чем говорилось ранее. При необходимости корректируется доза гипотензивного средства. Важно также продолжать измерять кровяное давление и быть готовым пересмотреть дозу гипотензивного средства при отмене антидепрессанта.
Выбрав соответствующее антидепрессивное средство, очень важно объяснить больному, что терапевтический эффект может наступить не сразу, а через две-три недели, хотя сон, вероятно, улучшится раньше. Необходимо также сообщить, что побочные эффекты (сухость во рту, нарушения аккомодации, запор) появятся раньше терапевтического эффекта. Более пожилой человек должен быть предупрежден о возможности постуральной гипотензии. Следует убедить больного, что большинство из этих явлений постепенно будут исчезать с продолжением применения препарата. Поскольку самочувствие больного может ухудшиться из-за побочных явлений до наступления терапевтического эффекта, врач должен повторно навестить его через неделю (тяжелых депрессивных больных — еще раньше), установить, какие именно побочные явления возникли, и объяснить происхождение тех из них, о которых ранее не было сказано. Он должен ободрить больного, убедить его продолжать прием лекарства, одновременно оценив глубину депрессии.
Начальная доза должна быть умеренной (например, амитриптилин назначают в количестве 75–100 мг в день). При необходимости эту дозу увеличивают примерно через неделю, когда степень выраженности побочных явлений уже может быть выяснена. Вся доза антидепрессанта обычно назначается на ночь, так что седативный эффект лекарства может улучшить сон, а пик побочных явлений приходится на ночное время и, вероятно, больной его не заметит. Дозы должны быть меньшими у пожилых пациентов, у тех, у кого имеются сердечные заболевания, гипертрофия простаты или другие состояния, которые могут обостриться вследствие приема трициклических антидепрессантов, а также у больных с заболеваниями печени и почек.
Если через две или три недели депрессивное состояние не смягчается, не следует менять одно лекарство на другое. Вместо этого врач должен попытаться выяснить, почему не был достигнут терапевтический эффект: принимал ли пациент лекарство в назначенной дозе; правилен ли диагноз; какие социальные факторы играют роль в поддержании болезненного состояния. Негативное отношение пациента к приему антидепрессантов — обычное явление. Оно связано с мрачной уверенностью депрессивного больного в том, что уже ничто не может ему помочь, нежеланием терпеть неприятные побочные явления и опасением, что однажды начав прием лекарства, он уже никогда не сможет от него отказаться.
В случае достижения терапевтического эффекта следует продолжать применение лекарства в полной дозе в течение еще шести недель. Затем лечение необходимо продолжать сниженной дозой на протяжении следующих шести месяцев (Mindham et al. 1973). Если при сокращении дозы возникает обострение, прежняя доза должна быть восстановлена по меньшей мере на три месяца, и только тогда можно попробовать повторно снизить дозу. (Существует иная тактика: прекращение терапии сразу после окончания депрессивной фазы. — Ред.)
Ингибиторы моноаминоксидазы
Хотя в психиатрии ингибиторы моноаминоксидазы используются уже в течение многих лет, истинная природа их терапевтического действия до сих пор не установлена бесспорно. Они безусловно обладают анксиолитическими свойствами. Они также могут обладать и специфическим антидепрессивным действием, которое ограничивается менее тяжелыми депрессивными расстройствами. Антидепрессивный эффект надежно не доказан, и всякое улучшение, наблюдаемое у больного, может быть связано с анксиолитическим действием лекарства. Сообщается, что ингибиторы моноаминоксидазы могут иметь терапевтическое значение при фобических тревожных состояниях (Sargant, Dally 1962), тревожных расстройствах с приступами паники (Sheehan et al. 1980). Одно из этих лекарств — транилципромин — обладает таким же стимулирующим действием, как и амфетамин. Это частично поддерживает сложившееся мнение о характере антидепрессивного действия всех лекарств этой группы.
Следует помнить, однако, что наряду с этим умеренным терапевтическим эффектом существует широкий спектр опасных реакций несовместимости с определенными лекарствами и пищевыми продуктами. Эти реакции настолько серьезны, что мы рекомендуем никогда не применять ингибиторы моноаминоксидазы в качестве препаратов первого выбора, прибегая к ним только после полной неудачи адекватного лечения одним из трициклических или подобных антидепрессантов. И даже при этих условиях ингибиторы моноаминоксидазы не должны применяться часто. Однако следует знать, что единого мнения по этому вопросу не существует.
Ингибиторы моноаминоксидазы (ИМАО) инактивируют энзимы, окисляющие норадреналин, 5-гидрокситриптамин, тирамин и другие амины, которые присутствуют в организме в качестве трансмиттеров или поступают с пищей либо принимаются в качестве лекарств. Моноаминоксидаза существует в ряде форм, которые имеют различия в отношении субстрата и особенностей тормозящего действия. Действие ИМАО не ограничивается моноаминоксидазой. Эти лекарства ингибируют также гидроксилазы в печени, метаболизирующие барбитураты, трициклические антидепрессанты, фенитоин (дифенин) и антипаркинсонические препараты. Торможение моноаминоксидазы развивается быстро, но после отмены ИМАО восстановление энзима до прежнего уровня активности происходит в течение двух недель, так что опасность реакции несовместимости сохраняется на все это время. Полное описание этих важных свойств ингибиторов моноаминоксидазы можно найти в обычных учебниках фармакологии.
Имеется несколько препаратов, но все они, за исключением транилципромина, обладают почти одинаковым терапевтическим действием. Ипрониазид является прототипом этой группы лекарств, но его гепатотоксическое действие определяет непригодность для широкого применения в психиатрии. Фенелзин — наиболее часто используемый препарат, поскольку он менее токсичен для печени, чем другие. Изокарбоксазид, как сообщается, имеет меньше побочных эффектов, чем фенелзин, и может быть использован в случаях, когда больные хорошо поддаются лечению фенелзином, но страдают от его побочных эффектов в виде гипотензии и нарушений сна. Транилципромин отличается от других ИМАО сочетанием способности ингибировать моноаминоксидазу и амфетаминоподобного стимулирующего действия, что приветствуется многими больными. В самом деле, препарат частично метаболизируется в амфетамин. Иногда это лекарство употребляется в комбинации с трифлуоперазином в виде препарата «парстелин» (10 мг транилципромина и 1 мг трифлуоперазина в каждой таблетке), но нет достаточных оснований назначать эту комбинацию. Некоторые пациенты становятся зависимыми от стимулирующего эффекта транилципромина (см., например, Griffin et al. 1981). Более того, по сравнению с фенелзином этот препарат чаще может провоцировать гипертонические кризы, хотя меньше поражает печень. По этой причине транилципромин следует назначать с большой осторожностью.
Ингибиторы моноаминоксидазы быстро всасываются и распределяются по всему организму. Большинство из них — это производные гидразина, которые инактивируются ацетилированием их боковой цепочки в печени. Скорость этого ацетилирования у разных людей различна и детерминирована генетически. Сообщалось, что пациенты с замедленным ацетилированием лучше поддаются антидепрессивному действию этих лекарств (Johnstone, Marsh 1973). Интересующее клиницистов негидразиновое соединение транилципромин метаболизируется быстро и в основном элиминируется в течение 24 часов.
Они включают сухость во рту, затруднение мочеиспускания, постуральную гипотензию, головную боль, головокружение, тремор, парестезии в руках и ногах, запоры, отеки суставов. Соединения гидразина могут привести к гепатоцеллюлярной желтухе.
Пища и напитки
Некоторые пищевые продукты содержат тирамин — вещество, которое обычно инактивируется моноаминоксидазами, в основном в кишечнике и печени. Если эти энзимы ингибируются, то тирамин не разлагается и, проникая в организм, оказывает; свое гипертензивное действие. Этот эффект является следствием выделения норадреналина с последующим повышением кровяного давления. Оно может достичь опасного уровня и привести к субарахноидальному кровоизлиянию. Важный ранний симптом такого криза — сильные, обычно пульсирующие головные боли. Основными пищевыми продуктами, которых следует избегать, являются экстракты из мяса и дрожжей, копченая и маринованная рыба, жареная домашняя птица или дичь и сыры — особенно камамбер, бри, стилтон, горгонзола, чеддер и некоторые сыры американского производства. Кьянти, некоторые красные вина и пиво также могут вызвать реакцию. Почти четыре пятых зарегистрированных случаев реакций несовместимости ИМАО с пищевыми продуктами и почти все случаи смерти были следствием употребления сыра (McCabe 1986). Гипертонические кризы лечат, блокируя альфа-адренорецепторы парентеральным введением фентоламина или, если это лекарство недоступно, внутримышечной инъекцией хлорпромазина. За кровяным давлением требуется следить очень тщательно.
Лекарства
Пациентам, принимающим ингибиторы моноаминоксидазы, нельзя назначать лекарства, метаболизм которых зависит от энзимов, подавляемых ИМАО. Такие лекарства включают симпатомиметические амины (адреналин, норадреналин, амфетамин и фенфлурамин), фенилпропаноламин и эфедрин (который может присутствовать в каплях для лечения ринита). L-ДОФА и дофамин также могут вызывать гипертонические реакции.
Антигипертензивные лекарства, такие как метилдофа и гуанетидин, и антигистаминные препараты также не показаны. Местные анестетики часто содержат симпатомиметические амины, и их следует избегать. Морфин, петидин, прокаин, кокаин, алкоголь, барбитураты и инсулин могут быть вовлечены в опасные взаимодействия с ИМАО. Повышается чувствительность к оральным антидиабетическим средствам с соответствующим риском гипогликемии. Метаболизм барбитуратов, фенитоина (дифенина) и других лекарств, распадающихся в печени, может быть замедлен.
Трициклические лекарства также взаимодействуют с ингибиторами моноаминоксидазы, что иногда является причиной гиперпирексии, беспокойства, мышечных подергиваний и ригидности, судорог и комы. Если ИМАО добавляется к трициклическому антидепрессанту и доза каждого лекарства хорошо отрегулирована, такие реакции очень редки. Некоторые клиницисты применяют такую комбинацию, считая, что она более эффективна, чем каждое средство в отдельности. Эта практика обсуждается в гл. 8 (см.). Подчеркнем, что ИМАО должен быть добавлен к трициклику; неправильно добавлять трициклик к уже принимаемому ИМАО, поскольку при этом увеличивается возможность серьезной реакции несовместимости. Комбинации лекарств, если их вообще назначать, могут использоваться только специалистами, имеющими опыт их применения (приобретенный под наблюдением еще более опытного специалиста), и только у тех пациентов, которые могут точно соблюдать дозировку и сообщать о возможных побочных явлениях. Имипрамин, так же как и кломипрамин и другие лекарства, обладающие относительно специфическим действием на обратный захват серотонина, не должны назначаться совместно с ИМАО (White, Simpson 1981).
Возможность взаимодействий следует учитывать и при замене ингибиторов моноаминоксидазы трициклическими антидепрессантами. Трициклики не должны назначаться в течение двух недель после отмены ИМАО, поскольку может возникнуть реакция несовместимости. Если трициклики назначаются первыми (как это делают при комбинированном лечении), интервал между применением лекарств не нужен. Это еще одно основание для того, чтобы всегда начинать лечение депрессивных больных с трициклических антидепрессантов.
Они включают болезни печени, феохромоцитому, выраженную сердечную недостаточность и состояния, требующие применения лекарств, несовместимых с ИМАО.
Как уже объяснялось, ингибиторы моноаминоксидазы не должны назначаться первыми при лечении депрессивных состояний. Если же их назначают, то больным необходимо подробно объяснить, какие возможны реакции несовместимости с пищевыми продуктами и отдельными лекарствами. Нужно подробно записать все, что сказано (устные наставления пациент может забыть), и дать больному эту карту, образец которой представлен на рис. 17.1. Пациент должен обязательно показать эту карту любому врачу или стоматологу, который его лечит. Следует предупредить больного, чтобы он покупал патентованные лекарства только у квалифицированного фармацевта, которому также необходимо показать эту карту.
ЛЕЧЕБНАЯ КАРТА-ПАМЯТКА
Постоянно носите эту карту с собой. Предъявляйте ее любому врачу; который будет лечить Вас (за исключением назначившего это лекарство), в том числе и Вашему дантисту, если Вы нуждаетесь в стоматологическом лечении.
ИНСТРУКЦИИ ДЛЯ ПАЦИЕНТА
Пожалуйста, прочтите внимательно!
Во время приема этого лекарства, а также в течение 10 дней после окончания курса лечения необходимо соблюдать следующие простые правила:
1. НЕ УПОТРЕБЛЯЙТЕ в пищу определенные продукты, в частности СЫР, МАРИНОВАННУЮ СЕЛЬДЬ, БОБЫ В СТРУЧКАХ.
2. ИСКЛЮЧИТЕ из употребления блюда, содержащие ЭКСТРАКТЫ ИЗ МЯСА И ДРОЖЖЕЙ.
3. НЕ ПРИНИМАЙТЕ никаких других ЛЕКАРСТВЕННЫХ СРЕДСТВ (будь то таблетки, капсулы, капли в нос, средства для ингаляций или свечи, приобретенные Вами без рецепта или по рецепту, выписанному ранее), не проконсультировавшись предварительно с Вашим врачом или с Вашим фармацевтом.
Внимание! Помните, что любые препараты от кашля, насморка, головной боли, а также тонизирующие средства тоже являются лекарствами.
4. ИЗБЕГАЙТЕ употребления АЛКОГОЛЬНЫХ НАПИТКОВ; полностью откажитесь от красных вин, особенно типа кьянти.
Сообщайте о любых серьезных симптомах своему врачу и неукоснительно придерживайтесь данных им рекомендаций.
ИМАО
Подготовлено Фармацевтическим обществом и Британской медицинской ассоциацией совместно с Министерством здравоохранения Соединенного Королевства.
Рис. 17.1. Лечебная карта-памятка (соответствует форме, предусмотренной British national formulary)
Если требуется применить ИМАО, то лучше всего выбрать фенелзин, начав с дозы в 15 мг два раза в день с последующим постепенным повышением до 15 мг четыре раза в день. Хотя пациенты чаще отдают предпочтение транилципромину (благодаря его амфетаминоподобному эффекту), мы не рекомендуем применять этот препарат из-за возможного развития зависимости, связанной с его стимулирующим действием.
Если эти лекарства не оказывают терапевтического эффекта, следует сделать не менее чем двухнедельный перерыв до назначения вместо ИМАО других антидепрессантов. Отмена ИМАО должна проводиться постепенно.
Гипотеза о том, что при депрессивных состояниях уменьшается содержание в мозге 5-окситриптамина (5-НТ, серотонина), привела к терапевтическому применению L-триптофана и 5-окситриптофана (5-НТР), которые способны преодолевать гематоэнцефалический барьер. Эти вещества иногда применяются в чистом виде, иногда — в комбинации с ингибитором моноаминоксидазы (для замедления их метаболизма) или с блокатором обратного захвата серотонина (5-НТ) — кломипрамином, назначаемым для повышения концентрации 5-НТ в синаптических щелях (в настоящее время широко распространены селективные ингибиторы обратного захвата серотонина. — Ред.). Даже в такой комбинации антидепрессивное действие L-триптофана или 5-НТР окончательно не доказано (Badlessarini 1984). Если все же один из этих препаратов употребляется, это допустимо лишь в порядке лечебного эксперимента в случаях, когда проведенный адекватный курс другого антидепрессивного лечения не дал эффекта.
Фармакология
5-Окситриптамин синтезируется из триптофана окислением в 5-окситриптофан, затем декарбоксилированием. Он разрушается моноаминоксидазой. L-Триптофан — это незаменимая аминокислота, которая, вероятно, не имеет выраженного самостоятельного фармакологического действия, в частности не влияет на настроение психически здоровых людей.
Фармакокинетика
Триптофан хорошо всасывается. Он вступает во множество обменных реакций и быстро разрушается в печени пирролазой, образуя кинуренин и в конечном итоге — никотиновую кислоту. Активность триптофан-пирролазы усиливается кортизолом и эстрогенами и индуцируется самим L-триптофаном.
Доступные препараты
Триптофан доступен в виде таблеток, содержащих 0,5 г препарата в смеси с 5 мг пиридоксина гидрохлорида и 10 мг аскорбиновой кислоты (которые являются соответственно и кофакторами в реакциях декарбоксилирования и окисления). Он также выпускается в смеси с шоколадным порошком для смягчения неприятного вкуса большого количества L-триптофана.
Нежелательные эффекты
L-Триптофан почти не имеет побочных эффектов, кроме тошноты и анорексии, возникающих вскоре после начала его приема. Он вызывает сонливость днем и может улучшить ночной сон, если принимать его вечером.
Рекомендации к применению
Недостаточность данных о терапевтическом эффекте препарата убеждает в том, что он не должен применяться как средство первого выбора для лечения депрессивных расстройств. Он может иногда назначаться больным, у которых не добились лечебного эффекта другими методами терапии, но клиницист не должен рассчитывать на значительные результаты.
Литий
Соли лития стали использовать в медицине более ста лет назад, первоначально как средство для лечения подагры. В 1940-е годы их применяли в качестве заменителя поваренной соли у больных с сердечной недостаточностью, находящихся на бессолевой диете. Поскольку часто возникали токсические проявления, такая практика была отменена. Как лечебное средство при мании соли лития были впервые применены Cade в 1949 г. в Австралии. Использование карбоната лития для лечения и профилактики аффективных нарушений было введено в практику в результате работы Schou в Дании.
Чаще всего литий применяется для предупреждения приступов мании и депрессии. Он также употребляется для лечения острых эпизодов мании. Литий имеет и антидепрессивное действие, но оно менее выражено; во всяком случае, такое действие выражено не более, чем у трициклических антидепрессантов, которые к тому же не столь токсичны. Сообщалось также, что карбонат лития снижает предменструальное напряжение, но это не было достаточно убедительно подтверждено. Данные о терапевтическом эффекте лития при депрессивных состояниях анализировались в главе об аффективных расстройствах (см.).
В опытах на животных литий воздействует на ряд медиаторов и энзимов, хотя некоторые из этих эффектов наблюдались только при концентрациях лития, значительно превышающих применяемые для лечения людей. Неясно, какое из многих фармакологических действий ионов лития может объяснить их терапевтический эффект.
Литий быстро всасывается из кишечника и также быстро проникает в жидкую среду и ткани, замещая натрий и калий, противодействуя магнию и кальцию. Литий медленнее натрия выходит из клеток, из плазмы выделяется почками, частично задерживается в клетках и других частях организма. Следовательно, наблюдаются фаза быстрого выделения лития из плазмы почками и фаза более медленного удаления его из тканей всего организма. Литий, как и натрий, фильтруется и частично реабсорбируется в почках. Если проксимальные канальцы абсорбируют больше воды, то и абсорбция лития возрастает. Ввиду этого дегидратация вызывает увеличение концентрации лития в плазме. Поскольку при транспорте литий конкурирует с натрием, он больше реабсорбируется при снижении концентрации натрия. Тиазидовые диуретики повышают экскрецию натрия, не увеличивая экскреции лития; таким образом, они могут привести к токсическим концентрациям лития в крови.
Ввиду того что терапевтическая и токсическая дозы лития очень близки, важно во время лечения периодически измерять концентрацию лития в крови. Впервые измерения проводят через 4–7 дней после начала применения лития, затем — еженедельно в течение трех недель и наконец (при условии, что достигнуто удовлетворительное стабильное состояние и содержание лития в крови) — один раз в шесть недель. После приема одиночной пероральной дозы уровень лития в плазме возрастает в два или три раза в течение четырех часов. Поэтому концентрацию лития измеряют не ранее чем через 12 часов после приема последней дозы, обычно перед утренней дозой, прием которой при необходимости может быть отложен на один или два часа. Важно следовать этому правилу, поскольку публикуемые данные о концентрациях лития относятся именно к результатам измерений через 12 часов после последней дозы, а не во время «пика» в течение четырех часов после ее приема. Если обнаруживается неожиданно высокая концентрация, необходимо установить, не принял ли больной случайно свою дозу лития перед взятием крови на анализ.
До последнего времени было принято считать, что для профилактики концентрация лития в плазме должна составлять 0,7–1,2 ммоль/л при измерении через 12 часов после приема очередной дозы. Однако Srinivasan и Hullin (1980) утверждают, что эти уровни концентрации неоправданно завышены. Они полагают, что для профилактики достаточна концентрация 0,5–0,8 ммоль/л[44], а более высокая концентрация необходима только при лечении острого приступа. Это мнение теперь принято многими. При лечении острой мании концентрация в плазме ниже 0,9 ммоль/л, очевидно, неэффективна; требуемая концентрация, по-видимому, должна достигать 0,9–1,4 ммоль/л (Prien et al. 1972). Серьезные токсические реакции возникают при концентрациях выше 2,0 ммоль/л, хотя ранние симптомы могут появиться в интервале 1,5–2,0 ммоль/л.
Хотя обычно концентрация измеряется через 12 часов после приема последней дозы, представляется наиболее вероятным, что нарушения, вызываемые литием, зависят от концентрации его в крови в период ее наибольшего повышения. Поэтому были созданы таблетки пролонгированного действия для уменьшения пика концентраций, однако скорее всего изменение концентрации во времени при приеме этих таблеток не отличается от наблюдаемого при приеме обычного карбоната лития (Srinivasan, Hullin 1980). Желательно назначать литий в два приема в день, а не в один: в этом случае пик концентраций менее высок. Исключение делается для тех пациентов, которые регулярно принимают лекарство один раз в день, а второй раз в тот же день принять его обычно забывают.
Некоторое увеличение диуреза, связанное с экскрецией натрия, развивается сразу после приема лекарства. Другими обычными побочными эффектами являются тремор рук, сухость во рту, металлический привкус во рту, ощущение мышечной слабости и утомляемость. Поздние эффекты заключаются в следующем. Вслед за начальным изменением диуреза, связанным с выделением натрия, у многих больных развивается нарушение концентрационной способности почек, что ведет к полиурии и полидипсии. У некоторых больных развивается синдром несахарного диабета (см. ниже). Полиурия может вызвать дегидратацию (с риском интоксикации литием, так что больным необходимо употреблять достаточное количество жидкости, чтобы компенсировать ее потери). Некоторые больные, особенно женщины, во время приема лития прибавляют в весе. Постоянный мелкий тремор, особенно рук, обычен, но если тремор крупный, то это дает основание предполагать повышение концентрации лития до токсических уровней. Большинство больных адаптируются к мелкому тремору; тем же, кто не может к нему привыкнуть, назначают пропранолол по 10 мг три раза в день, что обычно уменьшает тремор. Сообщалось об отдельных случаях частичного облысения при отсутствии гипотиреоза (Mortimer, Dawber 1984) и о ломкости волос у некоторых больных (McCreadie, Farmer 1985).
У 5 % больных, принимающих литий, наблюдается увеличение щитовидной железы. Железа уменьшается при приеме тироксина, несмотря на дальнейшее применение лития; полный возврат щитовидной железы к нормальным размерам определяется через месяц или два после прекращения приема лития (Schou et al. 1968). Литий влияет на функцию щитовидной железы; гипотиреоз развивается примерно у 20 % подвергающихся лечению литием женщин (Lindstedt et al. 1977), при этом компенсаторно растет секреция тиреостимулирующего гормона. Функцию щитовидной железы нужно проверять каждые шесть месяцев, с тем чтобы обнаружить эти изменения, однако периодические исследования не могут заменить постоянного наблюдения за клиническими проявлениями, особенно признаками сонливости и значительного прибавления в весе. В случае если гипотиреоз развивается, а необходимость приема лития все еще велика, следует присоединить тироксин.
Отмечаются также обратимые изменения на ЭКГ. Это может быть связано с замещением калия в миокарде литием, поскольку аналогичные изменения (с уплотнением T-волн и инверсией или расширением QRS) характерны для гипокалиемии. Другими нарушениями являются обратимый лейкоцитоз и (в редких случаях) папулезные или макулопапулезные высыпания. По некоторым сообщениям, длительное лечение литием может вести к остеопорозу у женщин, однако это не подтверждено убедительными данными.
Длительное воздействие на почки вызывает у некоторых больных определенные расстройства. В 10 % случаев наблюдается стойкое нарушение концентрационной функции почек, в незначительном количестве случаев развивается синдром нефрогенного несахарного диабета, вызванного противодействием лития эффекту антидиуретического гормона. Этот синдром не поддается воздействию антидиуретической терапии, но обычно проходит после прекращения применения препарата, хотя известны случаи стойкого синдрома (Simon et al. 1977). Были описаны структурные изменения в почках у животных, получавших токсические дозы лития (Radomski et al. 1950), но при значительно более высоких дозах, чем эквивалентные применяемым при лечении людей. Были также сообщения о поражениях почечных канальцев у пациентов, получавших длительное лечение (Herstbech et al. 1977). Частота патологических находок изменяется в зависимости от критериев, по которым отбирались больные для исследования. Среди больных с нарушениями функции почек у большинства наблюдались изменения в канальцах; среди остальных больных такие изменения были выявлены только у одного из шести (Bendz 1983). Сообщалось и о склерозе гломерул, но нарушения функции гломерул наблюдались редко. Glen et al. (1979) не обнаружили повышения уровня смертности вследствие поражения почек у 784 больных, принимавших литий в течение многих лет, и нет данных об уремии, безусловно вызванной литием (Anonymous 1984). Таким образом, нет оснований опасаться поражения почек (при условии, что до начала лечения их функция была нормальной) в случае, если концентрации лития не превышают 1,2 ммоль/л. Все же, учитывая современный уровень знаний, целесообразно проводить простые тесты функционального состояния почек каждые шесть месяцев (см. далее). Читателям, нуждающимся в более подробной информации о влиянии лития на почки, рекомендуется работа Myers et al. (1980).
У некоторых больных отмечается влияние лития на память. Они жалуются на ежедневно повторяющиеся пробелы в памяти, например забывчивость в отношении хорошо известных имен. Возможно, такие нарушения памяти вызваны скорее аффективными расстройствами, чем лекарством. Эти субъективные впечатления о нарушениях памяти не согласуются с результатами психологического тестирования в группах больных, принимающих литий и не получающих его (Smigman, Perris 1983). Однако у нормальных людей-добровольцев применение лития вызывало незначительные, но отчетливо определяемые нарушения памяти, ухудшение некоторых процессов переработки и усвоения информации (Glue et al. 1987).
Они зависят от дозы и проявляются в атаксии, нарушении координации движений конечностей, мышечных подергиваниях, смазанной речи и спутанности. Токсические эффекты требуют срочной медицинской помощи, поскольку возможно дальнейшее развитие токсической реакции, приводящее к коме, судорожным припадкам, а в конечном итоге к смерти. Если развиваются такие симптомы, необходимо сразу же прекратить применение лития и назначить усиленный прием жидкости с добавлением хлористого натрия для стимуляции осмотического диуреза. В тяжелых случаях может потребоваться почечный диализ. Литий быстро удаляется из организма, если функция почек не нарушена; поэтому у большинства пациентов наступает полное выздоровление; иногда возможен летальный исход. Однако сообщалось, что в некоторых случаях наблюдались стойкие неврологические поражения, несмотря на проводимый гемодиализ (von Hartitzsch et al. 1972).
Литий проникает через плаценту. Сообщалось о повышенном количестве аномалий развития у детей, матери которых получали литий в период беременности. По некоторым данным, отклонения наблюдаются в 7 % случаев, причем чаще всего поражается сердце ребенка (Kallen, Tandberg 1983). Поэтому необходимо избегать применения лития в первой трети беременности (Weinstein 1980). Литий проникает в грудное молоко в таком количестве, что его концентрация в плазме крови грудного ребенка достигает половины (или более) концентрации в крови матери. В таких случаях следует перевести младенца на искусственное вскармливание.
В ряде сообщений приводятся случаи серьезных токсических реакций у больных, которым литий назначался одновременно с большими дозами галоперидола для лечения острого приступа мании (Cohen, Cohen 1974; Loudon, Waring 1976). Эти реакции проявляются в оглушенности, треморе, признаках нарушения экстрапирамидных и мозжечковых функций. Из четырех случаев, описанных Cohen и Cohen, у двоих больных впоследствии сохранилась деменция, а еще у двоих — стойкая дискинезия. Другие исследователи не подтвердили этих данных в отношении больных, принимающих оба этих лекарства. Высказывалось предположение о том, что в случаях, описанных Cohen и Cohen, у больных был одновременно и энцефалит. Однако Loudon и Waring считают, что нужна особая осторожность при дозах галоперидола более 40 мг в день в сочетании с концентрацией лития выше 1 ммоль/л. Пока не будут получены дополнительные данные, представляется целесообразным следовать этой рекомендации.
Тиазидовые диуретики могут усиливать токсичность лития, поэтому их и не следует назначать одновременно с ним. Если пациент, получающий литий, нуждается в хирургическом лечении с применением миорелаксантов, следует предупредить анестезиолога о приеме лития, поскольку он может потенцировать действие миорелаксантов. При этом необходимо прекратить прием лития за 48–72 часа до операции (см.: Drugs and Therapeutics Bulletin 1981a; Havdala et al. 1979).
К ним относятся почечная недостаточность или недавнее заболевание почек, сердечная недостаточность или недавно перенесенный инфаркт миокарда, хроническая диарея, способная вызвать изменения электролитного баланса. Желательно не назначать литий детям, а также (что уже объяснялось ранее) в начальном периоде беременности. Не следует прописывать его пациентам, которые вряд ли смогут соблюдать профилактические меры, необходимые для его безопасного употребления.
Важно тщательно соблюдать принятую схему лечения, поскольку терапевтические дозы лития воздействуют на щитовидную железу и почки, а превышение дозы оказывает токсическое действие. Предлагаемая здесь схема представляет один из нескольких разработанных в настоящее время подходов, которые могут в достаточной степени обеспечить безопасность. Успешное лечение требует внимания к деталям. Вот почему описываемые ниже меры изложены достаточно подробно.
Перед назначением лития следует провести соматическое обследование, включая измерение кровяного давления. Полезно также взвесить больного. В моче должны быть определены белок, сахар и произведен подсчет форменных элементов. Кровь исследуется на электролиты, мочевину, креатинин плазмы, гемоглобин, СОЭ с полным подсчетом клеточного состава крови. Если необходимо особенно тщательное обследование, следует определить креатининовый клиренс, причем обычно достаточны пробы за 18 часов. Необходимы также тесты на функцию щитовидной железы: Т4 как отсеивающий тест с последующим Т3-тестом, TSH (ТТГ) и FTI в зависимости от показаний (чтобы решить, какие тесты предпочтительны, целесообразно проконсультироваться с клиницистом или эндокринологом). Если потребуется, необходимо провести ЭКГ исследование, тест на беременность, определить клиренс лития.
Если по этим тестам противопоказаний к применению лития нет, нужно убедиться в том, что больной не употребляет тиазидовые диуретики. Затем необходимо дать подробные объяснения и рекомендации пациенту. Он должен знать, в чем проявляются ранние токсические эффекты при чрезмерно высоком уровне лития в крови и при каких обстоятельствах они наиболее вероятны (например, во время интеркуррентного гастроэнтерита, инфекции почек или вторичной дегидратации при лихорадке). Пациента следует предупредить, что при возникновении подобных явлений он должен прекратить прием лития и обратиться за советом к врачу. Обычно полезно привлекать к соответствующим беседам и других членов семьи. Часто целесообразно оставить письменные инструкции (написанные самим врачом или предлагаемые фармацевтическими фирмами). При проведении бесед необходимо соблюдать определенный баланс, чтобы не встревожить больного излишним подчеркиванием опасностей, связанных с приемом лития, и при этом не упустить никакой важной информации, необходимой пациенту для активного и сознательного участия в процессе лечения.
Начало лечения. Литий обычно назначается в виде углекислой соли. Лечение нужно начинать и продолжать, применяя препарат двумя дозами с промежутком в 12 часов. Единственным исключением могут быть случаи, когда пациент постоянно забывает принимать одну из доз, и тогда можно попробовать применять только вечернюю дозу. Если лекарство назначается с профилактической целью, начинать нужно с дозы в 750–1000 мг в день, разделив ее на два приема, при этом исследуя кровь на содержание лития каждую неделю и корректируя дозу до достижения необходимой концентрации. Для профилактики наиболее благоприятным уровнем является концентрация 0,4–0,8 ммоль/л (в пробе крови, взятой через 12 часов после последнего приема лекарства, как уже объяснялось); если эта концентрация не дает лечебного эффекта, необходимо достичь предварительно принятого более высокого уровня 0,7–1,2 ммоль/л. Следует помнить, что может потребоваться несколько месяцев, чтобы проявился полный эффект применения лития.
При продолжении лечения концентрацию лития в крови следует определять каждые шесть недель. Важно предусмотреть меры, которые напоминали бы пациенту и врачу о времени, когда необходимо проводить исследования. Если врач назначил литий нескольким больным, полезно придерживаться специального графика, составленного таким образом, чтобы было невозможно пропустить время исследования. Каждые шесть месяцев берут пробы крови для определения электролитов, мочевины, креатинина и проведения полного клинического анализа, а также исследуется функция щитовидной железы. Полученные результаты фиксируют в табличной форме в истории болезни, с тем чтобы данные последовательно проводимых исследований можно было легко сравнивать. Если в двух проведенных последовательно, с месячным интервалом, исследованиях функции щитовидной железы определяется развитие гипотиреоза, необходимо либо прекратить применение лития, либо назначить L-тироксин. Полиурия, вызывающая беспокойство больного, может быть основанием для того, чтобы сократить дозу, однако стойкая полиурия требует специального исследования почек, включающего определение их концентрационной способности. Стойкий лейкоцитоз встречается часто, но он, по-видимому, безвреден и быстро исчезает после окончания приема препарата.
Пока применяется литий, врач должен помнить о возможности редко встречающегося взаимодействия с галоперидолом (см. ранее). Необходимо также внимательно следить за токсическими эффектами, если используются и другие нейролептики или ЭСТ. Если какому-либо пациенту требуется проведение анестезии, анестезиолога следует предупредить о том, что больной получает литий: как уже отмечалось, имеются отдельные наблюдения о потенцировании литием действия миорелаксантов.
Литий обычно применяется по меньшей мере в течение года, но часто значительно дольше. Вопрос о необходимости продолжения терапии должен пересматриваться раз в год, причем следует обращать внимание даже на незначительные колебания настроения больного, поскольку в таких случаях отмена лекарства может привести к возобновлению болезни. В продлении лечения чаще всего нуждаются больные, у которых в течение короткого промежутка времени наблюдалось несколько приступов аффективного расстройства, а также пациенты, у которых расстройство было настолько тяжелым, что нужно избегать малейшего риска его возобновления. Некоторые больные принимают литий в течение 15 лет и более, но при этом каждые пять лет необходимо заново решать вопрос о продолжении лечения.
Если литий отменить внезапно, то у некоторых больных развиваются раздражительность и эмоциональная лабильность (King, Hullin 1983), а иногда возобновляется аффективное расстройство, чаще в виде мании, чем депрессии. Хотя частота таких реакций точно не установлена, отмена лития должна производиться постепенно, в течение нескольких недель.
Стимуляторы центральной нервной системы
К этому классу лекарств относятся мягкие стимуляторы, среди которых наиболее известен кофеин, и более сильные, такие как амфетамин. Другие слабые стимуляторы включают в себя фенкамфамин, меклофеноксат и пемолин. Иногда эти препараты рекомендуют для лечения состояний истощения и сенильных проявлений, однако целесообразность их применения для этой цели сомнительна. Для лечения депрессивных расстройств они непригодны.
Наиболее важными из сильных стимуляторов являются амфетамины. Хотя в прошлом эти препараты широко употреблялись, в настоящее время они не рекомендуются из-за часто возникающей при их применении зависимости. Они безусловно не подходят для лечения депрессивных расстройств. Прежде эти средства употреблялись для снижения аппетита, но теперь это не практикуется. Единственным показанием для их применения у взрослых в настоящее время является нарколепсия. (Их использование при гиперкинетическом синдроме у детей обсуждается здесь.)
Еще один стимулятор центральной нервной системы — кокаин — обладает еще более выраженной способностью вызывать зависимость. В психиатрии он не используется, хотя изредка назначается умирающим больным, часто в комплексе с диаморфином или морфином.
Основными препаратами являются дексамфетамина сульфат, применяемый при нарколепсии в дозе 10 мг частями в течение дня с последующим постепенным повышением (по 10 мг в течение каждой недели) до 50 мг в день, и метиламфетамина гидрохлорид, который обладает идентичными свойствами.
Побочные действия: возбуждение, бессонница, отсутствие аппетита, головокружение, тремор, сердцебиение и сердечная аритмия. Токсические эффекты при больших дозах проявляются в дезориентации и агрессивном поведении, галлюцинациях, судорогах и коме. Длительное злоупотребление может привести к параноидному состоянию, сходному с параноидной шизофренией (Connell 1958). Амфетамины несовместимы с ингибиторами моноаминоксидазы. Они противопоказаны при сердечно-сосудистых заболеваниях и тиреотоксикозе.
Противоэпилептические средства
Противоэпилептические препараты часто называют также антиконвульсантами, хотя это название не вполне адекватно, поскольку не все эпилептические припадки сопровождаются судорогами. Эти препараты применяются обычно в целях профилактики — отдельный припадок не лечится. Однако в случаях, когда судорожные припадки непрерывно продолжаются длительное время (status epilepticus) или часто повторяются с краткими перерывами (серии припадков), необходимо применение лекарств для прекращения припадков. Психиатр должен знать об этих лекарствах не только потому, что он может быть приглашен для лечения больных с эпилепсией, но и в связи с тем, что некоторые из таких препаратов провоцируют нарушения поведения.
Для лечения эпилепсии применяется большое количество соединений, которые обычно классифицируются в зависимости от их химической структуры. Это гидантоины, барбитураты, сукцинимиды, бензодиазепины, карбамазепин и вальпроат натрия. Однако химические различия малоинтересны для клинициста, которому гораздо более полезной представляется классификация лекарств по их эффективности при различных типах эпилепсии. Прежде чем дать такую классификацию, необходимо рассмотреть некоторые характеристики основных групп этих лекарств.
Гидантоины широко употребляются со времени введения фенитоина (дифенина) в лечебную практику в 1938 г. Это единственное средство, которое и теперь используется в общей практике.
Барбитураты, применяемые с 1912 г., до последнего времени были наиболее часто назначаемыми противоэпилептическими препаратами. Чаще всего для контроля судорожных расстройств применялись фенобарбитал и близкий к нему препарат примидон (гексамидин).
Другие соединения. Карбамазепин химически близок к трициклическим антидепрессантам, отличаясь от имипрамина только более короткой боковой цепочкой. Эта структура предполагает наличие также антидепрессивного действия лекарства (см.). Вальпроат натрия имеет отличную от строения других противоэпилептических средств структуру, являясь солью карбоновой кислоты с разветвленной цепочкой. Сультиам является производным сульфонамида.
| Таблица 17.8. Классификация припадков и препаратов выбора | ||
|---|---|---|
| Тип припадков | Препарат первого выбора | Другие препараты |
| а) Парциальные, или фокальные (как простые, так и сложные) | Карбамазепин | Фенитоин (дифенин) или вальпроат натрия |
| б) Генерализованные | Карбамазепин или вальпроат натрия | Фенитоин (дифенин) |
| тонико-клонические | Карбамазепин или вальпроат натрия | |
| Абсансы | Вальпроат натрия | Этосуксимид (суксилеп) |
| Миоклонические и атонические | Вальпроат натрия | Клоназепам |
При лечении эпилепсии выбор лекарства больше основывается на наличии или отсутствии побочных действий, чем на различиях в эффективности в отношении припадков. Для парциальных (иначе называемых фокальными) припадков (как сложных, так и простых) препаратом выбора является карбамазепин, в то время как основными альтернативными средствами могут быть дифенин или вальпроат натрия. Дифенин обладает узким диапазоном доз для контроля припадков и более, чем карбамазепин, способен вызывать побочные эффекты. При тонико-клонических генерализованных припадках выбирают прежде всего либо карбамазепин, либо вальпроат натрия. Для лечения абсансов наиболее эффективен вальпроат натрия, причем альтернативным средством может быть этосуксимид (суксилеп). До последнего времени миоклонические и атонические припадки плохо поддавались лечению противоэпилептическими средствами, однако некоторые из них теперь контролируются более новыми средствами — вальпроатом натрия или клоназепамом.
Препараты, применяемые при эпилептическом статусе
Препаратом первого выбора является диазепам, вводимый внутривенно. Необходимо иметь в виду возможность угнетения дыхания и венозного тромбофлебита. Как правило, при внутримышечном введении диазепам неэффективен при эпилептическом статусе, но его можно с достаточным эффектом вводить per rectum, особенно если трудно попасть в вену больного (Munthe-Kaas 1980). Если диазепам не дает нужного результата, следует применить внутривенное вливание хлорметиазола. В прошлом основным средством лечения был паральдегид; затем он почти вышел из употребления, однако сейчас к нему все чаще прибегают в случаях, когда диазепам не помогает. Паральдегид можно вводить внутримышечно, per rectum или внутривенно. Если используется шприц из пластика, лекарство следует вводить сразу же после его набора в шприц. Если же статус продолжается, несмотря на принятые меры, то можно попробовать дифенин при проведении ЭКГ — мониторинга (из-за опасности сердечной аритмии) или применить фенобарбитал, предварительно проконсультировавшись с невропатологом (кроме чрезвычайных случаев). Подробные инструкции в отношении подбора доз приведены в British паtional formulary и в соответствующих руководствах. Полезный обзор по вопросам лечения эпилептического статуса дан Rimmer и Richens (1988).
Создается впечатление, что противоэпилептические средства не обладают общим фармакологическим действием, определяющим их терапевтический эффект. Возможно, они действуют различными путями и на разных стадиях развития судорожной активности. Например, фенобарбитал повышает порог судорожной готовности, в то время как дифенин, по-видимому, ограничивает распространение разряда. До тех пор пока не будут более глубоко изучены соответствующие механизмы, рассмотрение вопроса о фармакодинамике противоэпилептических средств не представляет практической ценности для клиницистов.
В настоящее время используется так много различных противоэпилептических средств, что при любых обобщениях, касающихся их фармакодинамики, придется делать оговорки о тех или иных исключениях. Большинство этих лекарств хорошо всасываются, но дифенин, который не очень хорошо растворяется в воде и абсорбируется в разных количествах из различных препаратов, является исключением. Большинство противоэпилептических средств метаболизируются в печени и выделяются с мочой в виде связанных или свободных соединений. Многие из них обладают длительным действием. Поэтому они могут назначаться один или два раза в день при условии, что единичная доза не так велика, чтобы вызвать побочные явления, связанные с пиком содержания лекарства в плазме после приема. Карбамазепин является исключением и должен назначаться три раза в день большинству больных.
Как правило, полезно измерять концентрацию препарата в плазме, поскольку она не всегда однозначно связана с величиной принятой дозы. Хотя это можно делать при лечении большинством обычно применяемых лекарств, измерение концентрации наиболее необходимо при использовании дифенина, поскольку в этом случае соотношение между применяемой дозой и концентрацией в плазме особенно неустойчиво. Что касается любого лекарства, необходимо учитывать, сколько времени прошло между приемом последней дозы и моментом взятия пробы крови, поскольку иначе возникнут трудности при оценке и интерпретации результатов.
Все противоэпилептические средства потенциально вредны и должны употребляться достаточно осторожно. Ввиду того что побочные эффекты у разных препаратов различны, здесь может быть дан только общий обзор. Прежде чем назначить лекарство, необходимо тщательно изучить справочники, такие как British national formulary, или обзор Jeavons (1970).
Дифенин обладает множеством побочных действий. Он часто вызывает гипертрофию десен. Угри, гирсутизм, огрубление черт лица достаточно часты, поэтому необходимо осторожно относиться к его назначению. Со стороны нервной системы нередко развиваются мозжечковые симптомы (атаксия, дизартрия, нистагм), что указывает на передозировку; у детей интоксикация часто возникает без появления соответствующих симптомов, из-за чего ее нередко упускают из виду. Высокая концентрация в плазме (более 40 мг/мл) может вызвать острое органическое психическое расстройство. Согласно Glazer (1972), дифенин бывает причиной энцефалопатии, одним из проявлений которой может стать учащение припадков. Возможны гематологические нарушения: мегалобластическая анемия, связанная с дефицитом фолиевой кислоты, лейкопения, тромбоцитопения и агранулоцитоз. Может снизиться концентрация кальция в плазме. Reynolds (1968) предположил, что психические нарушения вследствие побочных эффектов дифенина обусловлены дефицитом фолиевой кислоты. Однако достаточно убедительных доказательств в пользу этой гипотезы нет (Richens 1976).
Карбамазепин дает меньше побочных явлений. Сонливость, атаксия и диплопия могут развиться при слишком высокой его концентрации в плазме; бывают также проявления идиосинкразии — эритематозные высыпания, задержка жидкости, гепатит, лейкопения или другие патологические изменения крови. Вальпроат натрия оказывает мало побочных действий; наиболее частыми из них являются потенцирование действия седативных препаратов, гастроинтестинальные расстройства (их можно предотвратить, принимая лекарство вместе с пищей или применяя вяжущие препараты) и ожирение. Изредка возникали тромбоцитопения, тремор, временное выпадение волос, серьезные нарушения функции печени. Предлагалось исследовать функцию печени до назначения лечения (Drugs and Therapeutics Bulletin 1981a), но это признается не всеми. Побочные эффекты фенобарбитала при лечении эпилепсии включают в себя сонливость, раздражительность, при высоких дозах — смазанную речь и атаксию. У детей часто наблюдаются гиперактивность или эмоциональные нарушения, ухудшается обучаемость, могут появиться кожные высыпания. По возможности следует избегать применения этого лекарства.
Дети, матери которых страдают эпилепсией, немного чаще имеют врожденные дефекты, включая заячью губу и незаращение неба (волчья пасть). Эти пороки развития обусловлены, возможно, применением антиконвульсантов во время беременности. Однако не исключено, что каким-либо неизвестным путем они связаны и с самой эпилепсией. Все это следует учитывать, сопоставляя с риском, связанным с отменой препарата в каждом конкретном случае.
При столь большом количестве различных противоэпилептических средств трудно сделать общие выводы о взаимодействии этих лекарств. Важно помнить, что именно метаболизм в печени, играющий большую роль в выведении их из организма, усиливается под влиянием некоторых соединений (особенно фенобарбитала, дифенина, гексамидина и карбамазепина). Сультиам замедляет метаболизм дифенина, фенобарбитала и гексамидина. Некоторые противоэпилептические препараты усиливают метаболизм других лекарств, в том числе пероральных противозачаточных средств (в таких случаях рекомендуется применять другие методы контрацепции). Подобное воздействие оказывается также на антидепрессанты, антикоагулянты, фолиевую кислоту, витамин D и стероиды; в таких случаях нередко приходится повышать дозу этих веществ. Поэтому если клиницист, применяющий противоэпилептические средства, недостаточно знаком с такими их эффектами, он должен обратиться к учебному пособию по клинической фармакологии. Эта рекомендация относится также и к применению карбамазепина для профилактики приступов аффективных расстройств (см.).
Противопоказаний немного, и они специфичны для каждого препарата. Врач, назначая лекарство, с действием которого недостаточно знаком, должен их внимательно оценить. Нужно особенно подчеркнуть, что применение фенобарбитала для лечения эпилепсии (особенно у детей и психически больных) ограничено, поскольку это часто ведет к нарушениям поведения. Больным, страдающим заболеваниями почек и печени, противоэпилептические средства следует назначать с осторожностью.
Психиатру чаще приходится продолжать уже проводимое лечение больных эпилепсией, чем начинать лечение больных с впервые установленным диагнозом. У некоторых больных эпилепсия и психические расстройства не взаимосвязаны, у других психопатологические симптомы вторичны по отношению к эпилепсии или проводимому противоэпилептическому лечению. Нарушения поведения при лечении чаще возникают в случае применения барбитуратов, а также при передозировке других противоэпилептических средств. Психиатр обычно продолжает лечение, назначенное до него врачом общей практики или невропатологом, и прежде чем внести какие-либо изменения, он должен обсудить этот вопрос с назначившим лечение врачом. Если психиатр назначает лечение в новом, первично диагностированном случае, он должен помнить, что лечение назначается на многие годы, потому целесообразны консультации со специалистом и семейным врачом. Лекарственное лечение не следует назначать по поводу единичного припадка (однако нужно провести необходимые исследования, чтобы установить его причину).
Оптимальной практикой является назначение только одного противоэпилептического лекарства и тщательный подбор его дозы. Внезапные изменения дозы небезопасны, поскольку это может вызвать эпилептический статус. Выбирают лекарство, о котором известно, что оно должно быть эффективным при той форме эпилепсии, которая наблюдается у данного больного (см. ранее). Если первый выбор не приводит к успеху, следует попытаться сделать второй, назначая также только один препарат. При широком выборе различных препаратов, доступных в настоящее время, лишь в редких случаях допустимо применять два препарата одновременно, и лишь в порядке исключения — более двух препаратов. В случае использования комбинации препаратов следует тщательно проанализировать возможность их взаимодействия. Особенно важно избегать таких комбинаций лекарств, как сультиам с дифенином (первый препарат может повысить концентрацию дифенина в плазме до токсического уровня); фенобарбитал с гексамидином (последний распадается до фенобарбитала); вальпроат натрия с лекарствами типа клоназепама, которые также обладают седативным эффектом. Кроме того, в каждом конкретном случае важно учитывать прием пациентом и других лекарств, применяемых для иных целей, и решить, могут ли они взаимодействовать с противоэпилептическими средствами.
В течение всего времени лечения необходимо внимательно следить за возможными побочными действиями употребляемого лекарства. В то же время врач должен удостовериться, что больной точно соблюдает назначенную схему приема лекарства. Нужно предупредить больного об опасности внезапного прекращения приема лекарства (частой причины развития эпилептического статуса). Если возникает необходимость замены одного лекарства другим, новое лекарство следует назначать так, чтобы постепенно достичь необходимой дозы. Только после этого можно отменить первое лекарство.
После установления эффективного режима лечения это лечение следует продолжать до тех пор, пока не будут полностью устранены припадки; период, в течение которого они отсутствуют, должен составлять не менее двух лет. Если же терапевтический эффект недостаточен, необходимо проверить концентрацию лекарства в плазме (слабый эффект лечения, возможно, связан либо с недостатком, либо с избытком лекарства); измерение концентрации проводится также при любых изменениях в неврологическом статусе и поведении больного или при других признаках лекарственной интоксикации. Если лекарство подлежит окончательной отмене, это можно делать только постепенно.
В Соединенном Королевстве больной эпилепсией имеет право вождения собственного автомобиля (но не общественного транспорта или тяжелых грузовиков) при условии, что в течение предшествующих двух лет у него не было припадков или в течение не менее чем трех лет такие припадки были только во время сна. Однако больные эпилепсией, у которых припадки можно контролировать только дозами лекарств, вызывающих сонливость, не должны водить машину. Если имеются сомнения, необходимо проконсультироваться со специалистов по лечению эпилепсии. Обзор по вопросам эпилепсии и вождения автотранспортных средств см. у O’Brien (1986).
Электросудорожная терапия (ЭСТ)
Судорожная терапия была введена для лечения шизофрении в конце 1930-х годов на основании принятого тогда ошибочного мнения, что при шизофрении не бывает эпилептических припадков, и наоборот. Исходя из этого предполагали, что искусственно вызванные судорожные припадки должны привести к улучшению при шизофрении. Но когда такое лечение начали применять на практике, оказалось, что наилучший эффект судорожная терапия дает при депрессивных состояниях, а не при шизофрении, причем она приводит к значительному уменьшению числа затяжных случаев и снижению смертности (Slater 1951). Вначале припадки вызывались либо кардиазолом (Meduna 1938), либо пропусканием электрического тока через мозг (Cerletti, Bini 1938). С течением времени общепринятым стало применение электрической стимуляции. В дальнейшем использование кратковременной анестезии и мышечных релаксантов сделало этот метод лечения безопасным и приемлемым.
В этом разделе мы суммируем показания к применению электросудорожной терапии. Более полную информацию об эффективности этого метода можно найти в главах, где описываются отдельные психопатологические синдромы.
ЭСТ — быстрый и эффективный метод лечения тяжелых депрессивных расстройств. По заключению Medical Research Council (Clinical Psychiatry Committee 1965), ЭСТ действует быстрее, чем имипрамин или фенелзин, более эффективна, чем имипрамин, у женщин, и более эффективна, чем фенелзин, у всех больных (хотя Greenblatt et al. 1964 не обнаружили разницы в реакции у мужчин). Эти наблюдения совпадают с мнениями многих клиницистов и с нашими рекомендациями в этой книге, что ЭСТ должна в основном применяться в тех случаях, когда важно быстро добиться терапевтического эффекта.
В связи с этим наиболее важным показанием для ЭСТ является риск самоубийства, депрессивный ступор или реальная опасность для жизни и здоровья, связанная с отказом больного от потребления жидкости, что ведет к нарушению функции почек. Менее серьезным показанием может быть продолжающееся тяжелое депрессивное расстройство, не поддающееся адекватному лечению антидепрессантами, а также депрессивное расстройство, вызывающее крайний дистресс, который требует быстрого купирования. ЭСТ также показана при некоторых послеродовых депрессивных расстройствах, когда требуется быстро вернуть мать к уходу за ребенком. В прошлом ЭСТ применялась для лечения мании. Хотя в настоящее время имеются достаточно эффективные лекарственные средства, ЭСТ все еще используется при мании в исключительных случаях, не поддающихся лечению лекарствами (см.). Клинический опыт показывает, что ЭСТ может вызвать быстрый эффект при острой кататонической шизофрении (хотя не имеется данных специальных клинических испытаний, подтверждающих это), а также при депрессивных формах шизоаффективного психоза (при других формах шизофрении ЭСТ не показана). Применение ЭСТ при этих состояниях более подробно рассматривается в других главах этой книги. Читатель может найти полезные краткие рекомендации о показаниях для ЭСТ в меморандуме Royal College of Psychiatrists (1977) и более полные данные в обзоре Kendell (1981).
Специфический терапевтический эффект ЭСТ можно исследовать, изучая физиологические и биохимические изменения в головном мозге. В первую очередь при определении характера действия ЭСТ следовало бы установить, зависит ли терапевтический эффект от судорожного припадка или же для этого достаточно других факторов, таких как прохождение тока через мозг либо применяемые при ЭСТ анестезия или мышечные релаксанты. Клиницисты обычно убеждены в том, что терапевтический эффект не наступает, если не возникает судорожного припадка. Это мнение поддерживается многими психиатрами, но строго не доказано специальными исследованиями. Например, улучшение у больных заметно менее выражено, если судороги смягчаются введением лидокаина (Cronholm, Ottosson 1960) или когда вызывают только субсудорожное состояние (Miller et al. 1953). Улучшение также резко ослабляется, если не осуществляется электрошок, но анестезия и другие аспекты процедуры ЭСТ остаются теми же (Brill et al. 1959; Robin, Harris 1962; Freeman et al. 1978). Однако существуют и некоторые сомнения, поскольку все эти испытания были проведены с методическими недостатками. Например, в исследовании Cronholm и Ottosson подбор больных производился не в случайном порядке, а у Robin и Harris не вполне удовлетворительными были методы количественной оценки. Но при всех условиях накопленные данные, взятые в совокупности, указывают на важную терапевтическую роль судорог. Этот вывод подтверждается также заметным лечебным эффектом судорог, вызываемых препаратами флуротил или «индоклон» (Laurell 1970).
Существует несколько форм электростимуляции, применяемой в ЭСТ, и до сих пор не выяснено, какая из них наиболее приемлема. По сравнению со стимуляцией переменным синусоидальным током стимуляция короткими импульсами требует меньшего напряжения для вызывания судорог. Предполагалось, что стимуляция короткими импульсами влечет за собой меньшие нарушения памяти сразу после ЭСТ (Valentine et al. 1968). Но это не подтверждено, и, видимо, нет особых различий в нарушениях памяти при различных формах стимуляции (Warren, Groome 1984; Squire, Zouzounis 1986). Более того, антидепрессивное действие может быть меньшим после стимуляции импульсным током низкого напряжения, чем при стимуляции переменным током высокого напряжения, даже если оба вида стимулов вызывают судороги одинаковой продолжительности (Robin, de Tissera 1982). Объяснить меньший антидепрессивный эффект можно тем, что судороги, хотя и одинаковые по продолжительности, менее интенсивны после стимуляции током низкого напряжения. Некоторые непрямые доказательства в пользу этого взгляда представляет тот факт, что стимуляция током низкого напряжения ведет к меньшему выделению пролактина, что, по-видимому, отражает и интенсивность судорог (Robin et al. 1985). Проводились опыты на животных для определения изменений в нейротрансмиттерах после судорог, вызванных электрическим раздражением по методике, соответствующей применяемой при ЭСТ. При такой процедуре отмечалось снижение активности бета-адренергических рецепторов и повышение активности 5-НТ2 рецепторов. Первое изменение соответствует тому, которое наблюдается при применении антидепрессантов, но в отношении активности 5-НТ2 рецепторов обнаружены противоположные сдвиги (Kellar, Stockmeier 1986). Постсинаптическая чувствительность к дофамину также повышается, если судить по нейроэндокринным реакциям на апоморфин (Grahame-Smith et аl. 1978). Такие находки (хотя они и представляют определенный интерес) трудно интерпретировать, поскольку моноаминовые системы взаимодействуют. Например, повышение чувствительности 5-НТ2 рецепторов вследствие повторных судорожных припадков зависит от интактных норадренергических путей (Kellar, Stockmeier 1986).
Если ЭСТ проводится без премедикации атропином, пульс вначале замедляется, а затем быстро повышается до 130–190 ударов в минуту, падая до исходного уровня или даже несколько ниже к концу судорожного состояния и сменяясь опять легкой тахикардией, продолжающейся несколько минут. Принято считать, что атропин устраняет оба периода замедления пульса, хотя контролируемое исследование Wyant и MacDonald (1980) не подтвердило этого. Если не применяются мышечные релаксанты, наблюдаются соответствующие изменения кровяного давления. Если же релаксант назначается, то изменения кровяного давления выражены меньше, хотя систолическое давление может повышаться и до 200 мм рт. ст. Церебральный кровоток также возрастает до 200 %. Если атропин не применяется, то во время ЭСТ почти у 70 % больных появляется сердечная аритмия; адекватные дозы атропина значительно снижают такую аритмию при условии, что сердце здоровое. Более детально эти физиологические изменения описаны у Perrin (1961). Наблюдается повышение выброса пролактина и нейрофизина во время судорожного припадка и вскоре после его окончания (Whalley et al. 1982).
В течение многих лет электрический ток, применяемый при ЭСТ, всегда подавался через два электрода, расположенных на противоположных сторонах головы. Сравнительно недавно было установлено, что потеря памяти после ЭСТ выражена меньше, если оба электрода помещены над субдоминантным полушарием. Поскольку действие ЭСТ, по-видимому, связано с судорогами, лечение будет одинаково эффективно независимо от того, как расположены электроды, если только при этом развивается генерализованный припадок. До последнего времени не было достаточно серьезных опровержений этого взгляда. Действительно, обзор 20 соответствующих исследований, сделанный d’Elia и Raotma (1975), дал основания для заключения, что унилатеральное и билатеральное расположение приводит к одинаковому антидепрессивному эффекту. Однако дальнейшие испытания, проведенные по двойной слепой методике, показали, что билатеральное расположение более эффективно. Во-первых, после билатеральной ЭСТ депрессивное расстройство проходит быстрее, чем после унилатеральной (Gregory et al. 1985). Во-вторых, показано, что к концу терапии билатеральной ЭСТ отмечается более выраженный положительный эффект (Malitz et al. 1986). В-третьих, установлено, что после шести сеансов билатеральной ЭСТ значительное улучшение наблюдалось у большего количества пациентов (81 %), чем при унилатеральной ЭСТ (56 %) (Abrams et al. 1983). Результаты этих и других исследований сложно интерпретировать, поскольку их методика резко различалась в нескольких отношениях: по количеству сеансов ЭСТ на курс лечения, типу стимуляции и дозировке применяемого тока, а также по критериям, которые использовались для решения вопроса о том, были вызваны судороги или нет. Horne et al. (1985) также было установлено, что при унилатеральном расположении электродов случаи, когда не удается вызвать судорожный припадок (судя по ЭЭГ-мониторингу), бывают чаще, чем при билатеральном. Если же принимались меры для того, чтобы добиться судорог, то в результате наблюдений не обнаружено разницы в действии между уни- и билатеральной ЭСТ. В связи с этим все еще не определено, действительно ли билатеральная ЭСТ более эффективна, чем унилатеральная; но все же, если необходимо срочно получить лечебный эффект (например, у пациентов с выраженными суицидальными идеями), следует предпочесть билатеральную ЭСТ, как и в тех случаях, когда эффективность нескольких первых сеансов унилатеральной ЭСТ недостаточна. (Методика определения доминантного полушария и выбора расположения электродов описана здесь.)
Субконвульсивный шок может сопровождаться тревогой и головными болями. ЭСТ вызывает кратковременную ретроградную амнезию, а также потерю памяти на период до 30 минут после припадка. Если сеансы ЭСТ повторяются с короткими перерывами, амнезия нарастает; однако это не всегда случается, если лечение проводится два или три раза в неделю. Некоторые пациенты жалуются на спутанность, тошноту и головокружение в течение нескольких часов после сеанса ЭСТ, но при современных методах эти побочные явления слабо выражены и быстро проходят (Gomez 1975); они также менее выражены при унилатеральной ЭСТ. Иногда пациенты испытывают боли в мышцах, особенно челюстных, что, по-видимому, обусловлено побочным действием миорелаксантов. Имеются отдельные сообщения о спорадически возникающих генерализованных судорожных припадках через несколько месяцев после ЭСТ (см., например, Blumenthal 1955), но такие припадки могли иметь и иные причины. Если они и появляются, то только в течение первого года после лечения.
Бывают случаи повреждения зубов, языка или губ при неудачном введении роторасширителя или интубационной трубки. Несоблюдение правил при наложении электродов может привести к ожогам кожи. Переломы, включая переломы позвонков, иногда возникают при ЭСТ без применения миорелаксантов. Все эти физические последствия редки при условии, что применяется хорошая техника анестезии и припадок модифицируется надлежащим образом. Другие осложнения ЭСТ нетипичны и в основном бывают у людей, страдающих соматическим заболеванием. Они включают в себя аритмии, эмболию легких, аспирационную пневмонию и инсульт. Продолжительное апноэ является редким осложнением, связанным с применением миорелаксантов.
Как уже упоминалось, постоянным эффектом ЭСТ является потеря памяти на непосредственно предшествовавшие сеансу события и нарушение запоминания информации, полученной непосредственно после него. Эти нарушения менее выражены после унилатеральной, чем после билатеральной ЭСТ, а их характер зависит от того, на какую сторону головы наложены электроды: при наложении со стороны недоминантного полушария возникают избирательные нарушения процессов усвоения невербальной информации. Подобные нарушения памяти наблюдаются почти у всех пациентов, получающих ЭСТ, и исчезают в течение нескольких недель после окончания лечения.
Многие больные боятся, что нарушения памяти окажутся длительными, некоторые жалуются на подобные нарушения. Однако специальные исследования не обнаружили отклонений в выполнении тестов на запоминание и уровни памяти до ЭСТ и через несколько недель после ее проведения (Cronholm, Molander 1964). Точно так же в ряде исследований не было обнаружено серьезных отличий в выполнении тестов на запоминание между леченными ЭСТ пациентами и контрольной группой больных, не получавших ЭСТ (Weeks et al. 1980; Johnstone et al. 1980). Но при исследовании давно леченных пациентов, которые заявляют, что страдают стойкими нарушениями памяти после проводившейся в прошлом ЭСТ, Freeman et al. (1980) обнаружили, что эти пациенты хуже выполняли некоторые задания из набора тестов на запоминание, чем в контрольной группе. У них наблюдались также отдельные остаточные депрессивные симптомы, и вполне возможно, что проблемы с памятью были обусловлены продолжающимся депрессивным расстройством. Представляется обоснованным вывод, что при обычных методах проведения ЭСТ не возникает стойких нарушений памяти, за исключением, возможно, очень незначительного количества случаев (и даже в этой группе нет уверенности в том, что нарушения связаны с последствиями ЭСТ, а не с остаточными явлениями исходного депрессивного состояния).
Частота летальных исходов при ЭСТ составляла 3–4 случая на 100 тыс. случаев терапии (Barker, Barker 1959). Обзор всех случаев применения ЭСТ (с использованием анестезии) в Дании привел к аналогичным показателям: один случай на 22 210, т. е. 4–5 на 100 тыс. случаев применения ЭСТ (Heshe, Roeder 1976). Риск в основном связан с анестезией и наиболее высок у пациентов с сердечно-сосудистыми заболеваниями. В случае летального исхода смерть обычно наступает вследствие фибрилляции желудочков или инфаркта миокарда.
Противопоказаниями к применению ЭСТ являются все заболевания, недопустимо повышающие риск при проведении анестезии, например респираторные инфекции, серьезные заболевания сердца, заболевания с резким повышением температуры. Другими противопоказаниями являются заболевания, которые могут обостриться в связи с изменениями кровяного давления или нарушениями ритма сердца, возникающими даже при хорошо модифицируемых припадках. Сюда относятся серьезные заболевания сердца, недавний коронарный тромбоз, аневризмы сосудов мозга или аорты и повышенное внутричерепное давление. Пациенты африканского происхождения, имеющие признаки серповидно-клеточной анемии, требуют добавочных мер для предупреждения падения парциального давления кислорода. Особое внимание следует обращать на пациентов, больных диабетом и принимающих инсулин. Что касается пожилых пациентов, то хотя с возрастом риск, сопряженный с ЭСТ, несколько возрастает, но также увеличивается риск при нелеченной депрессии и при терапии антидепрессантами.
ЭСТ не следует назначать больным, принимающим резерпин (Crammer et al. 1982, с. 233), но она не противопоказана при любом ином лечении психотропными средствами. Если пациент принимает ингибитор моноаминоксидазы или литий, анестезиолог должен об этом знать. Конечно, желательно сообщать анестезиологу обо всех лекарственных средствах, принимаемых пациентом, которого ему предстоит анестезировать.
В этой части будет описана техника проведения ЭСТ. Хотя врачу должна быть известна соответствующая информация, следует помнить, что ЭСТ — практическая процедура, которой необходимо овладеть на практике под руководством опытного специалиста, наряду с этим изучая теоретическую литературу. (Много полезной информации содержит доклад Pippard и Ellam в Королевском колледже психиатров в 1981 году.)
ЭСТ следует проводить в комфортных, обеспечивающих полную безопасность условиях. Пациенты не должны ожидать в помещениях, где они могут видеть или слышать то, что происходит при лечении других больных. Необходимы также помещение для восстановления и отдыха больного после ЭСТ, отдельное от помещения, где проводилось лечение, и адекватное оборудование для оказания экстренной помощи (отсасывающий аппарат, эндотрахеальные трубки, достаточные запасы кислорода и в идеале — дефибриллятор). Обслуживающий и врачебный персонал, проводящий ЭСТ, должен пройти специальную подготовку.
Вначале перед проведением ЭСТ необходимо успокоить больного и установить его личность. Необходимо ознакомиться с его историей болезни, чтобы убедиться в наличии специальной формы, подтверждающей согласие больного на ЭСТ и его способность дать такое согласие. Следует просмотреть также листок назначений, с тем чтобы установить, не получает ли больной такие лекарства, как ИМАО, которые могут быть несовместимы с анестезией. Важно также выяснить, не было ли у него лекарственной аллергии или неадекватных реакций при общей анестезии в прошлом. Список лекарств должен быть представлен анестезиологу. Если пациент недостаточно знаком врачу и анестезиологу, которые проводят ЭСТ, то хотя бы один из них должен обследовать больного в целях выявления признаков соматических заболеваний, особенно недавних заболеваний сердца. Далее следует удостовериться в том, что в течение последних пяти часов больной не ел и не принимал лекарств per os; затем анестезиолог должен проверить, все ли зубные протезы удалены изо рта и нет ли больных и сломанных зубов. Наконец, необходимо выяснить, как больной переносил предыдущие сеансы ЭСТ, если они были, и не было ли затяжного эффекта при применении релаксантов (зависящего от недостаточной активности псевдохолинэстеразы) или других осложнений.
Кроме исключительных случаев, при проведении ЭСТ должен присутствовать анестезиолог. Отсасывающие аппараты, достаточное снабжение кислородом и препараты для оказания неотложной помощи должны быть под рукой. При возможности в помещении или рядом с ним должен быть телефон. Сердечный дефибриллятор также желателен, хотя необходимость в нем возникает весьма редко (Pippard, Ellam 1981); анестезиолог должен сообщить свое мнение о том, что именно может потребоваться в данном случае. Помимо врача и анестезиолога должна присутствовать хотя бы одна медицинская сестра.
Обычно применяется премедикация атропином для уменьшения секреции слюнных и бронхиальных желез и снижения риска аритмии и перевозбуждения вагуса. Часто атропин вводят внутривенно в дозе 0,3–0,6 мг во время анестезии. Иногда его вводят подкожно заранее. Решение о применении атропина, способе его введения, времени применения и дозе должен принимать анестезиолог. (Американская психиатрическая ассоциация рекомендует применять при ЭСТ метоскополамин вместо атропина, поскольку метоскополамин не проникает через гематоэнцефалический барьер. В то же время данные о том, что атропин увеличивает спутанность после ЭСТ, не подтверждены достаточно убедительно.) Затем анестезиолог вводит ультракраткодействующий анестетик (часто метогекситон), сразу после этого — миорелаксант (часто — солянокислый суксаметоний) (вводить отдельным шприцем, хотя игла может использоваться та же). Анестезиолог отвечает за выбор лекарств. Именно он, прежде чем ввести роторасширитель, должен убедиться в том, что кислородное снабжение легких достаточное.
Пока проводится анестезия, психиатр решает, применить ли унилатеральное или билатеральное наложение электродов. Для уточнения доминантного полушария следует выяснить, не левша ли больной, по его ответу на вопрос, какой рукой он бросает или ловит предметы, с какой ноги начинает ходьбу. У правши почти всегда доминантным является левое полушарие, у левши любое полушарие может быть доминантным. Поэтому если есть уверенность в том, что больной не правша, лучше применять билатеральное наложение электродов. Во всех случаях за больным следует установить строгое наблюдение после первого сеанса ЭСТ. Выраженная спутанность, особенно с дисфазией, сохраняющаяся более пяти минут после восстановления сознания, свидетельствует о том, что доминантность определена неправильно. В таких случаях в следующий раз необходимо производить стимуляцию с другой стороны либо применять билатеральную ЭСТ. Если есть какие-то сомнения относительно выбора стороны, следует проводить билатеральную стимуляцию.
Кожу в соответствующих местах очищают, а электроды смачивают перед наложением на кожу (чтобы обеспечить хороший электрический контакт, необходимо сбрить волосы в соответствующих местах; это должен сделать вспомогательный персонал до направления больного на ЭСТ). В то время как сухие электроды могут привести к ожогам, чрезмерно смоченные электроды могут стать причиной короткого замыкания или предотвратить судороги. (Это более вероятно при унилатеральном расположении электродов, поскольку в этом случае они расположены близко один от другого.) Хотя достаточное введение миорелаксантов, как правило, приводит к минимальному развитию судорог, медицинская сестра или другой помощник должны быть наготове, чтобы при необходимости осторожно ограничивать больного.
Теперь необходимо надежно укрепить электроды. При унилатеральной ЭСТ первый электрод размещают на субдоминантной стороне на 4 см выше средней точки прямой, соединяющей наружный угол глаза и отверстие наружного слухового прохода. Второй прикрепляют на расстоянии 10 см от первого вертикально над входом в наружный слуховой проход с той же стороны (рис. 17.2). При билатеральной ЭСТ электроды размещают на противоположных сторонах головы, каждый на 4 см выше средней точки прямой, соединяющей наружный угол глаза и отверстие наружного слухового прохода (обычно как раз над линией волосяного покрова). Теперь можно производить шок.

Рис. 17.2. Унилатеральная ЭСТ. Электроды располагаются: А — на 4 см выше средней точки линии, соединяющей отверстие слухового прохода и угол глаза; В — на расстоянии 10 см от точки А над ухом (см.: Crammer, I., Barraclough, В., Heine, В. 1982. The use of drugs in psychiatry. Gaskell, London)
Существуют различные типы аппаратов для ЭСТ. Некоторые из них дают переменный синусоидальный или модифицированный синусоидальный ток, другие — стимул с постоянным током. В Великобритании сейчас в основном используются аппараты последнего типа. В настоящее время нет достаточных оснований для того, чтобы установить преимущество одного из этих типов, ибо неясно, что важнее — количество электричества (заряд), энергия или амплитуда тока. (Полезная информация по этим вопросам приводится в прил. 6 к монографии Pippard и Ellam 1981.) Следует изучить инструкции производителя для каждого аппарата и придерживаться их, чтобы обеспечить безопасную и правильную эксплуатацию аппарата. Важно также иметь современный запасной аппарат.
Электроды либо укрепляют вместе в одном наголовнике, либо их держит оператор в каждой руке по одному. Последний способ более удобен для достижения хорошего контакта в обоих электродах.
Необходимо внимательно наблюдать за проявлениями припадка. Если была достигнута достаточная мышечная релаксация, должна наблюдаться следующая картина. Вначале появляются подергивания мышц лица и открывается рот; затем верхние веки и большие пальцы на руках и ногах ритмически подергиваются в течение примерно полуминуты. Важно не спутать эти судорожные движения с мышечными подергиваниями, вызванными суксаметонием. Были попытки использовать ЭЭГ-мониторинг для контроля наступления припадка, но данные ЭЭГ часто трудно интерпретировать, поскольку могут наблюдаться в качестве артефакта мышечные сокращения, вызванные непосредственным стимулированием фронтальных мышц. Альтернативным методом может быть изолирование одного из предплечий от воздействия мышечного релаксанта, что обеспечивается наложением манжеты аппарата для измерения кровяного давления на плечо и надуванием ее до уровня выше систолического давления перед введением миорелаксанта. Это давление сохраняется в течение всего периода, когда должен быть припадок, а затем снимается. При этом судорожная активность может наблюдаться в мышцах изолированной части руки. Определяя необходимое давление в манжете, следует иметь в виду, что во время припадка систолическое давление повышается, и если оно в это время превысит уровень давления в манжете, то релаксант попадет в предплечье.
После припадка необходимо подать в легкие достаточно кислорода по заранее введенной дыхательной трубке. Пациент остается под наблюдением анестезиолога и обслуживающего персонала до восстановления дыхания и сознания. В период восстановления пациента поворачивают на бок и проводят все те мероприятия, которые применяются после анестезии при малых хирургических операциях. Квалифицированная медицинская сестра должна наблюдать за больным и организовать его обслуживание. В это время психиатр делает записи, в которых указывает дату и время, принцип расположения электродов, применявшиеся лекарства, дозировку тока, а также дает краткое описание припадка и всех проблем, которые при этом возникали. Когда пациент проснется и у него восстановится ориентировка, он должен в течение часа или около того отдыхать в кровати или кресле.
Если ЭСТ проводится амбулаторно, следует убедиться в том, что больной до прибытия на процедуру не ел и не пил. После ЭСТ он должен отдыхать в течение нескольких часов, не покидая больницы, пока не будет точно установлено, что произошло полное восстановление. Пациент может отправиться домой только в сопровождении ответственного взрослого, желательно сотрудника больницы, естественно, не на велосипеде и не за рулем автомобиля. Авторы этой книги считают, что для проведения ЭСТ пациента лучше помещать в больницу.
Наиболее важной проблемой (помимо связанных с процедурами анестезии) является отсутствие клонических судорог (тонические мышечные сокращения, вызванные током, не должны ошибочно приниматься за судорожный припадок). Если уже ясно, что не возникло судорожного припадка, следует проверить аппарат, электроды, их контакт с кожей. Нужно также учесть возможность короткого замыкания вследствие повышенной влажности кожи. Если перечисленных нарушений не обнаружено, следует считать, что у пациента либо повышенное сопротивление экстракраниальных тканей и кости, либо высокая устойчивость к судорогам. Тогда проблему можно решить повышением энергии на 5 Дж и провести еще одно включение (не следует «для верности» применять такой подход ко всем больным, поскольку это может привести к более серьезным нарушениям памяти после ЭСТ).
В Великобритании билатеральная ЭСТ обычно применяется один раз в неделю, хотя в экстренных случаях в первую неделю можно проводить до трех сеансов. Если и в последующие недели есть необходимость проводить по три сеанса, то преимущество должно быть отдано унилатеральной ЭСТ, поскольку она вызывает менее выраженные нарушения памяти.
Решение о продолжительности курса ЭСТ зависит от клинического опыта, поскольку нет надежной соответствующей информации, основанной на клинических испытаниях. Обычно курс ЭСТ составляет в общем от шести до 12 сеансов. Улучшение следует оценивать не реже чем раз в неделю; обычно некоторое улучшение наблюдается после двух-трех сеансов, далее оно быстро нарастает. Если улучшение развивается быстрее, то проводится меньше сеансов. Если эффекта не наблюдается после шести-восьми сеансов, то курс ЭСТ следует прекратить, поскольку надежды на эффективность процедуры уже нет.
У некоторых пациентов после курса ЭСТ может развиться рецидив, поэтому следует назначить антидепрессанты уже в конце курса ЭСТ, чтобы уменьшить риск возобновления заболевания. В прошлом назначались поддерживающие сеансы ЭСТ каждые 2–4 недели после окончания основного курса для предотвращения рецидива. Не доказано, что такой подход эффективнее, чем применение антидепрессантов, поэтому к нему прибегают исключительно в случаях тяжелой депрессии, не реагирующей на достаточные дозы антидепрессантов (применяемых по отдельности и в комбинации).
До того как пациенту будет предложено дать согласие на проведение ЭСТ, важно объяснить ему характер процедуры, указав на ожидаемый успех и возможный риск (особенно воздействие на память). Важность этого шага подтверждается наблюдениями Freeman, Kendell (1980): при опросе только одна пятая больных, получающих ЭСТ, сообщили, что им были даны адекватные разъяснения. Многие пациенты ожидают развития тяжелых и постоянных расстройств памяти, а некоторые — даже немодифицированных судорожных припадков. Когда врач уверен, что пациент понимает, о чем ему говорят, последнему дают на подпись стандартную форму для изъявления согласия. Больной должен осознать, что данное им согласие относится ко всему курсу лечения ЭСТ, а не только к одному сеансу (хотя пациент, конечно, может отказаться от данного им согласия в любое время). Вся эта разъяснительная работа входит в обязанности врача, и ее не следует передоверять другим сотрудникам из числа медицинского персонала.
Если пациент отказывается дать согласие либо не может его дать, поскольку находится в состоянии ступора или по другим причинам, и все же эта процедура необходима, то в Соединенном Королевстве должны быть рассмотрены такие дальнейшие шаги. В первую очередь нужно решить, нет ли оснований для применения соответствующего раздела Закона о психическом здоровье (Mental Health Act). Согласно этому разделу, никто не имеет права дать согласие от имени пациента, однако может быть официально установлено, что тот психически болен и нуждается в лечении. В Англии и Уэльсе требуется мнение и второго независимого консультанта (согласно Закону о психическом здоровье 1983 г.). Те кто работает в других странах, должны согласовать свои действия с требованиями местных законов. Если решение о лечении принято на основании закона, то после его проведения и выздоровления больного у последнего редко возникают сомнения в необходимости проведенного лечения.
Психохирургия
Термин «психохирургия» относится к использованию нейрохирургических методов для модификации симптоматики психической болезни путем оперативного вмешательства либо на ядрах, либо на белом веществе мозга. Психохирургия ведет свое начало с 1936 г., когда Moniz опубликовал работу об операции, заключавшейся в широком рассечении белого вещества лобных долей (фронтальная лейкотомия). Эта обширная операция была модифицирована Freeman и Watts (1942), которые производили меньшие рассечения в лобных долях через латеральные трепанационные отверстия. Несмотря на то что эта так называемая стандартизованная лейкотомия была далека от анатомически стандартизованной и приводила к неприемлемым побочным эффектам (см. далее), она широко применялась в Великобритании и других странах. Хотя вначале у пациентов наблюдалось улучшение и это воспринималось с энтузиазмом, вскоре стало очевидным, что возникают побочные эффекты (нарушение интеллекта, эмоциональная неустойчивость, нарушение самоконтроля в поведении, апатия, недержание мочи, ожирение и эпилепсия). Это подтолкнуло к поискам более ограниченных рассечений мозга, дающих лечебный эффект с меньшими побочными последствиями. Был достигнут некоторый прогресс, однако в то же время благодаря успехам психофармакологии появилась возможность использовать лекарства для лечения психических расстройств, при которых прежде применялась психохирургия.
Не было проведено контролируемых исследований для установления ценности этих хирургических операций. Если такие операции вообще применимы, то к ним целесообразно прибегать только после очень настойчивых попыток достичь излечения другими методами. При таком подходе необходимость в применении психохирургии будет крайне незначительной. Судить о том, насколько широко применяется психохирургия, сложно. Согласно обзору, сделанному нейрохирургами США и Канады, в течение трех лет (1971–1973) было проведено только 1039 таких операций для лечения психических расстройств (Donnely 1978). Обзор, проведенный в 44 неврологических стационарах на Британских островах, показал, что количество этих операций снизилось со 158 в 1974 году до 119 в 1976 году и все они были проведены по поводу хронической депрессии, тревожных состояний и обсессивно-компульсивного невроза (Barraclough, Mitchell-Heggs 1978). Количество этих операций с тех пор продолжало заметно снижаться.
По мере того как операции на лобной доле становились анатомически менее экстенсивными, в Великобритании наиболее широко применяемыми процедурами стали ограниченное подсечение медиальной трети орбитальной коры и бимедиальная операция, проводимая на фронтоталамическом пучке. В то же время было установлено, что лобная кора имеет комплексные связи с гипоталамусом, височной корой, гиппокампом, амигдалой и мамиллярными тельцами. В связи с этим хирургический подход направлен на некоторые из этих связей так же, как и на лобную долю.
В настоящее время прежние операции «вслепую» заменены стереотаксическими процедурами, что позволяет более точно провести операционные разрезы. Этими стереотаксическими операциями являются трактотомия, лимбическая лейкотомия и амигдалотомия. При стереотаксической трактотомии целью является задняя часть участка, который отделяется путем чрезорбитального подсечения. Повреждение его ткани вызывается имплантацией радиоактивного иттрия (см.: Knight 1972). При стереотаксической лимбической лейкотомии небольшие билатеральные разрезы производят в нижне-медиальном квадранте лобной доли для прерывания двух из фронто-лимбических проводящих путей, и в cingulum (Richardson 1973). При амигдалотомии билатеральное вмешательство осуществляется в амигдалах, в основном для контроля агрессивного поведения (Small et al. 1977).
После операции обычно наблюдается снижение тревоги и напряжения; другие симптомы редуцируются гораздо медленнее. Важно проводить соответствующую реабилитацию в послеоперационный период. Реабилитационные методы зависят от состояний, по поводу которых проводилось лечение. При обсессивном неврозе показаны методы поведенческой терапии, в то время как при депрессивных состояниях необходимы программы социальной реабилитации.
В отношении показаний к применению психохирургии нет единого мнения. Некоторые клиницисты настаивают на том, что психохирургия никогда не должна применяться, другие считают ее методом выбора в небольшом количестве случаев, не поддающихся иному воздействию. Поскольку не было проведено удовлетворяющих современным требованиям контролируемых исследований для оценки этого метода, выводы можно делать только на основании не вполне определенных данных катамнестического наблюдения за больными после проведенной операции. Те, кого лечили стереотаксической субкаудальной трактотомией, наблюдались Ström-Olsen и Carlisle (1971), которые сообщили о 210 пациентах, и Göktepe et al. (1975), которые сообщили еще о 208 больных. В этих двух сериях наблюдений у больных шизофренией (их было немного) состояние практически не изменилось, тогда как при депрессивных расстройствах улучшение наблюдалось в 70 % случаев, при тревожных состояниях — в 60 %, при обсессивных неврозах — в 50 %. В то же время критерии улучшения весьма неопределенны, а из-за отсутствия контрольной группы невозможно установить, каково было бы улучшение без операции.
Шестьдесят шесть пациентов, леченных стереотаксической лимбической лейкотомией, наблюдались Mitchell-Heggs et al. (1976), которые пришли к заключению, что эта операция может помочь определенным категориям пациентов. Они сообщили, что улучшение наблюдается у 78 % больных с депрессивным расстройством, у 66 % с хроническим тревожным неврозом, у 89 % больных с обсессивными нарушениями и у 80 % в небольшой группе шизофреников. Однако методологические сложности затрудняют интерпретацию значимости этих наблюдений.
О серьезных побочных явлениях операций, производившихся на более ранних этапах становления психохирургии, уже сообщалось. При применении новейших стереотаксических процедур побочных явлений значительно меньше, но если они возникают, то также проявляются в виде апатии, ожирения, расторможенности и эпилепсии.
Согласно нашему опыту, упорное и продолжительное лечение медикаментами и поведенческими методами почти всегда ведет к приемлемой ремиссии у пациентов, которые могли бы подвергнуться психохирургии. Хорошим правилом было бы никогда не прибегать к психохирургическому воздействию до того, как будет установлено, что проводимая в течение нескольких лет медикаментозная терапия не дала эффекта. Если следовать этому правилу, то операции вряд ли вообще проводились бы. Хирургическое вмешательство если и допустимо, то лишь при хроническом обсессивном неврозе и тяжелом хроническом депрессивном расстройстве у пожилых больных. Нет ясных показаний для психохирургии при тревожных неврозах и шизофрении. (Для ознакомления с мнением менее консервативного автора рекомендуется обзор Bartlett et al. 1981.)
Вышедшие из употребления методы лечения
ТЕРАПИЯ ДЛИТЕЛЬНЫМ СНОМ
Многие психически больные сообщают о нарушениях сна в течение месяцев, некоторые желают более продолжительного сна. При терапии пролонгированным сном это осуществляется сильной и многократной седацией, продолжающейся постоянно в течение нескольких дней. Больной при этом спит как днем, так и ночью, и его будят только для приема пищи и опорожнения мочевого пузыря и кишечника. Процедура применяется при тяжелых хронических тревожных состояниях и обсессивных неврозах и иногда приводит к некоторому временному улучшению. Но не доказано, что это улучшение глубже и длительнее, чем при менее интенсивных методах лечения, и метод полностью вышел теперь из употребления. Sargant и Slater (1963) приводят детальное описание метода.
Она была введена в конце 1930-х годов Sakel (1938) как способ лечения шизофрении и в течение многих лет широко применялась без проведения контролируемых испытаний. Однако со временем Ackner и Oldham (1962) нашли, что инсулинокоматозная терапия не дает большего терапевтического эффекта, чем повторные периоды бессознательного состояния, вызванные седативными снотворными средствами. Введение нейролептиков показало, что они обладают сильным терапевтическим эффектом. Инсулинокоматозная терапия вскоре была вытеснена из употребления. Процедура в основном заключалась в вызывании повторных гипогликемических ком введением инсулина с последующим их снятием через некоторое время введением глюкозы. Информация об этом методе приведена Sargant и Slater (1963).
Многие больные значительно теряют вес в течение своей болезни. Частью лечения были попытки добиться повышения веса в период улучшения психического состояния. Во время и после второй мировой войны стало популярным применение малых доз инсулина для повышения аппетита пациентов с хроническими тревожными состояниями и с целью добиться не только увеличения веса, но и улучшения психического статуса. Ныне более логичным считается добиться повышения веса лечением первичного психического расстройства. Модифицированная инсулиновая терапия теперь почти не применяется и в этой книге не рекомендуется. Тем, кто желает подробнее ознакомиться с этим методом, рекомендуем работу Sargant и Slater (1963).
Barchas, J.D., Berger, P.A, Ciaranello, R.D., and Elliot, G.R. (1977). Psychopharmacology. Oxford University Press, New York.
Crammer, J., Barraclough, B., and Heine, B. (1982). Use of drugs in psychiatry (2nd edn). Gaskell, London.
Grahame-Smith, D.G., and Aronson, J.K. (1984). Oxford textbook of clinical pharmacology and drug therapy. Oxford University Press, Oxford.
Green, A.R. and Costain, D. (1981). Pharmacology and biochemistry of psychiatric disorders. John Wiley, Chichester.
Royal College of Psychiatrists (1977). Memorandum on the use of electroconvulsive therapy. British Journal öf Psychiatry 131, 261-72.
Silverstone, T. and Turner, P. (1982). Drug treatment in psychiatry (2nd edn). Routledge and Kegan Paul, London.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ