Исследование системы гемостаза
Биологическая система, обеспечивающая, с одной стороны, предупреждение и купирование кровотечений, а с другой – сохранение жидкого состояния циркулирующей крови, обозначается как система поддержания гемостатического потенциала крови (гемостаза). Эта система является частью более сложной многокомпонентной системы регуляции агрегатного состояния крови, в которую включаются все органы и ткани, участвующие в продукции, метаболизме и нейрогуморальной регуляции компонентов системы гемостаза.
В осуществлении гемостаза принимают участие три взаимодействующих между собой функционально‑структурных компонента: стенки кровеносных сосудов, клетки крови (в первую очередь тромбоциты) и плазменные ферментные системы – свертывающая, фибринолитическая, или плазминовая, калликреин‑кининовая и система комплемента.
Внутренняя поверхность кровеносных сосудов (эндотелий) обладает высокой способностью препятствовать образованию тромбов и играет важную роль в сохранении жидкого состояния циркулирующей крови. Это свойство эндотелия связано со следующими его особенностями:
1) способностью образовывать и выделять в кровь мощный ингибитор агрегации тромбоцитов – простациклин, который препятствует склеиванию тромбоцитов;
2) продукцией тканевого активатора, расщепляющего тромбы (фибринолиза);
3) неспособностью к контактной активации системы свертывания крови;
4) созданием антикоагулянтного потенциала на границе кровь/ткань путем фиксации на эндотелии комплекса гепарин – антитромбин III;
5) способностью удалять из кровотока активированные факторы свертывания крови.
Вместе с тем стенка сосудов в силу своих анатомо‑физиологических особенностей – ригидности, эластичности, пластичности – способна противостоять не только давлению крови, но и умеренным внешним травмирующим воздействиям, в силу чего они препятствуют возникновению кровоизлияния (геморрагии). Это свойство, как и способность противостоять выходу эритроцитов из капилляров путем выпота, то есть через механически не поврежденную стенку сосудов, зависит от полноценности эндотелия и от особенностей строения субэндотелиального слоя – степени развития и качества коллагена и микрофибрилл, соотношения коллагеновых и эластических волокон, структуры базальной мембраны. Эти свойства в значительной степени зависят от количества и качественных особенностей тромбоцитов, в силу чего при недостаточном их содержании в крови и/или при тромбоцитопатиях усиливаются как кровоточивость, так и ломкость микрососудов (капилляров).
Капилляры отвечают на повреждение выраженным локальным спазмом – рефлекторным и связанным с высвобождением из стенок сосудов и тромбоцитов адреналина, норадреналина, серотонина и других биологически активных веществ.
Повреждение стенки сосудов способствует активации свертывания крови и тромбоцитарного гемостаза несколькими путями:
1) выделением в кровь тканевого тромбопластина (фактора III, апопротеина С) и других активаторов свертывания и агрегации тромбоцитов – адреналина, норадреналина;
2) контактной активацией коллагеном и другими компонентами субэндотелия как тромбоцитов (склеивания), так и свертывания крови (активация фактора XII);
3) продукцией плазменных кофакторов адгезии и агрегации тромбоцитов – фактора Виллебранда.
Таким образом, стенка сосудов тесно связана и взаимодействует со всеми другими звеньями системы гемостаза, особенно с тромбоцитами.
Участие тромбоцитов в гемостазе определяется в основном следующими их функциями:
1) ангиотрофической – способностью поддерживать нормальную структуру и функцию микрососудов, их устойчивость к повреждающим воздействиям, непроницаемость по отношению к эритроцитам;
2) способностью поддерживать спазм поврежденных сосудов путем высвобождения вазоактивных веществ – адреналина, норадреналина, серотонина;
3) способностью закупоривать поврежденные сосуды путем образования первичной тромбоцитарной пробки (тромба), включающей приклеивание тромбоцитов к стенке сосуда, склеивание их друг с другом, а также синтез, накопление и секрецию активных веществ, стимулирующих адгезию и агрегацию;
4) тромбопластической – способностью тромбоцитов выделять кровеостанавливающие факторы.
Первичная остановка кровотечения в капиллярах осуществляется в основном за счет тромбоцитов. При этом выраженное увеличение времени кровотечения регистрируется не только при значительной тромбоцитопении (менее 30–50 × 109/л). Среди наследственных форм вторичной дисфункции тромбоцитов наиболее важной и распространенной в клинической практике является ангиогемофилия (болезнь Виллебранда), при которой время кровотечения увеличивается до 0,5–1 ч и более, а среди приобретенных форм – нарушения функции тромбоцитов при ДВС‑синдроме (тромбоцитопатия потребления, повреждающее действие продуктов протеолиза), уремии, приеме лекарственных средств (аспирин, антикоагулянты, фибринолитики).
Ведущая роль в реализации первичного гемостаза принадлежит адгезивно‑агрегационной функции тромбоцитов. Чаще всего пусковую роль в этом процессе играет повреждение стенки кровеносных сосудов, вследствие чего тромбоциты вступают в контакт с субэндотелием, в частности – с главным стимулятором адгезии коллагеном, набухают, образуют отростки и приклеиваются (адгезируют) на этих участках. Другими словами, тромбоциты находят место повреждения, приклеиваются к краю поврежденного сосуда, затем увеличиваются в размерах и закрывают отверстие своим «телом». Важнейшими плазменными кофакторами этого процесса являются ионы кальция и синтезируемый в эндотелии белок – фактор Виллебранда (фактор VIII), а в тромбоцитах – взаимодействующий с фактором Виллебранда мембранный гликопротеин.
Из тромбоцитов, подвергающихся адгезии и агрегации, активно секретируются гранулы, которые содержат вещества, усиливающие процесс агрегации и формирующие вторую волну гемостаза.
В результате взаимодействия тромбоцитарных и плазменных факторов в зоне гемостаза образуется тромбин, малые дозы которого резко усиливают и завершают процесс агрегации и одновременно вызывают свертывание крови, в силу чего тромбоцитарный сгусток покрывается фибрином и уплотняется.
Чрезвычайно важную роль в регуляции тромбоцитарного гемостаза играют производные арахидоновой кислоты, высвобождаемой из мембранных фосфолипидов тромбоцитов и стенки сосудов вследствие активации фосфолипаз. В дальнейшем под влиянием циклооксигеназы из арахидоновой кислоты образуются простагландины, а из них в тромбоцитах под влиянием тромбоксансинтетазы вырабатывается чрезвычайно мощный агрегирующий агент – тромбоксан А 2, а в стенке сосудов под влиянием простациклинсинтетазы образуется основной ингибитор агрегации – простациклин. Нарушение образования тромбоксана А 2 в результате снижения активности или блокады циклооксигеназы или тромбоксансинтетазы ведет к выраженному нарушению функции тромбоцитов, способствует развитию кровоточивости, что наблюдается при ряде наследственных и приобретенных тромбоцитопатий. Наоборот, нарушение синтеза в стенке сосудов простациклина или ослабление его поступления в кровь ведет к повышенной склонности тромбоцитов к агрегации и повышенному тромбообразованию.
Для осуществления адгезивно‑агрегационной функции тромбоцитов необходим ряд плазменных кофакторов агрегации – ионы кальция и магния, фибриноген, альбумин и два белковых кофактора, именуемые агрексонами А и В , фосфолипидный кофактор.
Вместе с тем парапротеины, криоглобулины и продукты фибринолиза ингибируют агрегацию тромбоцитов. К белковым ингибиторам этого процесса относятся также простациклинзависимый макромолекулярный белок, фактор Барнес – Лиана.
Свертывание крови – сложный ферментный процесс, в котором участвует ряд протеолитических ферментов, а также неферментные белковые и фосфолипидные компоненты, резко ускоряющие и усиливающие активацию и действие ферментов (табл. 6).
Условно процесс свертывания крови может быть разделен на две основные фазы:
1) начальную многоступенчатую, приводящую к активации протромбина (фактора II) с превращением его в активный фермент – тромбин;
2) конечную, в которой фибриноген под влиянием тромбина превращается вначале в мономеры фибрина, а затем – в фибрин‑полимер, который стабилизируется активированным фактором XIII.
Свертыванию крови противодействуют первичные (самостоятельно синтезируемые) и вторичные (образующиеся в процессе свертывания и фибринолиза) физиологические антикоагулянты.
Фибриноген – глобулярный гликопротеин, состоящий из двух одинаковых субъединиц. Каждая из субъединиц состоит из трех цепей. Вначале тромбин отщепляет от этой молекулы пептиды А. Появление свободных пептидов А в циркулирующей крови (определяются иммунологически с помощью анти‑А‑сыворотки) служит признаком тромбинемии и используется в качестве «свидетеля» внутрисосудистого свертывания крови (при ДВС‑синдроме, массивных тромбозах).
Общая оценка конечного этапа процесса свертывания проводится с помощью тромбинового теста. Тест имеет большое значение для диагностики многих нарушений свертываемости крови, его результаты важны для правильного толкования показаний всех других коагуляционных проб, поскольку торможение конечного этапа процесса удлиняет время свертывания во всех остальных исследованиях.
Механизмы трансформации протромбина в тромбин.
Согласно современной каскадно‑комплексной теории свертывания крови, активация протромбина (фактора II) является результатом многоступенчатого ферментного процесса, в котором последовательно активируются и взаимодействуют между собой различные факторы свертывания.
Различают два основных механизма запуска процесса свертывания – внешний и внутренний.
Таблица 6. Характеристика факторов свертывания крови

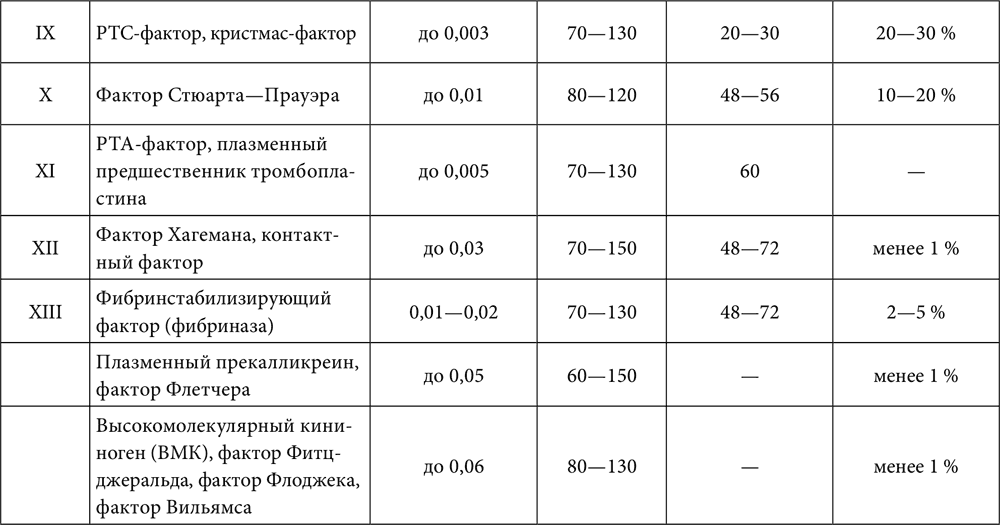
Внешний механизм запускается тканевым тромбопластином, который может попадать в плазму крови из поврежденных (травмы, операции) тканей, стенок сосудов (вырабатывается поврежденным эндотелием при участии активированных тромбоцитов), а также поступать в кровоток с тканевой жидкостью (эмболия околоплодными водами, перитонеально‑венозное шунтирование, различные виды шока). Непосредственно в крови тканевый тромбопластин может продуцироваться активированными моноцитами. В большом количестве тканевый тромбопластин вырабатывается и клетками некоторых злокачественных опухолей (в том числе лейкозными).
Тканевый тромбопластин образует комплекс с ионами кальция и фактором VII, активируя последний, в результате образуется мощный ферментный активатор фактора X.
Внутренний механизм значительно более сложен и важен для расшифровки патогенеза и диагностики наиболее часто встречающихся в клинической практике геморрагических диатезов – гемофилии А и В , ангиогемофилии, или болезни Виллебранда (на их долю приходится большинство всех наследственных геморрагических коагулопатий).
При внутреннем механизме свертывание крови (плазмы) реализуется без участия тканевого тромбопластина. Пусковым фактором этого механизма является фактор XII (Хагемана), активация которого происходит вследствие контакта крови либо с чужеродной поверхностью (стеклом, металлом), либо с субэндотелием (коллагеном) и другими компонетами соединительной ткани, что наблюдается при повреждении стенок кровеносных сосудов (при механических травмах, васкулитах, атеросклерозе). Кроме того, активация фактора XII может осуществляться путем его ферментативного расщепления (калликреином, плазмином или другими протеазами).
Вместе с тем внешний и внутренний механизмы активации не изолированы друг от друга, взаимодействуют между собой. Многие факторы свертывания и фибринолиза синтезируются в печени. Из них факторы II, VII, X и IX, а также антикоагулянты – протеины С и S К ‑витаминозависимы: конечный этап их синтеза (карбоксилирование) нарушается при дефиците витамина К и под влиянием его антагонистов – кумаринов, фенилина. При этом нарушается образование в клетках печени К ‑витаминозависимой карбоксилазы, что лишает факторы свертывания способности к активации.
Физиологические антикоагулянты необходимы для поддержания крови в жидком состоянии и тормозят процессы образования тромбов. Могут быть подразделены на две основные группы:
1) первичные – самостоятельно синтезируемые и постоянно содержащиеся в крови;
2) вторичные – образующиеся при высвобождении активных веществ из клеток (протеолиз) при свертывании крови и фибринолизе.
Среди первичных антикоагулянтов наиболее важны следующие белки‑ингибиторы.
Антитромбин III – универсальный ингибитор почти всех ферментных факторов свертывания. На его долю приходится более 75 % всей антикоагулянтной активности плазмы крови, причем этот же белок является основным плазменным кофактором гепарина. При наследственном или приобретенном (вторичном) снижении уровня антитромбина III возникает тяжелое тромбофилическое состояние, характеризующееся рецидивирующими тромбозами магистральных вен конечностей и внутренних органов, тромбоэмболиями легочной артерии, инфарктами органов. При уровне антитромбина III ниже 30 % больные часто погибают в молодом возрасте от тромбоэмболии, причем гепарин не оказывает на их кровь заметного антикоагулянтного действия. Скрытая наклонность к тромбозам возникает уже при снижении уровня антитромбина III ниже 70–75 %, но в этом случае тромбоэмболии развиваются на фоне дополнительных провоцирующих факторов (беременность и ее токсикозы, послеоперационный период, травмы и значительное физическое напряжение, прием контрацептивных гормональных препаратов и ингибиторов фибринолиза).
Вторичное снижение уровня антитромбина III в плазме крови закономерно развивается при ДВС‑синдроме (диссеминированное внутрисосудистое свертывание – нарушенная свертываемость крови по причине массивного высвобождения из тканей тромбопластических веществ) и массивных тромбозах (вследствие интенсивного расходования на нейтрализацию факторов свертывания), в процессе лечения гепарином, который активирует и ускоряет метаболизм антитромбина III, в раннем послеоперационном периоде, при заболеваниях печени, лечении L ‑аспарагеназой и некоторых других ситуациях. Во всех этих случаях возникает опасность развития вторичных и рикошетных тромбозов.
В связи с этим динамический контроль над уровнем антитромбина III и гепаринорезистентностью плазмы приобретает большое клиническое значение как для оценки степени тромбогенной опасности, так и для своевременной коррекции дефицита этого антикоагулянта трансфузиями свежезамороженной плазмы крови, концентратами антитромбина III, удалением из крови белков острой фазы (плазмаферез).
Протеин С – синтезируемый гепатоцитами К ‑витаминозависимый профермент, активирующийся тромбином (а также трипсином и ядом гадюки Рассела), после чего он приобретает способность расщеплять и инактивировать основные неферментные ускорители процесса свертывания – факторы VIII и V.
Дефицит протеина С имеет значение в клинике. Описана наследственная его форма, при которой у больных с детского или юношеского возраста возникали рецидивирующие тромбозы. Глубокое вторичное угнетение протеина С (вплоть до почти полного исчезновения из крови) наблюдается при остром ДВС‑синдроме (быстрый клиренс активированного тромбином белка из плазмы), респираторном дистресс‑синдроме, тяжелых поражениях печени; менее значительное – в послеоперационном периоде.
Определяются протеин С и все взаимодействующие с ним белки иммунологически с помощью соответствующих специфических антисывороток.
Альфа 2‑макроглобулин – белок, обладающий способностью связывать активированные компоненты свертывающей системы крови и фибринолиза, выключать их из взаимодействия с другими факторами. Генетически обусловленный дефицит этого белка сам по себе не ведет к развитию тромбозов, но в совокупности с другими нарушениями может иметь патогенное значение.
Вторичные физиологические антикоагулянты образуются в процессе свертывания крови и фибринолиза в результате дальнейших ферментных изменений ряда факторов свертывания, в силу чего они после начальной активации утрачивают способность участвовать в свертывании крови и нередко, наоборот, приобретают свойства антикоагулянтов. Образующийся при свертывании фибрин адсорбирует и инактивирует большие количества тромбина, то есть является как фактором свертывания, так и антикоагулянтом (антитромбин I). Продукты ферментного расщепления фибриногена/фибрина плазмином (фибринолизином) ингибируют как агрегацию тромбоцитов, так и образование фибрина.
Патологические антикоагулянты отсутствуют в крови в нормальных условиях, но могут появляться (нередко в значительном количестве) при различных иммунных нарушениях, реже – без видимой причины. К ним относятся антитела к факторам свертывания крови, чаще всего к VIII и V (обычно появляются при гемофилии, после родов и массивных гемотрансфузий), иммунные комплексы – волчаночный антикоагулянт, нарушающий начальные этапы свертывания, антитромбин V, нередко выявляющийся при ревматоидном артрите и других заболеваниях.
Ферментная система, вызывающая асимметричное расщепление фибрина (фибриногена) на все более и более мелкие фрагменты, носит название фибринолитической, или плазминовой. Главным компонентом этой системы является фермент плазмин (фибринолизин), содержащийся в плазме крови в виде профермента (плазминогена) в количестве около 0,2 г/л. Активный плазмин быстро блокируется антиплазминами и выводится из кровотока. Вследствие этого после введения стрептокиназы или урокиназы уровень плазминогена в крови очень быстро и сильно снижается (при больших терапевтических дозах – почти до нуля), а затем, если прекращена дальнейшая его активация, в течение 18–28 ч восстанавливается. Эта способность активаторов плазминогена быстро истощать запасы указанного профермента должна учитываться при лечении тромбозов.
Активация фибринолиза в организме, как и активация свертывания крови, может осуществляться как по внешнему, так и по внутреннему механизму.
Внутренний механизм может запускаться теми же факторами, что и свертывание крови, то есть комплексом XIIа или XIII с калликреином и высокомолекулярным кининогеном. Внешняя активация фибринолиза осуществляется в основном синтезируемым в эндотелии сосудов так называемым белковым активатором тканевого типа. Интенсивный выброс его происходит при всех видах закупорки сосудов, в том числе и при сжатии сосудов манжетой (на этом основана манжеточная проба), при различных физических нагрузках, под влиянием вазоактивных веществ и лекарственных средств – никотиновой кислоты, адреналина и норадреналина, аналогов вазопрессина. Мощные активаторы плазминогена содержатся также в клетках крови – эритроцитах, тромбоцитах, лейкоцитах. Кроме того, гранулоциты и макрофаги могут секретировать внутриклеточные киназы, которые сами по себе, то есть без участия плазмина, расщепляют фибрин.
Активаторы плазминогена содержатся также в различных тканях, секретах и экскретах – моче, молоке, желчи, слюне. Большинство из этих активаторов идентичны сосудистому эндотелиальному. Очень большое количество активатора продуцируют и клетки некоторых опухолей (меланома).
Урокиназа, образующаяся в почках и в основной массе выделяющаяся с мочой, отличается от других активаторов. В кровь она попадает в небольшом количестве, поэтому урокиназная активация составляет лишь около 15 % от общей фибринолитической активности плазмы. Урокиназа широко используется в качестве лечебного препарата при необходимости растворения тромбов.
Из чужеродных активаторов фибринолиза в терапии тромбоэмболии чаще всего применяют различные виды стрептокиназы, реже – активаторы фибринолиза из других бактерий и грибов.
Фибринолиз ингибируется антиплазминами, из которых наиболее важен относящийся к α2‑глобулинам быстродействующий антиплазмин, содержащийся в плазме в количестве 0,07 г/л и способный нейтрализовать около 2/3 всего плазмина, образующегося при полной активации плазминогена крови. Не менее важную роль играет быстродействующий антиактиватор, ингибирующий активатор фибринолиза тканевого типа (эндотелиальный активатор плазминогена).
Плазминовая система адаптирована к лизису фибрина в тромбах и возникает лишь при очень сильной ее активности (например, при внутривенном введении стрептокиназы или урокиназы). Активный плазмин вызывает последовательное асимметричное расщепление фибриногена/ фибрина. Вначале от его цепей отщепляются низкомолекулярные фрагменты, затем – крупномолекулярные. В норме содержание в сыворотке ПДФ (продуктов деградации фибриногена/фибрина) составляет менее 0,05 г/л.
Повышенное содержание в крови ПДФ свидетельствует о происходящем в ней активном фибринолизе. Первичное повышение фибринолитической активности (без предшествующего свертывания крови) – крайне редкое явление. Оно зарегистрировано в единичных случаях наследственного дефицита α2‑антиплазмина, а из приобретенных форм – при меланоме, вырабатывающей большое количество активатора плазминогена тканевого типа. Предполагается также возможность активации фибринолиза без предварительного свертывания при тяжелых поражениях печени вследствие снижения синтеза в ней α2‑антиплазмина. Однако, поскольку при таких поражениях развивается, как правило, ДВС‑синдром, указанную активацию фибринолиза следует связывать с предварительным свертыванием крови.
В подавляющем же большинстве клинических ситуаций фибринолиз вторичен и связан либо с ДВС‑синдромом, либо с массивными тромбоэмболиями, а также с интенсивной локальной гемокоагуляцией в органах или ангиомах, поэтому повышение уровня ПДФ расценивается как показатель внутрисосудистой гемокоагуляции и вторичной активации фибринолиза.
Повышение уровня ПДФ в сочетании со снижением содержания в плазме крови плазминогена и его активатора – закономерные признаки интенсивного внутрисосудистого свертывания крови. Антиплазминовая активность при этом может как повышаться, так и оставаться нормальной или умеренно снижаться.
Вторым проявлением внутрисосудистого свертывания крови является циркуляция в кровотоке комплекса плазмин – антиплазмин (как и комплекса тромбин – антитромбин). Образование таких комплексов ингибиторов с активированными ферментами сопровождается появлением новых антигенных маркеров, которые отсутствуют по отдельности в ферментах (плазмина, тромбина) и их ингибиторах. Выявление этих неоантигенов используется в диагностике ДВС‑синдрома и других видов внутрисосудистого свертывания крови.
Продукты, образующиеся в результате фибринолиза, биологически активны и оказывают влияние на проницаемость и тонус кровеносных сосудов, свойства эндотелия, ингибируют агрегацию тромбоцитов и самосборку мономеров фибрина (то есть действуют как антиагреганты и антикоагулянты), тормозят фибринолиз, оказывают активирующее влияние на систему мононуклеарных фагоцитов, поглощаются этой системой и блокируют ее, взаимодействуют с системой комплемента.
При исследовании системы гемостаза нужно учитывать следующее:
1) исследования многих параметров должны выполняться в очень короткий срок – в течение первого часа после извлечения крови из вены;
2) нарушения в системе гемостаза часто требуют экспресс‑диагностики;
3) при перевозке, встряхивании крови и гемолизе результаты ряда исследований существенно искажаются. Некоторые исследования должны выполняться непосредственно в отделениях – в операционных, у постели больного.
Для получения более точных и достоверных результатов необходимо строго соблюдать правила получения крови из вены (без жгута и массажа), ее стабилизации (силиконирование посуды, правильное соотношение крови и стабилизирующего раствора), временные интервалы между получением крови и ее исследованием.
Исследование сосудисто‑тромбоцитарного гемостаза .
Нарушения в этом звене гемостаза могут протекать с наклонностью к геморрагиям или к тромбозам, в зависимости от чего подбираются методы исследования. Кроме того, все методы исследования тромбоцитарного гемостаза (табл. 7) подразделяются на основные и дополнительные, или тесты второго ряда, которые применяют лишь в том случае, если с помощью основных тестов выявлены какие‑либо нарушения. К основным (базисным) относятся следующие тесты.
Пробы на резистентность (ломкость) капилляров – манжеточная, баночная, ангиорезистометрия. Из этих тестов наиболее доступна и вместе с тем достаточно информативна проба Кончаловского –Румпеля –Лееде . Оценка производится по числу и размеру геморрагий, образовавшихся на верхней части ладонной поверхности предплечья (в круге диаметром 5 см) после 5‑минутного сдавливания плеча манжетой при давлении 90–100 мм рт. ст. Результаты учитывают через 5 мин после снятия манжеты. Число петехий (точечных кровоизлеяний) более 10 указывает на повышенную ломкость микрососудов, что часто связано с тромбоцитопенией или нарушением ангиотрофической функции тромбоцитов. Учитывается также возникновение геморрагий и под самой манжетой.
Симптом щипка Кожевникова – при нарушении эластичности капилляров на месте щипка кожи под ключицей появляются петехии или кровоподтеки. Повышенная ломкость капилляров наблюдается при сепсисе, сыпном тифе, дефиците витамина С , эндокринных нарушениях, ДВС‑синдроме, передозировке антикоагулянтов, дефиците факторов протромбинового комплекса.
Таблица 7. Методы исследования сосудисто‑тромбоцитарного гемостаза
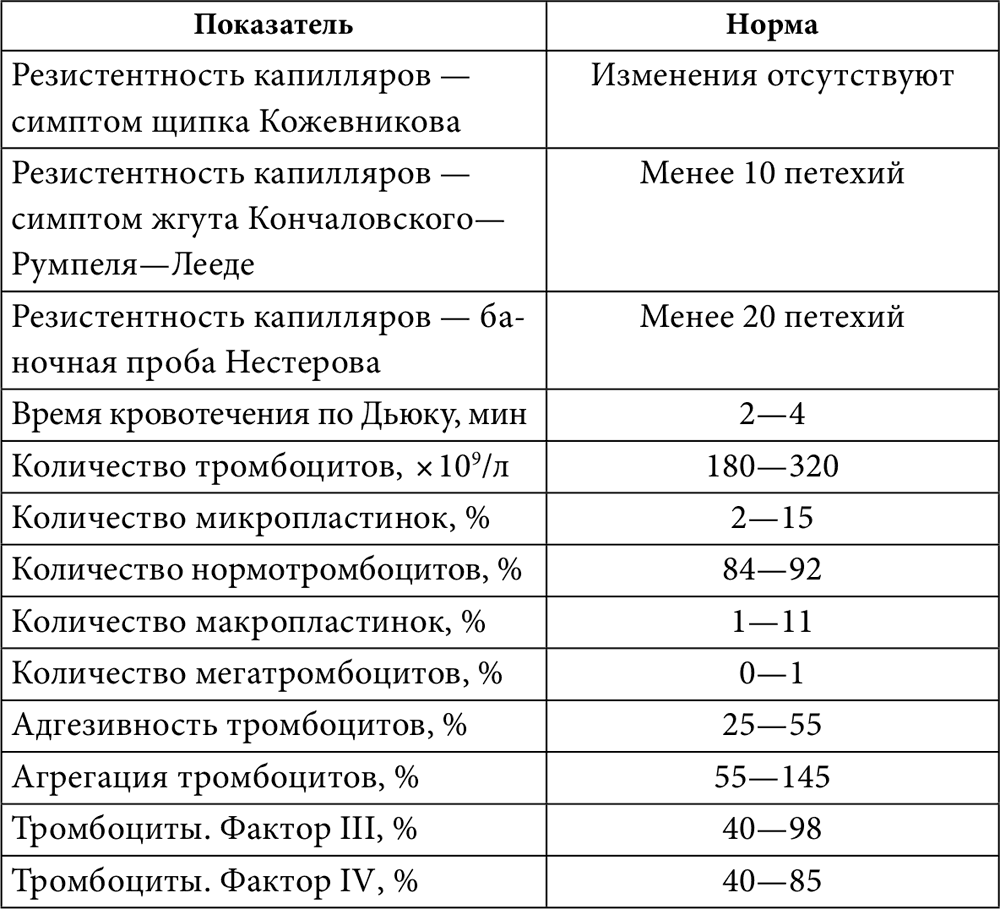
Показания тестов на длительность кровотечения , отклоняющиеся от нормы, свидетельствуют о выраженном нарушении тромбоцитарно‑сосудистого гемостаза, однако при нормальных результатах этих проб не исключается наличие нерезко выраженных тромбоцитопатий. Повышенное время кровотечения наблюдается при иммунных нарушениях, аллергии, инфекционных заболеваниях, болезнях крови, циррозе печени, ДВС‑синдроме, кровотечениях с гипофибриногенемией, действии гепарина, дезагрегантов и салицилатов, дефиците витамина С .
Пониженное время кровотечения наблюдается при повышенной спастической способности периферических капилляров, а также вследствие технической ошибки.
Подсчет количества тромбоцитов в крови – важнейший способ диагностики тромбоцитопений и тромбоцитопатий, протекающих с постоянным или периодическим уменьшением количества этих клеток (аномалии Бернара – Сулье, Мея – Хегглина).
Изучение размеров тромбоцитов в мазке (тромбоцитометрия) позволяет составить предварительное суждение о разных популяциях этих клеток в крови исследуемого и получить информацию о ряде их аномалий, а также о насыщении тромбоцитов гранулами. При некоторых тромбоцитопатиях (синдроме Вискотта – Олдрича) в крови преобладают очень малые тромбоциты (до 2 мкм в диаметре), при других (аномалии Бернара – Сулье, Мея – Хегглина) – гигантские формы (до 8 мкм и более). При ряде тромбоцитопатий эти клетки бедны гранулами, при других – нарушена централизация гранул при распластывании тромбоцитов на стекле, что свидетельствует о нарушении реакции высвобождения гранул и содержащихся в них веществ, необходимых для осуществления гемостаза. Все эти свойства, а также способность тромбоцитов к распластыванию и образованию отростков и оценка структуры этих клеток могут быть изучены как с помощью обычной и сканирующей электронной микроскопии, так и с помощью интерференционной оптики.
Ретракция кровяного сгустка закономерно нарушается при выраженной тромбоцитопении (менее 30–40 × 109/л) и при некоторых формах качественной неполноценности тромбоцитов, чаще всего – при тромбоцитастении Гланцманна, уремической тромбоцитопатии.
Исследование адгезивно‑агрегационной функции тромбоцитов – важнейшее звено лабораторной диагностики большинства тромбоцитопатий.
Графическая регистрация процесса агрегации под влиянием агрегирующих агентов – весьма информативный метод функционального исследования тромбоцитов. При графической регистрации определяют не только время наступления агрегации, но и ее интенсивность (по величине отклонения кривой и площади агрегатограммы), наличие первой и второй волн агрегации – при использовании малых концентраций адреналина и АДФ (вторая волна характеризует реакцию высвобождения), а также патологической дезагрегации.
Весьма важным является визуальное или графическое исследование агрегации тромбоцитов под влиянием ристомицина . Нарушается этот вид агрегации при одном из наиболее распространенных геморрагических диатезов – ангиогемофилии (болезни Виллебранда), а также при аномалии тромбоцитов Бернара – Сулье и при некоторых приобретенных видах угнетения синтеза фактора Виллебранда (иммунная ингибиция его, уремия).
Метод важен как для диагностики ангиогемофилии и вторичного угнетения синтеза этого фактора, так и для оценки тяжести поражения эндотелия (васкулиты, атеросклероз и др.) и наклонности к тромбозам, при которых содержание фактора Виллебранда в крови часто значительно повышается. Уровень фактора Виллебранда свидетельствует о способности эндотелия синтезировать его (снижен при ангиогемофилии) и о степени поражения эндотелия при васкулитах, атеросклерозе и других заболеваниях, протекающих с поражением внутренней оболочки сосудов.
При обследовании больных с тромбоэмболиями или повышенной склонностью к тромбозу и ишемии в число основных методов включают тесты, отражающие спонтанную агрегацию тромбоцитов , то есть возникающую в цельной крови или в плазме крови без добавления агрегирующих агентов.
В случае выявления при применении основных тестов нарушений, характеризующих тромбоцитарный гемостаз, по мере необходимости выполняют дополнительные исследования. Из них наиболее важны следующие.
Определение антитромбоцитарных антител путем иммунофлюоресцентного исследования в суспензии тромбоцитов иммуноглобулина, связанного с этими клетками (метод Диксона). Этот метод позволяет дифференцировать иммунные и неиммунные тромбоцитопении.
Определение продолжительности жизни меченых аутологичных тромбоцитов позволяет разграничивать тромбоцитопении с нормальной продолжительностью жизни тромбоцитов в циркуляции (около 9 суток) и формы заболевания с укороченной продолжительностью жизни этих клеток. Первые чаще всего связаны со снижением продукции тромбоцитов в костном мозге, вторые – с их ускоренной гибелью, либо с действием антитромбоцитарных антител (при аутоиммунных тромбоцитопениях продолжительность жизни тромбоцитов сокращается до нескольких часов), либо с интенсивной убылью этих клеток в агрегаты и тромбы при ДВС‑синдроме или массивных тромбозах (тромбоцитопении потребления).
Количественное определение содержания в плазме крови до и после агрегации ряда тромбоцитарных факторов – этот метод важен для идентификации ряда тромбоцитопатий (нарушении сохранности гранул и их компонентов, пареза реакции освобождения этих компонентов, повышения содержания их в плазме крови вследствие интенсивной внутрисосудистой адгезии и агрегации тромбоцитов).
Методы исследования свертывающей системы крови.
Данные методы подразделяются на следующие группы:
1) ориентировочные (общие), дающие представление о состоянии коагуляционного каскада в целом и отдельных его этапов;
2) дифференцирующие дефицит отдельных факторов – коррекционные коагуляционные тесты;
3) количественного определения отдельных компонентов системы по их функциональной активности (коагуляционные пробы, исследования на хромогенных и других субстратах) и/или по иммунологическим маркерам;
4) выявления внутрисосудистой активации процесса свертывания крови и фибринолиза по функциональным признакам или молекулярным маркерам такой активации.
Таким образом, при оценке состояния свертывающей системы крови (табл. 8–10) используются как собственно коагуляционные методики (лабораторные и инструментальные), составляющие основу диагностического процесса, так и иммунологические, радионуклидные и другие виды исследования. При этом во многих случаях компоненты системы могут определяться как по функциональной активности, так и иммунологически – по содержанию соответствующего антигена в крови. Параллельное использование таких методик позволяет дифференцировать формы патологии, связанные с отсутствием синтеза соответствующего фактора свертывания и формы, при которых молекула фактора синтезируется, но она аномальна и функционально неполноценна.
Определение времени свертывания крови (предпочтительнее методика Ли – Уайта) – давно применяющийся быстровыполнимый (непосредственно у постели больного) ориентировочный тест, позволяющий выявлять значительные нарушения свертываемости крови, связанные с дефицитом факторов гемокоагуляции (кроме фактора VII) или с действием антикоагулянтов и фибринолитиков. Тест сравнительно низкочувствительный, показатели его нарушаются лишь при выраженном снижении содержания в плазме факторов свертывания (ниже 4–5 %), в связи с чем непригоден для выявления легких форм гемофилии А и В , а также нарушений свертываемости крови при ангиогемофилии, дефиците фактора XI, прекалликреина и высокомолекулярного кининогена. По этим причинам тест не может использоваться для предоперационного обследования больных: при нормальных показателях теста (5–10 мин) возможно возникновение профузных послеоперационных кровотечений.
Силиконовое время плазмы – это время рекальцификации плазмы, полученной в условиях силиконирования игл, пробирок, пипеток, то есть при минимальной контактной активации. Нормативные показатели зависят от используемого силикона и определяются исследованием крови здоровых людей для каждого его образца отдельно.
Индекс контактной активации – это соотношение времени свертывания крови по Ли – Уайту в силиконовой и несиликоновой пробирках. Повышенная контактная активация наблюдается при нарушении функций печени, недостатке факторов Хагемана, Флетчера и Фитцджеральда, избытке антикоагулянтов. Пониженная контактная активация наблюдается при гиперкоагуляционной фазе ДВС‑синдрома.
Время рекальцификации плазмы – это время свертывания крови после добавления к ней определенного количества хлорида кальция. Нестандартизированный низкочувствительный тест. Повышенный показатель (время удлинено) наблюдается при тромбоцитопении, наличии антикоагулянтов, недостатке факторов свертывания. Пониженный показатель (время укорочено) наблюдается при тромбозе, ДВС‑синдроме, эритроцитозе.
Активированное парциальное/частичное тромбопластиновое время плазмы (каолин‑кефалиновый тест) – высокочувствительный метод, выявляющий нарушения свертываемости крови при запуске процесса по внутреннему механизму. Избирательно чувствителен к дефициту плазменных факторов свертывания. Нормативные показатели зависят от используемых образцов кефалина (эритрофосфатида), в большинстве случаев составляют 37–50 с (оптимально – 37–45 с). Повышенный показатель (время удлинено) наблюдается при ДВС‑синдроме, циррозе и жировой дистрофии печени, гемофилии, наличии антикоагулянтов. Пониженный показатель (время укорочено) наблюдается при повышенной свертываемости крови, попадании тканевого тромбопластина в пробирку (нарушение техники взятия крови).
Каолиновое время плазмы – тест, сходный с предыдущим, но без добавления в плазму кефалина, в результате чего он чувствителен не только к дефициту плазменных факторов свертывания, но и к недостатку тромбоцитов и фактора 3 тромбоцитов. Ориентировочная оценка активности этого фактора может быть проведена путем сравнения каолинового времени плазмы исследуемого с высоким и низким содержанием тромбоцитов (норма – 57–70 с).
Таблица 8. Показатели протромбина

Протромбиновое (тромбопластиновое) время плазмы (время Квика, протромбиновый индекс) характеризует скорость свертывания рекальцифицированной плазмы крови при запуске процесса по внешнему механизму, то есть при добавлении тромбопластина мозга человека (или кролика). При нормальном протромбиновом времени плазмы тест позволяет выявить изолированный или совокупный дефицит факторов протромбинового комплекса – VII, X, V и II, из которых три фактора (VII, X и II) К ‑витаминозависимы и их активность снижается под влиянием антикоагулянтов непрямого действия (норма – 90–110 %). Увеличенный протромбиновый индекс наблюдается при недостатке витамина К , наличии антикоагулянтов, хроническом панкреатите, дисфибриногенемии, врожденной гипопротромбинемии, поздних стадиях ДВС‑синдрома, хронических заболеваниях печени, механической желтухе. Уменьшенный протромбиновый индекс наблюдается при беременности, родах, травмах, тромбозе, некрозе, злокачественных новообразованиях, состоянии гиперкоагуляции.
Тромбиновое время плазмы , то есть время свертывания цитратной плазмы при добавлении к ней тромбина стандартной активности, является основным тестом для оценки конечного этапа свертывания крови (свертывание за 30–35 с). Увеличенное тромбиновое время наблюдается при гепатите, ДВС‑синдроме, гипофибриногенемии, циррозе печени, наличии ингибиторов свертывания крови. Уменьшенное тромбиновое время наблюдается при гиперфибриногенемии, парапротеинемии. Плазма не свертывается при наличии ингибиторов свертывания крови, моноклональных гаммапатиях, гипофибриногенемии.
Аутокоагуляционный тест (АКТ) – высокочувствительный двухступенчатый тест, характеризует процесс свертывания крови при запуске его по внутреннему механизму.
Микрокоагуляционный тест (МКТ) используется в педиатрии, поскольку на его проведение необходимо всего лишь 0,1–0,2 мл крови, в отличие от АКТ (20 мл крови).
Коагуляционная активность в АКТ и МКТ вначале нарастает и у здоровых людей обычно достигает максимума к 10‑й минуте инкубации кровь‑кальциевой смеси (ККС), когда свертывание субстратной плазмы происходит за 10±1 с. Затем коагуляционная активность ККС начинает снижаться, что свидетельствует об инактивации образовавшегося в ней тромбина. При гемофилиях, действии гепарина и других нарушениях свертываемости коагулирующая активность ККС резко снижается, а максимум перемещается с 10‑й минуты на более поздний срок. При гиперкоагуляции наблюдается более раннее и более значительное нарастание тромбиновой активности в ККС.
Таблица 9. Коагулограмма


Таблица 10. Основные типы коагулограмм


1‑й тип коагулограммы (снижение антикоагулянтных свойств крови) наблюдается при состояниях после хирургического вмешательства (особенно у людей старше 35 лет и у больных с гнойными осложнениями), состояниях после родов у женщин с гипертонией или флеботромбозом.
2‑й тип коагулограммы (гиперкоагуляция) – при тромбоэмболии легочной артерии, инфаркте миокарда, гиперкоагуляционной фазе ДВС‑синдрома, остром артериальном тромбозе нижних конечностей.
3‑й тип коагулограммы – при резкой депрессии фибринолиза, развивающейся тромбонемии на фоне гиперфибриногенемии.
4‑й тип коагулограммы – при гиперкоагуляционной фазе ДВС‑синдрома с признаками гиперкоагуляции в первой фазе.
5‑й тип коагулограммы – при острой приобретенной гипофибриногенемии с расстройством фаз свертывания при ДВС‑синдроме.
6‑й тип коагулограммы (гипокоагуляция) – при гемофилии, лечении гепарином.
7‑й тип коагулограммы – при гиповитаминозе К , лечении непрямыми антикоагулянтами, врожденном дефиците факторов свертывания с поражением паренхимы печени.
8‑й тип коагулограммы – при шоковых состояниях, заболеваниях крови, лечении фибринолитическими препаратами.
9‑й тип коагулограммы – при тромбоцитопении, тромбоцитопатии.
Исследование функциональной активности факторов свертывания и компонентов калликреин‑кининовой и фибринолитической систем. Методы основаны на исследовании активности протеолитических ферментов и их ингибиторов, участвующих в свертывании крови, фибринолизе и образовании кининов, по интенсивности и скорости расщепления специфически чувствительных к этим ферментам пептидов, при деградации которых высвобождается красящий агент.
Иммунологическое определение компонентов системы гемостаза выполняется методами иммунопреципитации, иммуноэлектрофореза, радиоиммунологическими и другими с соответствующими антисыворотками. При этом оценивается содержание в плазме крови антигена того или иного фактора свертывания (или его фрагментов), а не функциональная активность, которая может быть резко сниженной при нормальном содержании антигена в плазме. Такая ситуация характерна для всех случаев, когда в организме синтезируются аномальные (функционально неполноценные) факторы, сохраняющие свою антигенность, но лишенные способности участвовать в гемостазе.
Определение основных физиологических антикоагулянтов . Наиболее важное значение имеет определение активности основного физиологического антикоагулянта – антитромбина III. Его снижение может быть генетически обусловленным (первичная тромбофилия) либо вторичным вследствие интенсивного потребления (ДВС‑синдром, массивные тромбозы) или ускоренного метаболизма (лечение гепарином, L ‑аспарагиназой, синтетическими контрацептивными средствами) и блокады иммунными комплексами, парапротеинами, фибронектином, белками острой фазы. В любом случае снижение активности антитромбина III ниже 60–65 % поддерживает внутрисосудистое свертывание крови, делает менее выраженным антикоагулянтное действие гепарина. Вместе с тем очень часто между уровнем антитромбина III и снижением чувствительности к гепарину нет закономерного соответствия. При этом обычно ослабление антикоагулянтного действия гепарина существенно преобладает над степенью снижения активности антитромбина III.
Исследование фибринолиза. Важно выявление как повышения фибринолитической активности крови, так и ее снижения, что может быть связано либо с интенсивным потреблением плазминогена и его активаторов при их активации и фиксации в сгустках и тромбах, либо с повышением антиплазминовой и антиактиваторной активности плазмы (табл. 11).
Таблица 11. Фибриноген и фибрин

Повышенное значение фибриногена наблюдается при воспалительных и некротических процессах, лихорадке, инфекционных заболеваниях, хирургических вмешательствах, диффузных болезнях соединительной ткани, нефрите, ожогах, травмах, лучевой болезни, пароксизмальной ночной гемоглобинурии, уремическом синдроме, инфаркте миокарда, злокачественных опухолях. Физиологическое повышение значения фибриногена наблюдается при беременности и во время менструации. Пониженное значение фибриногена наблюдается при состояниях после кровотечения, циррозе печени, ожогах, отравлении гепатотропными ядами, врожденном дефиците фибриногена, цинге, тяжелом токсикозе беременных, ДВС‑синдроме, травмах, эмболии околоплодными водами, действии фенобарбитала, урокиназы и стрептокиназы, шоковых состояниях, кахексии, укусе змеи.
Исследование фибринолитической активности эуглобулиновой фракции плазмы. Это один из важнейших базисных тестов. С помощью эуглобулиновых тестов оценивается содержание в плазме крови плазминогена и его активаторов. При получении крови в условиях основного обмена, то есть утром натощак, до подъема больного с постели, тканевых активаторов плазминогена в крови почти нет. Следовательно, в таких условиях определяется в основном состояние внутреннего (собственно кровяного) процесса активации плазминогена. Удлинение времени фибринолитической активности наблюдается при геморрагическом васкулите, апластических процессах кроветворения, тромбозе. Сокращение времени фибринолитической активности наблюдается при ацидозе, ДВС‑синдроме, циррозе печени, шоковых и стрессовых состояниях, гипоксии, сильных физических нагрузках, хирургических операциях на легких, матке, простате, мозге, при осложнениях после родов.
Способность эндотелия сосудов выделять в кровь внешний активатор фибринолиза (активатор тканевого типа – АТТ) оценивается по ускорению эуглобулинового лизиса после сжатия сосудов манжетой от аппарата для измерения артериального давления, либо после дозированной физической нагрузки на велоэргометре, либо при фармакологической стимуляции (производными вазопрессина – десмопрессином или адиуретином). В этих случаях второй раз кровь на исследование берется из пережатых сосудов до снятия манжеты. С помощью таких проб может быть изучено влияние компрессии не только на фибринолиз, но и на другие антитромботические свойства стенок сосудов (антикоагулянтные, антиагрегационные).
Нагрузочные пробы стандартизируются таким образом, чтобы в норме эуглобулиновый лизис ускорялся в 2 раза и более (выполнение исследования не в условиях основного обмена приводит к очень большим случайным ошибкам, поэтому до начала исследования больной утром не должен вставать с постели, венопункция должна проводиться в палате). Ослабление реакции на компрессию или нагрузку свидетельствует о недостаточной реактивности фибринолитической системы и повышенном тромбогенном риске, что подтверждено рядом исследований.
Ретракция кровяного сгустка – самопроизвольное отделение сыворотки крови от ее сгустка при отстаивании. Повышенный показатель ретракции кровяного сгустка наблюдается при анемии, гиперфибриногенемии. Пониженный показатель ретракции кровяного сгустка наблюдается при тромбоцитопении, геморрагической алейкии Франка, эритремии, увеличении гематокрита, болезни Верльгофа.
Как и при исследовании свертывающей системы крови, эти данные могут быть существенно дополнены иммунологическим определением компонентов системы фибринолиза и продуктов расщепления фибриногена и фибрина.
Методы выявления маркеров («свидетелей») внутрисосудистого свертывания крови и фибринолиза . В процессе внутрисосудистого свертывания крови и сопряженного с ним интенсивного фибринолиза происходит, с одной стороны, потребление и более или менее выраженное снижение уровня в крови ряда компонентов системы гемостаза, а с другой – появление их частей, осколков и метаболитов, которые в нормальной плазме крови отсутствуют или содержатся в небольшом количестве. Выявление таких маркеров активации внутрисосудистого свертывания и фибринолиза имеет важное диагностическое значение при ДВС‑синдромах, тромбоэмболических заболеваниях и микротромбоваскулитах различного генеза (инфекционного, иммунного, опухолевого).
К маркерам потребления и активации тромбоцитарного звена гемостаза относятся тромбоцитопения, повышение уровня в плазме компонентов гранул – антигепаринового фактора тромбоцитов, а также сохранение в циркуляции функционально менее активных и хуже агрегирующих кровяных пластинок.
Основные маркеры повреждения и функциональной неполноценности эндотелия сосудов – повышение уровня в плазме крови фактора Виллебранда, ослабление реакции эуглобулинового лизиса при компрессии сосудов манжетой, физической нагрузке или введении аналогов вазопрессина.
Гиперкоагуляция может служить признаком активации свертывающей системы крови. Выявляется она с помощью общих коагуляционных тестов и инструментальных методов исследования (тромбоэластографии), а в клинике – на основании трудности получения крови из вены: легкого тромбирования как самого сосуда, так и игл.
Этаноловый тест специфичен, дает положительный результат при ДВС, тромбозах и других видах тромбинемии. В III стадии ДВС на фоне выраженной гипофибриногенемии (менее 0,5–0,7 г/л), как и при гепаринизации, этаноловый тест часто становится отрицательным.
Ортофенантролиновый тест (ОФТ) высокоинформативен, позволяет проводить качественное и количественное определение растворимых фибрин‑мономерных комплексов (РФМК) в плазме с небольшим количеством тромбоцитов. Полученные результаты (в секундах) переводят с помощью калибровочной кривой в количество РФМК. В норме хлопья появляются через 120 с; чем быстрее они появляются, тем больше РФМК содержится в исследуемой плазме.
Помимо вышеуказанных тестов может применяться тест склеивания стафилококков (ТСС, стафилококковый клампинг‑тест) – простой и высокоинформативный метод выявления в сыворотке РФМК и ранних продуктов фибринолиза (фрагментов X, а также связанного с ними заблокированного фибриногена). У здоровых людей содержание РФМК и ранних ПДФ в сыворотке не превышает 0,002 г/л (2 мкг/мл). Пригоден для экспресс‑диагностики активации системы гемостаза при ДВС‑синдромах, тромбоэмболиях и пр.
Определение содержания в плазме крови активированного фактора XIII как показателя циркуляции в крови тромбина . Фактор XIII, активируемый тромбином в присутствии ионов кальция, расщепляется на цепь А, обладающую фибринстабилизирующей активностью, и инертную цепь S .
Выявление активации протромбина . При активации протромбина фактором XIII происходит отщепление от субстрата одного из фрагментов, определяемого иммунологически. Нарастание содержания последнего в плазме свидетельствует об активации системы свертывания крови.
Выявление клеточных маркеров активации внутрисосудистого свертывания крови . При ДВС‑синдроме и других видах блокады микроциркуляции в мелких сосудах эритроциты подвергаются травмированию, в связи с чем в мазках крови увеличивается число фрагментированных клеток (более 7–10 %).
Выявление снижения уровня в плазме крови (потребления) компонентов свертывающей, фибринолитической и калликреин‑кининовой систем . При остром и подостром ДВС‑синдроме отмечаются усиленные потребление и метаболизм ряда компонентов системы гемостаза, и поэтому уровень их в плазме существенно снижается. Особенно выражено подавление факторов VIII, V, антитромбина III, белков С и S , фибронектина, прекалликреина, высокомолекулярного кининогена, плазминогена. Определение некоторых из этих параметров имеет значение не столько для диагностики, сколько для оценки остроты процесса и эффективности заместительной терапии. Уровень фактора I (фибриногена) также часто снижается, что, однако, маскируется исходно повышенным содержанием его в плазме при инфекционных и иммунных заболеваниях, токсикозах беременности и других видах патологии.
Наличие продуктов деградации фибриногена наблюдается при ДВС‑синдроме, болезнях печени, тромбозе, состояниях после хирургического вмешательства, лейкозе, злокачественных опухолях, почечной недостаточности, инфаркте миокарда, легочной эмболии, лечении фибринолитическими препаратами.
Выявление неоантигенов . В процессе активации факторов свертывания и фибринолиза и последующего образования их комплексов с физиологическими антагонистами возникают новые антигенные маркеры, отсутствующие отдельно в составных частях этих пар. Так, например, комплекс тромбин – антитромбин III образует антиген, не свойственный отдельно ни тромбину, ни антитромбину III. Точно так же образуется неоантиген в парном соединении плазмин – антиплазмин и т. д. При наличии антисывороток к этим неоантигенам легко установить присутствие в крови активированных ключевых ферментов свертывания крови (тромбина) и фибринолиза (плазмина).
Наблюдение за маркерами внутрисосудистого свертывания крови имеет значение для правильной оценки динамики патологического процесса, степени эффективности и достаточности проводимой терапии.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ