3. Значение эндофитов для симбиотрофнои азотфиксации растений
Возможность обогащения почвы азотом за счет деятельности грибов в микоризе всегда интересовала нас. О том, что вопрос этот решается положительно, мы доложили на специальном совещании по азотфиксации в Киеве в 1968 г. (Гельцер, 1968 а).
Широко распространенное прежде мнение об отсутствии эндофитов внутри клубеньков бобовых растений не соответствует действительности. При предварительной мацерации крупных розовых клубеньков клевера можно наблюдать под микроскопом их везикулы в верхней зоне клубенька. На рис.21 при увеличении в 300 и 600 раз видны хорошо окрашенные везикулы. Применявшийся в нашей лаборатории метод выделения чистых культур эндофитов дал возможность получить их из поверхностно стерильных крупных клубеньков многих бобовых растений, таких как клевер, бобы, люпин, горох, вика, что дает возможность утверждать наличие в них двух симбионтных организмов — гриба и бактерии.

Рис. 21. Везикулы эндофитов в клубеньке клевера (ув, 300 и 600)
Отличительной особенностью чистых культур эндофитов, выделенных из клубеньков клевера, является синтез красного пигмента, который окрашивает клубенек в розовый цвет. В. Стеварт (Stevarl, 1966), изучая процесс азотфиксации а клубеньках бобовых растений с 15N, установил его только у окрашенных в розовый цвет крупных клубеньков, тогда как мелкие, белые клубеньки азотфиксацией не обладали. Правильность этого вывода была подтверждена многими микробиологами, которые выделяли из розовых клубеньков наиболее активные расы клубеньковых бактерий для приготовления нитрагина.
Хотя сама по себе розовая окраска существенного значения не имеет, она служит показателем наличия в клубеньках клевера симбионтных грибов, так как эндофиты этого растения синтезируют красный пигмент. Мы уже указывали, что эндофиты из женьшеня и мать–и–мачехи, синтезирующие черный пигмент, который не переходит в раствор, также активизируют деятельность клубеньковых бактерий, как и эндофиты из облепихи, синтезирующие красно–рыжий пигмент.
В лабораторных и полевых опытах при использовании чистых культур эндофитов, выделенных из сильно микотрофных женьшеня, мать–и–мачехи и облепихи, было установлено положительное действие продуктов их синтеза на размножение (табл. 3) и вирулентность клубеньковых бактерий.

В некоторых опытах, посвященных изучению стимулирующего действия эндофитов на размножение клубеньковых бактерий, было установлено увеличение их массы в 100-литровом реакторе на 20 и 40 г.
Влияние симбионтных грибов на вирулентность клубеньковых бактерий было определено в стерильном опыте в широких пробирках на агаровых средах. В контрольных трех пробирках семена клевера заражались чистой культурой клубеньковых бактерий, а в опытных к ней добавлялось- несколько капель разбавленного ростового препарата эндофитов. После 2 мес. роста клевера на корнях в контроле было обнаружено по 0,45 мелких клубенька в среднем на растение, тогда как в опытных вариантах — по 4,25, т. е. в 10 раз больше. Помимо того, следует отметить и лучшее развитие последних.
Краткосрочный полевой опыт на эту тему был заложен во ВНИИ кормов. Здесь контрольные семена клевера обрабатывали только клубеньковыми бактериями, а опытные — дополнительно и ростовым препаратом Симбионт 1. После 45 дней роста клевера в обоих вариантах были подсчитаны клубеньки на корнях 80 растений, взятых с двух участков поля. При этом с каждого участка брали по 20 контрольных и 20 опытных растений. На первом участке в контроле насчитывалось 445 клубеньков, в опытном варианте — 740, на втором — соответственно 677 и 1083, а в среднем 1122 и 1823 клубенька. Таким образом, применение препарата Симбионт 1 позволило увеличить количество клубеньков на 63%.
На рис.22 видно более сильное, чем в контроле, развитие корневых систем у клевера, семена которого были обработаны ростовым «препаратом из эндофитов, а на рис.23 показано обилие клубеньков на корнях сои в варианте с обработкой семян растертыми клубеньками сои и очень слабое их развитие при заражении семян чистыми культурами клубеньковых бактерий сои. Приведенные результаты опытов показывают, что для активизации азотфиксации бобовых культур нужно стимулировать развитие эндофитов в корнях и клубеньках этих культур.

Рис. 22. Корневые системы клевера в контроле (1) и из семян, обработанных ростовым препаратом (2) в возрасте 1,5 мес.

Рис. 23. Молодые ростки сои при заражении клубеньками (слева) и чистой культурой эндофитов (справа)
Какие вещества, синтезируемые эндофитами, способны оказывать стимулирующее действие на размножение и активность клубеньковых бактерий? До сих пор многие исследователи придают большое значение так называемому леггемоглобину, окрашивающему клубенек клевера в розовый цвет (Риго, 1983). Ошибочность этого направления определяется как нерезультативностью многолетних исследований этих авторов, так и материалами рассмотренных выше опытов, доказавшими стимулирующее действие эндофитов на клубеньковые бактерии и даже при отсутствии окрашенных в красный цвет пигментов этого гриба. Как уже указывалось, кроме клеверных эндофитов, многие эндофиты из других растении синтезируют красный пигмент, окрашивая им цветы и плоды, и никто его за гемоглобин не принимает. По разработанной нами методике любой исследователь может получить чистые культуры эндофитов из корней клевера, пшеницы, томатов, ржи и других растений и убедиться в том, что продукты их жизнедеятельности не обладают признаками гемоглобина, за исключением такого, как окраска. Очевидно, основным стимулирующим свойством обладают гормональные вещества, ферменты и витамины эндофитов.
Ф. В. Турчин (1959), изучая механизм азотфиксации бобовых культур с 15N, пришел к выводу, что этот процесс осуществляется в клетках клубеньковой ткани под влиянием ферментов клубеньковых бактерий, но в таком случае бактерии могли бы в чистых культурах сами фиксировать атмосферный азот. При современном состоянии науки можно утверждать, что ферменты, на которые указывал Ф. В. Турчин, синтезируют в клубеньках эндофиты, так как их наличие в развитых клубеньках можно считать установленным фактом. В дальнейшем, продолжая эти исследования с сотрудниками З. Н. Берсеневой и Г, Г. Жидких, Ф. В. Турчин (1963) пришел к выводу о способности к азотфиксации ферментов, выделенных не только из клубеньков, но и из листьев и корней как бобовых, так и небобовых растений, что указывает на возможность усвоения атмосферного азота всеми растениями, хотя и в различной степени. Для того чтобы достоверность данного вывода стала достоянием пауки, необходимо установить недостающие звенья этой цепи, т. е. тот основной микроорганизм, ферменты которого способствуют азотфиксации растений.
Переходя к главной теме этой главы, мы хотели бы отметить, что выявление нами двух микроорганизмов в клубеньках бобовых растений открывает новые возможности для активизации процесса их азотфиксации. Вместо обычно рекомендуемых обработок семян бобовых культур соответствующими нитрагинами, нужно повысить вирулентность и активность клубеньковых бактерий, усиливая микотрофность этих культур путем опрыскивания семян гормональными препаратами, изготовляемыми из чистых культур эндофитов (например, Симбионтом 1 или Симбионтом 2). Добавление к ним микродоз молибдена усилит получаемый эффект, так же как и повторное применение такой обработки семян в потомстве данной культуры.
В природных условиях роль бобовых растений в обогащении целинных почв азотом невелика. Даже в степной зоне, растительность которой создала самые богатые по содержанию азота черноземные почвы, количество бобовых растений не превышает, в травостое более 5% (Лаврененко и Прозоровский, 1939). Многие исследователи приходили к заключению, что не только бобовые, но и растения других семейств обладают способностью усваивать атмосферный азот. Однако, поскольку они не указывали на участие определенных микроорганизмов, ответственных за данный процесс, наука не признавала это положение доказанным.
X. Шандерль (Schanderl, 1942) на основании точных учетов баланса азота в сосудах установил, что подсолнечник за вегетационный период может фиксировать из воздуха 613 мг азота на сосуд, ирисы — 539, а клевер и фасоль — только 384 и 321 мг. X. Шандерль считал, что не только бобовые, но и другие растения в симбиозе с неизвестными организмами способны усваивать азот из воздуха.
Большой интерес представляет изучение баланса азота у длительно растущих многолетних растений в природных условиях. Так, Э. Рассел (1955), директор Ротемстедской опытной станции в Англии, привел данные о накоплении азота за 20 лет в залежи, которая на 86% состояла из щучки (Deschampsia caespitosa Р. В.) при почти полном отсутствии бобовых в травостое. При невысоком содержании извести в почве ежегодная прибавка азота достигала 67 кг/га, а на карбонатной почве — 103 кг/га. Ниже мы покажем, что для нового азотфиксирующего микроорганизма рН среды имеет большое значение. Рассел отметил, что «симбиотическая фиксация азота, возможно, не ограничивается одними только бобовыми растениями, хотя в сельском хозяйстве они являются единственными важными азотфиксирующими культурами» (с. 298). Очевидно, большое значение имеет длительное существование многолетних растений на одном месте.
А. В. Соколов (1956) в заповедной степи установил накопление азота в слое 0-50 см черноземных почв в размере 17,5-26,5 т/га при наличии только 5% бобовых в травостое. Нами было установлено наиболее высокое содержание азота в типичном сероземе: 0,2% азота накопилось в многолетней орошаемой залежи, состоящей из чистого злакового покрова с бобовыми (Гельцер, Ласукова, 1934).
Из данных, полученных с применением изотопа 15N, большой интерес представляют работы Греты Стевенсон (Stevenson, 1959) об азотфиксации у небобовых культур. Она доказала способность к азотфиксации у многих растений на бедных почвах в Новой Зеландии. В песчаных почвах, свободных от азотфиксирующих бактерий, ею наблюдалась ассимиляция l5N у сосны, зараженной микоризой, у сливы, ежи, кипрея и других растении. Доказанной азотфиксацией обладают все небобовые растения, имеющие на своих корнях клубеньки, заполненные эндофитами совместно с актиномицетами.
Большинство растений, способных к азотфиксации, живет на бедных песчаных, каменистых или торфяных почвах. Несмотря на многочисленность работ, посвященных выяснению видового состава микроорганизмов, населяющих клубеньки небобовых растений, ученые еще не пришли к единому выводу. В сводных статьях по этому вопросу приводятся данные о наличии в клубеньках септированных эндофитов, актиномицетов и бактерий. Более достоверными являются работы, авторы которых применили для изучения клубеньков электронную микроскопию. Ж. Беккинг, В. Бэр и А. Хоуинк (Becking, Boer, Houwink, 1964) установили, что в клубеньках ольхи имеются эндофиты в виде септированных гиф и их многочисленных везикул, как заполненных цитоплазмой, так и лишенных се, и актиномицеты.
В последние годы (1980-1982) группа авторов, возглавляемая И. II. Андреевой (Андреева и др., 1980), изучающая в электронном микроскопе развитие эндофитов в корнях облепихи, пытается доказать, что фиксация азота осуществляется везикулами, поскольку она слабо проявляется в мицелярной стадии развития эндофита и значительно увеличивается в период появления везикул. Совершенно очевидно, что это совпадение связано с общим состоянием развития эндофита, а не со способностью везикул к азотфиксации, которые являются не самостоятельными органами, а расширенной частью гифа гриба, служащей для накопления продуктов его синтеза белковой природы. Неправильным в статьях указанных авторов является определение симбионтов как «эндофит–актиномицет», тогда как это два разных организма, один из которых — актипомицет — выделяется всеми как чистая культура, а другой — эндофит — только при наличии гормональных веществ в питательной среде (Гельцер, Кузнецова, 1977).
Первичный почвообразовательный процесс на свежих глинистых отложениях начинается с развития сильно микотрофной мать–и–мачехи (Tussilago farfara L.), к которой обычно через несколько лет присоединяется пырей (Triticum re–pens L.). Проходит длительный период накопления азота и зольных элементов в поверхностном горизонте почвы до появления в травостое ползучего клевера (Trifolium repens L.) или других бобовых, которые очень требовательны к условиям среды. Изучение динамики накопления азота в глине, взятой из глубокой шахты метро и заросшей в первые годы мать–и–мачехой, а затем пыреем, показало, что за 16 лет верхний горизонт этой глины превратился в темноцветную дерновую почву. Первоначальное содержание в глине азота 0,010%» а после указанного срока оно составило в слое 0-5 см 0,093%, в слое 6-25 см — 0,049, 30-35 см — 0,019%. Это накопление азота произошло без всякого участия бобовых в травостое и при незначительном количестве азотобактера в верхнем горизонте — 10-20% комочков обрастания на гелевых пластинках.
Предварительный опыт по выращиванию проростков мать–и–мачехи в водной культуре с питательной смесью Гельригеля три различном содержании азота показал, что лучше всего это сильно микотрофное растение растет уже при 0,1% азота в смеси, обеспечивая себя атмосферным азотом, тогда как увеличение дозы азота до нормальной для таких растений, как пшеница или рожь, является гибельным для мать–и–мачехи.
Обстоятельный вегетационный опыт, поставленный в нашей лаборатории в полулитровых сосудах с силикагелем, с несомненностью подтвердил способность к азотфиксации сильно микотрофного растения мать–и–мачехи. Опыт проведен в двукратной повторности по следующей схеме: 1 — контроль — питательная среда без азота; 2 — питательная среда + 1,4 мг азота. В каждый сосуд высаживали по 4 проростка с зачатками листьев, которые в общей сложности содержали 11,0 мг азота. Через 2 мес. в надземной части и корнях растений, освобожденных от силикагеля, было определено содержание азота (табл. 4).
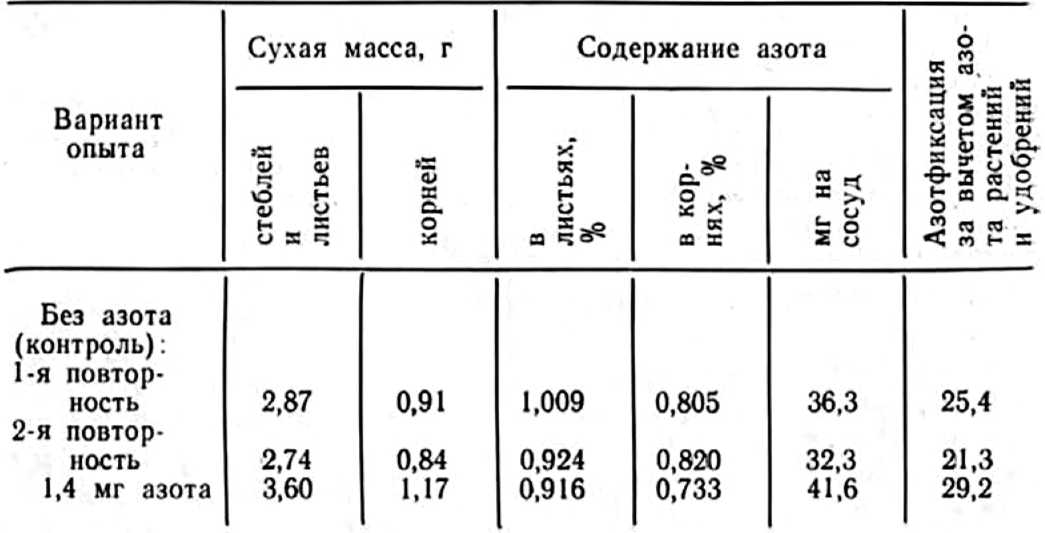
Примечание. В посадочном материале содержался азот в среднем на сосуд 11,0 мг.
Наибольшая азотфиксации (29,2 мг на сосуд) наблюдалась при добавлении в «питательную среду всего 1,4 мг азота. Высокая микотрофность корней у мать–и–мачехи была установлена и в варианте без азота.
Как будет показано ниже, способность мать–и–мачехи к азотфиксации подтвердилась также в длительных опытах в лизиметрах. Именно благодаря данной способности это растение поселяется первым как на бедных аллювиальных песках, так и на глинистых материнских породах.
Чтобы доказать азотфиксирующую способность сильно микотрофных растений, следовало установить ее наличие у чистых культур эндофитов. Изучению азотфиксирующей способности выделенных чистых культур эндофитов предшествовал длительный подбор питательных сред и условий их культивирования, необходимых для выявления продуктивности этого процесса. Обильный рост мицелия эндофитов в питательных средах можно получить при добавлении к синтетической среде с сахаром вытяжек из растений, пивного сусла или кукурузного экстракта, но в этих случаях, т. е. при хорошем азотном питании, эндофиты не фиксируют азота, что характерно для всех азотфиксирующих микроорганизмов. Способность эндофитов фиксировать азот проявляется при минимальном количестве минерального азота или азота аминокислот в среде (0,1 мг/л), что определяет длительный период роста грибов (20-30 дней) для наращивания большой массы мицелия. Еще медленнее растут эндофиты в питательной среде, без азота. Понадобилось 2-3 мес. для получения хорошо развитого мицелия у мать–и–мачехи, который фиксировал за 72 дня 0,6 мг азота, а за 118 и 127 дней — 3,2 и 4,7 мг. Эндофит из ирисов за 118 и 123 дня в среде без азота фиксировал 2,5 и 3,0 мг азота.
Установив, что эндофиты используют для азотфиксации больше сахара, чем свободно живущие бактерии, мы уменьшили аэрацию путем их культивирования в широких пробирках при слое жидкости 10 см и замены минерального азота аспарагином или нуклеинатом натрия из расчета 5 мг на литр питательной среды № 22 с рН 5,8-6,6. В широкой пробирке 50 мл питательной среды заражали небольшим количеством мицелия эндофита. В начале опыта ежедневно взбалтывали пробирки для получения большого количества отрезков гиф. Затем их помещали на 30 дней в термостат при температуре 24-28° и доступе воздуха. После этого срока 5 мл среды брали для определения сахара по Бертрану, а 45 мл — для определения азота мицелии по Кьельдалю с применением перекиси водорода. Титрование проводилось с 0,01 н. растворами серной кислоты и щелочи. Было осуществлено около 500 определений содержания азота. Отмечено, что чистые культуры эндофитов зимой фиксируют немного меньше азота, чем весной и летом.
Чтобы избежать изменения культуры эндофитов при длительной их адаптации к лабораторным питательным средам, мы выделяли новые чистые культуры для определения их способности к азотфиксации. Особое внимание обращалось на отсутствие загрязнения лабораторного воздуха аммиаком. При протягивании воздуха через титрованную кислоту в течение нескольких дней не было обнаружено его наличия.
Полученные данные по азотфиксации чистых культур эндофитов приведены в табл.5.

Многие авторы отмечают, что развитие эндофитов в корнях растений не зависит от степени кислотности почвы, но это еще не доказывает, что условия среды не влияют на активность их жизнедеятельности. При специальном изучении влияния кислотности питательной среды на азотфиксацию эндофитов мы получили интересные результаты (табл. 6).

Наиболее значительно снизилась азотфиксация при увеличении кислотности среды с рН 6,4 до рН 5,5 у эндофитов» выделенных из пшеницы, кукурузы, ирисов, ольхи, в то же время эндофит из вереска не реагировал на повышение кислотности. При подкислении до pH 4,5 у всех эндофитов значительно снизилась способность к азотфиксации, что может служить объяснением более низкого содержания азота в зоне кислых подзолистых почв, чем в карбонатных черноземах.
Как видно из табл.6, абсолютная азотфиксация эндофитов, так же как и относительная (на 1 г использованного сахара), довольно значительна. Чистые культуры эндофитов, выделенные из клубеньков бобовых растении, не обладали повышенной способностью к азотфиксации по сравнению с эндофитами из корней этих растений. Поскольку в клубеньках бобовых растений имеется два микроорганизма, обладающих способностью к азотфиксации — клубеньковая бактерия и эндофит, мы сделали попытку выращивать их в лабораторных питательных средах совместно, что нам не удалось. Быстрое подкисление питательной среды было неблагоприятно как для эндофита, так и для бактерий. Очевидно, их совместное существование в клубеньке обеспечено нейтрализацией избыточной кислотности.
Установление азотфиксирующей способности эндофитов в питательных средах при минимальной дозе азота еще не дает права с уверенностью утверждать, что они могут осуществлять этот процесс в природных условиях, хотя эндофиты как симбиотрофные организмы более надежно обеспечены энергетическим материалом в природных условиях, чем свободноживущие азотфиксирующие бактерии. Все же для доказательства их участия в обогащении растений и почвы азотом нужно было установить, что сильно микотрофные растения фиксируют больше азота, чем слабо микотрофные.
Для изучения этого вопроса были созданы на территории ВИУАА бетонные лизиметры без дна размером 0,5 м2, которые были заполнены на глубину 80 см слабосортированной глиной, взятой с глубины 3 м, ниже которой находилась местная глинистая материнская порода. Материалы подробного химического и микробиологического исследования состава глины после 3 и 7 лет проведения этого опыта уже опубликованы в наших работах (Гельцер, 1956, 1963б). Здесь мы сообщаем данные за 10 лет.
Из опытов в лизиметрах академика В. Р. Вильямса было известно, что рост растений на материнской породе очень задерживается из–за недостатка зольных элементов и азота. В нашем опыте было внесено перед посевом в каждый лизиметр по 2 г Р205 в виде КН2РО4, 1,5 г азота с KN03, микроэлементы с боромагниевыми удобрениями и по 100 г. СаО.
Выбор подопытных растений был обусловлен степенью их микотрофности. В парующем лизиметре незначительное накопление азота слагалось из азота осадков, поливных вод,, удобрений и азотфиксации водорослей. Помимо указанного лизиметра, имелись лизиметры, в которых ежегодно высевались слабо микотрофные однолетние зерновые и бобовые культуры, сильно микотрофные ирисы, многолетние злаки и бобово–злаковые травосмеси. Во второй серии, кроме отмеченных, были лизиметры с сильно микотрофными многолетними растениями — мать–и–мачехой, пыреем, любкой.
Включение ирисов в опыт определялось имеющимися данными о быстром окультуривающем их действии на почву (Ф. Ю. Гельцер, 1955, 1960) и очень высокой степени микотрофности их корней (рис. 24). Впервые X. Шандерль (Schanderl, 1942) установил, что ирисы в сосуде накопили 539 мг азота, а клевер в тех же условиях — 384 мг.

Рис. 24. Чистая культура эндофитов из корней ирисов. Везикулярные вздутия окрашены анилин–бляу
Изучение мать–и–мачехи представляло интерес, поскольку это растение обеспечивает первичный почвообразовательный процесс на глинистых обнажениях или песчаных аллювиальных наносах. Несмотря на свою способность к азотфиксации, бобовые растения никогда не поселяются первыми на бедных субстратах. В противоположность бобовым мать–и–мачеха не выдерживает субстратов, обогащенных минеральными солями и перегноем, и ее нельзя выращивать на материнских породах более 4-6 лет.
В табл.7 дано накопление азота в глине лизиметров под влиянием роста сильно и слабо микотрофных растений.
Слабо микотрофные однолетние зерновые культуры даже при наличии двухлетнего культивирования однолетних бобовых — вики и гороха — незначительно обогатили глину азотом, тогда как сильно микотрофные многолетние злаки, ирисы и мать–и–мачеха способствовали значительному увеличению азота в почве. Преимущество остается за многолетней бобово–злакововой смесью, которая в 3 и 5 раз повысила содержание азота в глине. Баланс этого элемента приведен в табл.8.

Наглядным подтверждением полученных в этом опыте (в первой серии) данных служит фотография, показывающая рост проса на почвах лизиметров разных вариантов на седьмой год (рис. 25). В лизиметре без растений урожай сухой зеленой массы проса был предельно низким — 8,9 г. Лучше выросло просо в лизиметре с однолетними культурами и ирисами — 27,9 и 30,4 г. Значительно увеличилась зеленая масса проса после 6 лет возделывания многолетних злаков и бобово–злаковой травосмеси — соответственно 98,4 и 112,5 г.

Опыт убедительно показывает, что сильно микотрофные многолетние злаки обладают значительной способностью к азотфиксации, так как иначе они не смогли бы способствовать заметному накоплению перегноя, достаточному для создания почти такой же зеленой массы проса, которая была получена по лучшему предшественнику — многолетней бобово–злаковой травосмеси.
Ирисы и однолетние сельскохозяйственные культуры за 6 лет также заметно повысили Плодородие глины по сравнению с его уровнем в контрольном лизиметре, где глина так и не приобрела основного свойства почвы — ее плодородия.
Результаты изучения азотфиксации чистых культур эндофитов в лабораторных условиях, подкрепленные данными о накоплении азота и перегноя под влиянием роста сильно микотрофных растений в лизиметрах на материнской породе» находят полное подтверждение при исследовании природных почвообразовательных процессов. В природных условиях максимальное количество перегнойных веществ и азота накапливается в почвах на богатых фосфором карбонатных материнских породах, что обеспечивает хороший рост многолетней травянистой формации с хорошо развитой корневой системой. П. А. Костычев (1886) подчеркнул, что развитие гумозного слоя черноземов определяется глубиной проникновения корневых систем травянистых растений. По данным Н. И. Болотиной (1947), в метровом слое деградированных выщелоченных и обыкновенных черноземов в расчете на 1 га содержится от 21 до 37 т азота, а в мощных черноземах — 31-43 т/га.

Рис. 25. Рост проса на почвах с различным плодородием в лизиметрах:: слева направо — по пару; после однолетних культур; после ирисов; после многолетних злаков; после многолетних травосмесей
В основном накопление азота в почвах степей, прерий и лугов связано с хорошо выраженной микотрофностыо многолетней травянистой растительности. По данным Н. М. Базилевич (1955), ежегодный опад такой растительности содержит от 94 до 193 кг азота на 1 га.
Выводы
1. Чистые культуры эндофитов, выделенные из корней различных растений, обладают значительной способностью к азотфиксации. В лабораторных условиях за 30 дней опыта они фиксируют от 3,7 до 25,2 мг азота на 1 г сахара. В природных условиях симбионтные грибы многолетних растений могут накопить большое количество азота в почве при условии нейтральной реакции среды обитания.
2. Установленное нами в хорошо развитых клубеньках всех бобовых культур присутствие эндофитов подтверждает их участие в процессе азотфиксации этих растении.
3. Тройной симбиоз у бобовых — растение — клубеньковые бактерии — эндофиты — и симбиоз у небобовых растений с хорошо развитой микоризой и клубеньками на корнях обеспечивают значительную азотфиксацию в природных условиях.
4. Стимулирующее влияние эндофитов на азотфиксацию клубеньковых бактерий определяет эффективность обработки семян бобовых культур перед посевом ростовыми препаратами (такими, как симбионты), изготовленными из чистых культур эндофитов.
5. В длительных опытах в лизиметрах было установлено, что сильно микотрофные растения накапливают в материнской породе больше азота и перегноя, чем слабо микотрофные.
6. Обоснование большого значения азотфиксации эндофитов для накопления азота в почве заставляет обратить особое внимание на создание оптимальных условий их развития в корнях возделываемых культур.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ