DSBaN
kn = 7Г ■
“ ■ I(E„N) h
В зависимости от диффузионного пути И, концентрации фермента Е0 получаются величины кг (числа оборотов в сек-1 см. гл. 4, с. 70), необходимые для переработки в одном слое фермента всего приносимого диффузионным потоком субстрата к каталитически активной поверхности, приведенные в табл. 4.
ТАБЛИЦА 4
ВЕЛИЧИНА КАТАЛИТИЧЕСКОИ АКТИВНОСТИ АДСОРБИРОВАННЫХ НА МЕМБРАНЕ
ФЕРМЕНТОВ-Kj В СЕК-1, ОГРАНИЧИВАЕМЫЕ ДИФФУЗИОННЫМ ПОТОКОМ
СУБСТРАТА В ЗАВИСИМОСТИ ОТ I И Е0 (ПРИ Д~ 10-8 CM2/CEK, S„~ 10-3 М
(10—5 МОЛЬ/СМ3)
1, см
£0, м
1 ю-1
ю-*
ю-*
10-*
10~5
2-101
2-102
2 -103
2-104
2-105
10-7
4-102
4-103
4-104
4-105
4.10е
Если субстратом являются большие молекулы, например, белка в случае протеолиза, то D~10-7 см2/сек и S0 —10-5 М (10-8 моль/см3) предельные величины k2 будут соответственно ниже (табл. 5).
ТАБЛИЦА 5
ВЕЛИЧИНЫ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ АДСОРБИРОВАННЫХ НА МЕМБРАНЕ ФЕРМЕНТОВ, ТИПА ПРОТЕИНАЗ, ОГРАНИЧИВАЕМЫЕ ДИФФУЗИОННЫМ ПОТОКОМ СУБСТРАТА В ЗАВИСИМОСТИ ОТ I И Е„
I, см
10, м
1
ю-»
ю-*
ю-«
ю-<
10-7
4-10-'
4
4-101
4-102
4-103
1и~5
2-ID-2
2-Ю-1
2
2-10
2 • 102
Мы видим, что процессы, аналогичные внеклеточному пищеварению, очень сильно лимитируются диффузией. Действительно, к ферменту — протеиназе, адсорбированному на какой-либо поверхности при реально достижимых концентрациях белков при пищеварении диффузионный поток приносит одну молекулу субстрата один раз на протяжение времени порядка секунд. Нет никакого смысла в эволюционном совершенствовании протеиназ сверх этого лимита — более активные ферменты — бесполезны и, следовательно, не могут возникнуть в ходе естественного отбора. Так что наши рассуждения ib главе 4 о возможной причине парадоксально низкой каталитической активности протеиназ, /наверно, действительно должны быть сведены к объяснению диффузионными ограничениями.
Рассмотрим теперь возможные диффузионные ограничения биохимических процессов, идущих при диффузии субстратов в растворах ферментоз.
Модель 2. Представим себе клетку в виде трубы длиной I, сечением а, заполненную раствором фермента концентрации Е0. Пусть на одном конце трубки поддерживается постоянная концентрация субстрата S0, а на втором конце концентрация субстрата S,. Примем, как и раньше, что скорость превращения субстрата в продукт задается формулой Михаэлиса — Ментен:
k2E S
v = т—г~т . (Кт — константа Михаэлиса)
т г *
В стационарных условиях диффузионный поток субстрата уравновешивается в каждой точке объема ферментативным процессом, т. е.:
d2S k*SE,
РИС. 9. Изменение концентра ции субстрата при его диффу зии в растворе фермента
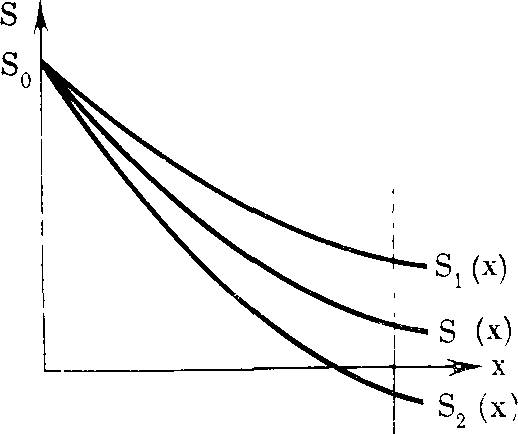
Ясно, что коэффициент диффузии D и величина k2 связаны друг с другом. Установить связь между ними прямо из условия S(x) > >0 не удастся, т. к. нельзя аналитически решить уравнение с граничными условиями S(0)=S0, dS/dx|*=i=0. Попытаемся хотя бы грубо оценить необходимую величину кг через D. Если предположить, что S{x)^Km, т. е. молекулы фермента в достаточной мере обеспечены субстратом, то кривая S(x) на рис. 9 пройдет ниже кривой Si(a:) и выше кривой S2(x), которые удовлетворяют
d2Si , /0 k2E0 d2S2 k2E0 соответственно уравнениям и — —и т
же граничным условиям, что и S (х).
Требование, чтобы концентрация S(x) была больше 0, с необходимостью влечет S^xJX). Отсюда несложными выкладками получаем неравенство: k <_40S^_ l2E0
Важно подчеркнуть, что в отличие от случая с диффузией к каталитической поверхности (с. 78), величина &2 оказывается обратнопропорциональной квадрату диффузного пути I.
Теперь мы можем провести численную оценку. Примем D~ ~ 10_6 см2/сек S0 — 10—4 М (10-7 моль/см3) и вычислим величины &2, лимитируемые диффузией субстратов для растворенных ферментов.
ТАБЛИЦА 6
ВЕЛИЧИНЫ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ВНУТРИКЛЕТОЧНЫХ ФЕРМЕНТОВ К2 В СЕК-1, ОГРАНИЧИВАЕМЫЕ ДИФФУЗИОННЫМ ПОТОКОМ СУБСТРАТА В ЗАВИСИМОСТИ ОТ I И Е,
Ео, м
1, см
ю-1
10“г
10-*
I0-*
10-5
4-10-3
4-10-1
4-101
4-103
10-0
м
1
О
4
4-102
4-104
10-7
4-10-1
4-101
4-103
4-105
Полагая характерными размеры клетки порядка 10-3 см (10 |я), концентрации субстрата порядка 10-4 М, концентрации ферментов 10-5—10-7 М мы получим для kz величины порядка 101—Ю3. Именно этому диапазону соответствует каталитическая активность ферментов, функционирующих во внутриклеточных растворах (типа ферментов гликолиза). Это «средние ферменты» в нашей классификации (см. табл. 2, гл. 4, с. 71).
В то же время для внутриклеточного процесса типа протео- лиза (все это в отсутствие активного перемешивания) реальна концентрация субстрата 10~6 м, а фермента 10_в—10-7 ми D~ ~ 10-7 см2/сек) диффузионно-лимитируемая величина оказывается равной 10-1—1 сек-1.
Как видно при сравнении табл. 5 и 7, при характерных размерах клетки порядка 10-4 см различия в диффузионно-лимити- руемой каталитической активности ферментов, адсорбированных на мембране и свободно растворенных в «протоплазме», нивелируются. Следовательно, для мелких клеток типа микробных адсорбция ферментов не дает значительных преимуществ. Возможно, этим и определяются сами эти характерные размеры микробных клеток.
Может возникнуть сомнение в правильности приведенных оценок — там были заданы в качестве самых низких концентраций ферментов порядка 10~7 М. Казалось бы можно совершенствовать работу каждой молекулы фермента, увеличивать kz, еще сильнее уменьшая концентрацию фермента. Оказывается — нельзя. Предельно низкая концентрация ферментов определяется малыми размерами клеток. В самом деле в клетке не может быть меньше одной молекулы данного фермента. Одной молекулы, конечно, мало — ненадежно. Легко вычислить, что при характерных размерах клетки 10~4—10-3 см и наличии в ней 10‘— 102 молекул данного фермента, концентрации ферментов не могут быть ниже 10~6—10"8 М.
Так или иначе, эти, как ясно, весьма приближенные оценки иллюстрируют диффузионные ограничения даже одноферментных биохимических реакций.
Эти ограничения становятся особенно существенными в многоэтапных, многоферментных биохимических превращениях. Действительно, в тех многоэтапных превращениях, в которых важен лишь конечный продукт, чем меньше времени расходуется на промежуточные стадии и чем меньше необходимое количество ферментов, тем лучше. Однако, если промежуточные превращения происходят в бесструктурном гомогенном растворе, путь каждой данной молекулы по всей цепи превращений становится очень долгим.
В многоэтапных превращениях, в которых важен лишь конечный продукт, диффузия промежуточных продуктов в объем (клетки) ухудшает кинетические характеристики системы в целом. Диффузия, как и в одноферментных системах, лимитирует
скорости промежуточных реакций. Кроме того, для обеспечения должной скорости промежуточных реакций, т. е. создания соответственно высоких концентраций промежуточных субстратов, оказываются необходимыми большие количества исходных субстратов. На это может расходоваться значительная часть исходного субстрата. И, возможно, самое главное, резко возрастает инерционность системы, время, необходимое для переключения с одного режима на другой. На каждом этапе продукты, возникшие на предыдущем ферменте, диффундируют в среду. Для того, чтобы дальнейшее превращение пошло со значительной скоростью, концентрация образовавшегося продукта, т. е. субстрата очередного фермента, должна повыситься до некоторой величины. В зависимости от объема системы на это нужно большее или меньшее время. Такая задержка происходит на каждом этапе. Суммарная задержка пропорциональна числу промежуточных стадий. Ясно, что подобная биохимическая система будет очень инерционной и малопригодной, например, для энергетического обеспечения быстрых физиологических процессов.
Другой существенный недостаток гомогенной системы — неэкономное расходование ценного ферментативного вещества. Для обеспечения необходимой скорости превращения веществ нужна большая концентрация соответствующих ферментов во всем реакционном объеме.
Таким образом, давление естественного отбора должно привести к выработке приспособлений, уменьшающих задержку на промежуточных стадиях и обеспечивающих более экономное использование ферментов. Эти приспособления — надмолекулярные комплексы, структуры, в которых катализаторы промежуточных превращений находятся на малых расстояниях или даже определенным образом ориентированы друг относительно друга.
Осуществление полиферментных превращений посредством надмолекулярных полиферментных комплексов, расположенных внутри органелл, отграниченных от окружающей их среды избирательно проницаемыми мембранами, обеспечивает дополнительные кинетические преимущества. Условием эффективного функционирования таких органелл является относительно незатрудненное проникновение в них исходных веществ и свободный выход конечных продуктов при малой проницаемости их поверхностной мембраны для промежуточных продуктов.
В этом случае скорость промежуточных превращений зависит от концентрации первого субстрата, поступающего из среды.
Ясно, что эффективным способом ускорения промежуточных превращений может служить увеличение концентрации превращаемых веществ внутри органеллы посредством активного транспорта, т. е. противоградиентной накачки веществ при сопряженной трате энергии, например, выделяющейся при гидролизе АТФ.
Таким образом, активный транспорт, сопряженный гидролиз АТФ, обычно анализируемые с чисто термодинамических позиций, обеспечивают большую скорость многоэтапных биохимических превращений, увеличивают их кинетическое совершенство. В этом, вероятно, и состоит основной биологический смысл процессов активного транспорта.
Мне хочется специально подчеркнуть последнее обстоятельство, так как обычно полагают, что связь между кинетическими и термодинамическими характеристиками химических и биохимических систем отсутствует. Здесь мы можем даже вывести количественную связь между затратами свободной энергии при активном транспорте и скоростью превращения вещества внутри органеллы.
Пусть v — скорость превращения субстрата в продукт, a AF — изменение (затрата) свободной энергии при противоградиентном переносе данного субстрата к месту его дальнейшего превращения; тогда, из уравнения Михаэлиса (см. с. 79) и соотношения:
S = Su exp (Д F/RT) получим:
k2S0E exp (AF/RT)
V = S0 exp (AF/RT) + Ku ’
где E — концентрация фермента, Км— константа Михаэлисаг равная половине концентрации субстрата, обеспечивающей максимальную скорость, S0 — концентрация субстрата вне органеллы, 5 — его концентрация внутри органеллы.
Наивысшая скорость многоэтапных превращений при наименьших количествах промежуточных продуктов достигается при переходе к полиферментным комплексам с «правильным», соответствующим маршруту превращений, расположением ферментов в комплексе и наиболее интенсивным противоградиент- ным переносом исходного субстрата внутрь органеллы и конечного продукта из нее. Суммарная скорость потока продукта при таком многоэтапном превращении лимитируется лишь собственно каталитической активностью наиболее медленного фермента в полиферментном комплексе и скоростью отвода (быть может, той же диффузии или активной откачки) образующегося конечного продукта.
До появления аппаратов перемещения в пространстве, обеспечивающих радикальное преодоление диффузионных ограничений, давление естественного отбора должно было обусловить йаиболее быструю в данной системе дуффузию.
Итак, биологический смысл структурной организации многоэтапных биохимических процессов, биологический смысл образования митохондрий и хлоропластов — предельно возможное ускорение превращений веществ и наивысшая скорость регуляции этих превращений.
Второе, возможно столь же важное, биологическое преимущество структурно организованных систем по сравнению с гомогенными растворами — резкая экономия каталитического вещества. Действительно, относительно небольшое число митохондрий обслуживает очень большие объемы протоплазмы. Если бы удалось так гомогенизировать митохондрии, чтобы все содержащиеся в них ферменты в неповрежденном состоянии перешли в раствор, то итоговая скорость превращения веществ (даже при избыточной их концентрации) была бы очень низкой. Для обслуживания такой гомогенной системы потребовалось бы значительно больше митохондриального вещества (то же касается вещества хлоропластов и т. п.).
Более или менее правильное пространственное расположение дискретных порций малого количества ферментов позволяет обеспечить высокую скорость превращения веществ, достигаемую в гомогенном растворе лишь при относительно очень высоких концентрациях ферментов.
Биологические преимущества более или менее правильной пространственной организации надмолекулярных полифермент- ных комплексов основаны на «игре на градиенте». Расположение небольшого числа митохондрий на некотором расстоянии друг от друга позволяет им использовать зависимость скорости диффузии от величины градиента концентрации диффундирующих веществ (см. рис. 10).
Представим себе, что поток вещества из внешней среды в клетку перерабатывается в конечном итоге в какой-либо полезный продукт.
Пусть для конкретности речь идет о диффузии кислорода и поглощении его митохондриями, вырабатывающими АТФ. В принципе можно рассчитать, сколько митохондрий необходимо для оптимальной работы и как они должны быть расположены (на каких расстояниях друг от друга, от поверхности клетки, от потребителей АТФ, например, миофибрилл (рис. 10). Для дедуктивного построения было бы желательно получить аналитическое выражение, связывающее коэффициент диффузии, каталитическую активность митохондрий, расстояние от границы клетки и т. п. с необходимым числом митохондрий и расстояниями между ними. Задача эта, однако, очень сложна. Можно не сомневаться, что именно такие оптимальные решения были найдены во всех конкретных случаях под давлением естественного отбора.
Теперь вполне уместно сказать, что изложенные выше соображения о биологическом смысле замены сплошной каталитической поверхности дискретными пространственно отдаленными друг от друга структурами (клеточными органеллами) являются результатом применения -системы аналогичных представлений, давно развитых в другой области.
Много лет назад (в 1947 г.) на меня произвело очень сильное впечатление изложение вопроса об устьичной регулировке транспирации листьев выдающимся лектором, профессором био-
РИС. 10. Переработка малым числом дискретных каталитиче- ски-активных структур потоков субстрата с большой поверхности за счет краевых эффектов диффузии

So — концентрация субстрата у наружной поверхности; Р — концентрация продукта
логического факультета МГУ Д. А. Сабининым. Несколько менее красочно материал этой лекции опубликован в книге [251]. Слова Сабинина имеют прямое отношение к рассматриваемому нами вопросу, и я приведу их полностью: «...Еще в 1800 г. Брауном и Эскомбом [370] было проведено изучение диффузии углекислоты через целлюлозные пластинки с отверстиями диаметром 0,38 мм. Это исследование показало, что при общей площади пор указанного диаметра, составляющей лишь 11% от площади пластины, через нее проходило столько же углекислоты, как и через свободное сечение трубки, иными словами, перегородка з данном случае переставала быть препятствием, снижавшим скорость диффузии. Браун и Эскомб предположили, что при порах еще меньшего диаметра, равного ширине устичных щелей эпидермиса, равенство скорости диффузионного тока при наличии и в отсутствии перегородки с порами будет достигнуто, если общая площадь пор составит лишь 1—3% площади пластинки. Такое соотношение площади устьичных щелей и всей поверхности эпидермиса является обычным у большинства растений.
Предположение Брауна и Эскомба примерно через четверть века могло быть подвергнуто экспериментальной проверке, когда фирмой Цейсс были изготовлены тонкие медные пластинки с порами диаметром около 10 мкм. Эта величина пор примерно равна диаметру открытых устьичных щелей. На 1 ммг площади медного листка толщиной 20 мкм наносилось до 100 пор. Для невооруженного глаза такая пластинка, пронизанная микроскопически мелкими порами, представлялась совершенно сплошной. Но при изучении испарения воды с поверхности небольших сосудиков, накрытых этими пластинками или оставленных совершенно непокрытыми, оказывалось, что в обоих случаях скорость испарения воды была примерно одинаковой. Этот удивительный результат явился блестящим подтверждением теоретических представлений о значении градиента дефицита насыщения как фактора скорости испарения.
При диффузии водяного пара через отверстия, равные по диаметру ширине открытых устьичных щелей, краевое испарение играет столь большую роль, что скорость испарения с единицы поверхности поры почти в 80 раз превышает соответствующуювеличину для свободной поверхности. В работах Губера [403] имеется обширный экспериментальный материал, позволяющий установить зависимость испарения от диаметра пор и величины общего сечения всех пор по отношению ко всей площади пластинки» [251, с. 132].
Было бы несправедливо не сказать, что за 20 лет до Брауна и Эскомба Стефан [461] теоретически и экспериментально исследовал испарение и диффузию жидкостей из ограниченных поверхностей и отверстий. При этом он исходил из работ Гельмгольца по прохождению звуковой волны через трубы и отверстия (органные трубы) и своих собственных аналогий между концентрационными (диффузионными) и электростатическими градиентами.
Стефан показал, в частности, что в силу краевых эффектов скорость диффузии через круглое отверстие пропорциональна его радиусу, а не площади, т. е.
v=4 DRp,
где v — скорость диффузии, D — коэффициент диффузии, р — величина градиента концентрации, R — радиус отверстия.
Таким образом, при уменьшении площади круглого отверстия в п раз скорость диффузии через него убывает лишь в У/г раз. Этим и объясняются устьичные эффекты. Их количественный анализ с учетом формы и взаимного влияния соседних отверстий сложен и требует применения ЭВМ.
Из изложенного выше ясно, что роль пространственных факторов, «игра на градиенте» давно осознана в физиологии растений ‘. Тем удивительнее, что в весьма близкой к физиологии растений области — биохимии — кинетическая роль структуры до сих пор осталась неосознанной. Насколько мне известно, до сих пор аналогия между пластинкой с малым числом дырок и, например, клеткой с митохондриями не проводилась. Отчасти это объясняется тем особым значением, которое придавалось каждому успешному осуществлению того или иного биохимического процесса в бесструктурной системе, в гомогенном растворе. В самом деле, лишь реализация ферментативного процесса в бесструктурной системе много десятилетий считалась обязательным условием изучения механизма такого процесса. Это обстоятельство было очень четко подчеркнуто В. А. Энгельгардтом в 1962 г. Он писал:
«В заключение подчеркнем, что все сказанное не означает, разумеется, недооценки значения структуры. Но мы предпочли придерживаться области тех вопросов, которые могут быть выражены химическими уравнениями и конкретными физическими представлениями.
К сожалению, вопросы структуры опутаны весьма больши' ореолом неопределенности, в них можно вкладывать все, что угодно, от структуры молекулы до структуры любого вещества, существа и даже до структуры популяций.
Повторяем, структура важна, ею пренебрегать нельзя. Но опыт биохимии дает нам примеры иного порядка. Был длительный период, когда все, что не удавалось описать химическими уравнениями, относилось за счет структуры. В период, когда ученые не могли ничего сказать о механизме дыхательного процесса, Варбург с восторгом говорил о роли структуры для клеточного дыхания. Но что осталось от роли структуры для клеточного дыхания? (его интенсивность (!)—С.Ш.). В настоящее время можно весь процесс клеточного дыхания воспроизвести в гомогенном растворе структуры. От структуры, которая фигурировала как основное звено Варбурга, не осталось и следа. Опыт учит, что термин «структура» обычно бывает ширмой, за которой скрывается наше незнание... Если мы можем воспроизвести кардинальные проявления жизнедеятельности в бесструктурной системе, нам нечего желать лучшего. Мы можем в бесструктурной системе воспроизвести редупликацию молекул ДНК, мы можем в бесструктурной системе воспроизвести такой коренной биологический процесс, как явление гибридизации». [352, с. 47].
Энгельгардт совершенно прав, говоря о возможности в принципе воспроизвести даже самые сложные биохимические процессы в бесструктурных системах. Строгая, высоко совершенная стереоспецифичность молекул белков-ферментов, связывающих в активном центре лишь молекулы своего субстрата, их способность различать например, окисленное и восстановленное состояние молекул субстратов (мы знаем это на примере НАД- дегидрогеназ) вполне может обеспечить нужную последовательность реагирования в многоэтапных процессах [471]. Для правильного, безошибочного осуществления многоступенчатых процессов превращения веществ, освобождения и усвоения энер- тии структура не нужна. Но смысл структуры не в этом. Структура обеспечивает большее биохимическое совершенство — в структурированных системах процессы идут быстрее, чем в бесструктурных. Структура нужна для ускорения многоэтапных превращений и их более совершенной регуляции-, она увеличивает экономичность системы, т. е. обеспечивает переработку наи- -большей массы субстратов наименее «материалоемкими» системами катализаторов-ферментов[8].
Глава 6
МЕМБРАНЫ, ИОННАЯ АСИММЕТРИЯ
Живое вещество должно быть дискретным, разделенным на организмы.
Возникновение дискретных организмов сопряжено с решением в ходе эволюции многих проблем.
Необходимость сохранения целости организма приводит к возникновению сигнальной системы, реагирующей на повреждение, а затем и на возможное повреждение (раздражение) клетки.
Асимметричное распределение ионов в системе клетка — среда является эволюционным результатом и способом осуществления возникновения раздражимости и возбудимости клеток.
Причина повышенной концентрации внутри клетки ионов калия, а снаружи ионов натрия заключена в геологической истории Земли.
В предыдущей главе мы пришли к необходимости эволюционного возникновения структурной организации для преодоления диффузионных ограничений биохимических процессов.
Структурная организация оказывается необходимой и по другим не менее важным эволюционным соображениям.
Ранее (гл. 2) мы подчеркивали, что «биологическое (кинетическое) совершенство» зависит от скорости увеличения массы вещества данного вида. Казалось бы, если не принимать в расчет диффузионные ограничения, вещества данного вида — матричные молекулы и соответствующие ферменты могли бы существовать в виде неразделенной смеси — «живого киселя», по выражению Н. В. Тимофеева-Ресовского.
Однако в этом случае естественный отбор становится неэффективным. Условие эволюции, способ естественного отбора— гибель, смерть (менее приспособленных. Гибель должна быть строго избирательной — лишь менее совершенных. Это возможно лишь при условии существования «живого вещества» в воде дискретных порций, содержащих необходимый я достаточный, комплект матричных макромолекул, ферментов и всего прочего. Чрезмерная избыточность понижает селективные преимущества.
Оптимальный по размеру комплект матричных и каталитических полимеров я низкомолекулярных веществ необходимый и достаточный для жизни — это элементарный организм, клетка. Такой организм должен обладать специфической поверхностью, отделяющей его от внешней среды и препятствующей вымыванию веществ, нарушению необходимого их комплекта.
Следовательно, биологическая целесообразность, т. е. предельно совершенная форма гибели, смерти достигается при разделении «вещества» данного вида на в некотором смысле независимо погибающие организмы. Размеры этих первичных организмов— клеток должны удовлетворять двум противоположным требованиям: с одной стороны, они должны быть достаточно большими, чтобы в них мог поместиться весь необходимый для автономного существования набор матриц, ферментов и прочих молекул, а с другой,— достаточно малыми для достижения наиболее интенсивного процесса естественного отбора наиболее экономным образом, а также для обеспечения требуемой поверхности взаимодействия с внешней средой.
Теперь на очередь становится задача рассмотрения биохимических механизмов отграничения от внешней среды, специфической биохимии клеточных поверхностей, клеточной оболочки.
Наиболее естественным механизмом построения оболочек клеток, образования дискретных порций живого вещества в водной среде, является создание гидрофобных границ раздела. Поскольку речь идет об отграничении гидрофильных биохимических систем (ферменты, матричные молекулы и другие основные биохимические компоненты по необходимости гидрофильны) от окружающей водной среды, первичная гидрофобная граница могла образовываться лишь детергентами, т. е. веществами-пиб- ридами, содержащими гидрофильные группы, обращенные внутрь клетки, и гидрофобные группы, обращенные наружу. Таким образом, появление дискретных форм жизни — особей, клеток сопряжено с возникновением системы синтеза биодетергентов (например, фосфолипидов). Замечательным свойством детергентов является их способность образовывать дискретные структуры (пленки, мицеллы, коацерватные капли, пузыри, пену [94, 261, 422]. Эта способность обусловлена взаимодействием сравнительно небольших молекул детергентов друг с другом и с молекулами среды посредством ван-дер-ваальсовых и электростатических сил. Эволюционная необходимость детергентов и липидов, возможная роль коацерватных структур, появляющихся в смесях детергентов и белков в процессе возникновения жизни, рассмотрены А. И. Опариным и сотрудниками [94, 261].
Ключевая роль детергентов в формировании дискретных особей (в том числе и прекрасных) вполне соответствует представлению о возникновении Венеры (Афродиты) из пены морской.
Возникновение клетки представляется следующим образом. В ходе эволюции появляются ферментные системы синтеза детергентов (например, фосфолипидов). Слой таких детергентов обволакивает комплект матричных молекул, молекул ферментов и низкомолекулярных метаболитов, образуя поверхностную мембрану. Синтез компонент мембраны строго регулируется — их количество должно соответствовать поверхности клетки.
Тут возникает непростая проблема: детергенты должны быть ориентированы, по-видимому, своими полярными группами внутрь клетки, а неполярными — наружу. Как достигается различение внутреннего и наружного;' Как предотвратить «нечаянное» выворачивание мембраны наизнанку? Это, по-видимому, возможно лишь посредством более или менее специфического взаимодействия с содержимым клетки, которое само не должно вытекать из нее и в отсутствии мембраны. Иными словами, должен существовать твердый каркас, на котором закрепляется мембрана. Этот каркас (наиболее вероятно — белковый гель) представляет собой трехмерную структуру, состоящую из фибриллярных макромолекул белка типа коллагена, тубулина или актина.
С другой, наружной, стороны не вся поверхность мембраны клетки должна быть гидрофобной — в противном случае произошло бы слипание клеток и стало бы невозможным необходимое для жизнедеятельности взаимодействие со средой. Следовательно, поверхностная мембрана должна обладать сложной структурой — ее обращенная внутрь сторона должна содержать химические группы, специфически соединяющиеся с внутренним каркасом, с внутриклеточными белками, а ее наружная сторона не должна быть однородно гидрофобной. Каркас, на который натягивается, к которому прикрепляется поверхностная мембрана, необходим, как мне кажется, и для того, чтобы эта мембрана не отделялась от клетки. В самом деле, детергентный слой вполне может образовать автономную структуру, и не обволакивающую клетку. Поэтому нужно, чтобы взаимодействие мембранных детергентов с каркасом было бы более сильным и специфичным, чем взаимодействие одной молекулы детергента с другой. Ясно, что такое обволакивание мембраной внутриклеточного содержимого нельзя обеспечить лишь за счет неспецифических электростатических или гидрофобных взаимодействий.
Много лет назад Н. К- Кольцов обнаружил, что форма клеток определяется формой каркаса, состоящего, как он считал, из коллагеновых волокон [144]. В последние годы весьма интенсивно развиваются исследования фибриллярных структур, определяющих форму клеток. Эти структуры состоят из так называемых микрофиламентов. Основная компонента микрофила- ментов — актин, т. е. один из двух главных белков мышц [392, 393]. Микрофиламенты расположены непосредственно под мембраной клетки. Однако, насколько мне известно, вопрос об их взаимодействии с мембраной не изучен. Неясно также, следует ли исключить предположение о коллагеновом каркасе. Возможность участия коллагена в таком каркасе следует из опытов по созданию на нем искусственных возбудимых липопротеидных мембран [369].
Итак, по указанным выше причинам предельно совершенные биохимические системы оказываются представленными в виде дискретных порций живого вещества. И эта дискретность осуществляется посредством биосинтеза специализированных де- тергентных молекул, по-видимому, спонтанно образующих граничные и прочие мембраны клеток. Мы видим, что и в этом случае все необходимое разнообразие свойств поверхностей клеток можно получить «наборным» методом — посредством должного сочетания относительно небольшого числа универсальных компонент — букв (фосфолипидных и прочих), составляющих слова «мембранного языка». Однако в отличие от полипеп- тидного и полинуклеотидного языков в мембранном языке не нужен строго детерминированный порядок слов и даже букв в слове, а достаточно, чтобы в данной структуре слова и буквы были представлены в должных соотношениях. Поэтому при наличии специфического белкового каркаса нет необходимости в соединении отдельных молекул в мембранных структурах валентными или строго определенными водородными связями — вполне удовлетворительные результаты достигаются и при соединении молекул ван-дер-ваальсовыми и электростатическими связями. Действительно замечательным свойством системы липиды— детергенты — вода является способность к автоматической самосборке мембран [307а, 422]. Мембраны в этом смысле вполне детерминированы физическими и химическими свойствами компонент самой системы. Особенности строения возникающей мембраны зависят почти исключительно от того, какие липиды, детергенты, электролиты и неэлектролиты содержатся в системе и в каком количестве. Следовательно, свойства мембраны определяются характером и интенсивностью биосинтетических процессов в протоплазме. Так, число и качество дефектов в мембране, мест, где плотная упаковка молекул (например, лецитина) нарушена, зависит от концентрации в системе других детергентных молекул. В конечном итоге, свойства мембраны записаны в соответствующих матричных текстах, определяю- ющих синтез в нужном месте и в нужное время необходимых ферментов, и задаются оперативным изменением активности уже синтезированных ферментов.
Попробуем представить себе возможные механизмы функционирования поверхностных клеточных мембран. Их функция состоит в избирательном пропускании одних веществ и не пропускании других, причем должно осуществляться как движение веществ по термодинамическому градиенту (из места с более высокой концентрацией в места с меньшей концентрацией), так и противоградиентное движение.
Ясно, что противоградиентное движение веществ может осуществляться лишь при использовании свободной энергии в каком-либо сопряженном экзэргоническом процессе.
Один из мыслимых способов противоградиентного перемещения состоит в уничтожении нормального градиента концентрации переносимого вещества. Это может осуществляться посредством связывания поступившего вещества в кинетически (осмотически) неактивный комплекс или же его вовлечения в какой-либо химический процесс. Так, глюкоза может исчезатьв процессе образования из нее гликогена, аминокислоты — в процессах синтеза белка и т. д.
В этих случаях не возникает принципиальных трудностей в представлении исходных шагов эволюционного совершенствования. Задача такой мембраны — обеспечение лишь грубой избирательности, наличие в ней дырок, пор, позволяющих нужным веществам двигаться (диффундировать) по «искусственному» градиенту и препятствующих вытеканию протоплазмы. Я подчеркиваю слово вытекание, так как именно в препятствии макроскопическим потокам жидкости и состоит первоначальная функция мембран. Множество микродырок не мешает макроскопической функции мембраны. Так, пористые, ячеистые например, вязанные свитеры и даже крупноячеистые вуали, ограничивая макроскопические потоки воздуха, сохраняют прикожный нагретый слой воздуха, и поэтому «греют» людей.
Регулирование свойств такой мембраны также может быть очень грубым — нет нужды в специальной подгонке диаметра пор к размеру проходящих через мембрану молекул.
Однако задача усложняется тем, что в биохимических процессах с необходимостью должны участвовать и низкомолекулярные промежуточные продукты, не все время пребывающие в комплексах с макромолекулами.
Таким образом, сведение избирательности переноса веществ к биохимической специфичности — к .избирательному вовлечению веществ в соответствующие биохимические процессы, лишь первый шаг эволюционного совершенствования трансмембранной системы переноса веществ.
Какие пути увеличения избирательности проницаемости мембран могут существовать в процессе эволюции?
Конечно, можно представить себе такое состояние протоплазмы, при котором все низкомолекулярные компоненты биохимических процессов оказываются в специфических комплексах с макромолекулами. Для его реализации нужно, чтобы образование этих комплексов было термодинамически выгодным. Величина выигрыша энергии при образовании комплекса низкомолекулярного вещества с макромолекулой и определит возможность «противоградиентного» переноса данного вещества. Слово «противоградиентный» взято в кавычки, поскольку в этом случае никакой противоградиентности нет — связывание вещества уменьшает его осмотическую, кинетическую активность. В месте образования комплекса создается активность (концентрация), меньшая, чем в других местах. Остается позаботиться
о том, чтобы не вытекали сами макромолекулярные комплексы, а это обеспечивается образованием наружной дырявой, сетчатой мембраны или же соединением всех или большей части макромолекул в трехмерную сеть — гель. Такие желеобразные дискретные организмы в принципе удовлетворяют условиям дискретности и стабильности оптимальных по размерам комплектов матричных молекул, ферментов и метаболитов.
Однако скорости биохимических процессов в таких организмах будут далеко не предельно возможными. Скорости транспорта субстратов и продуктов в биохимических системах, где все участники связаны с макромолекулами геля, очень малы. Условием быстрого протекания биохимических процессов является свободное, неограниченное соединением с макромолекулами движение низкомолекулярных веществ в протоплазме. Эволюция должна обеспечить максимум скорости узловых биохимических процессов без специальных уже нехимических приспособлений и это достигается при совершенно незатрудненной диффузии.
Следовательно, среда, в которой протекают наиболее важные биохимические процессы, должна быть жидкой *. В этой маловязкой бесструктурной жидкой среде могут находиться относительно небольшие компактные структурные образования — митохондрии, хлоропласты и пр., но основная среда должна быть жидкой и основные метаболиты в ней не должны быть связаны с гелеобразным комплексом. Большинство низкомолекулярных метаболитов (субстратов, ионов металлов, анионов, кофермен- тов и пр.) в соответствии с требованием максимально возможной скорости протекания узловых биохимических процессов должно свободно диффундировать в маловязкой жидкой протоплазме. Следовательно, крупно-ячеистая мембрана служит недостаточно совершенной границей раздела организма и внешней среды, так как она не будет препятствовать утечке метаболитов. Мембрана должна обладать избирательной проницаемостью.
Приведенное рассуждение, т. е. вывод о невозможности обеспечения должной интенсивности биохимических процессов в клетке при осуществлении специфического переноса веществ посредством специфического связывания в толще протоплазмы, имеет прямое отношение к недавней острой дискуссии. Д. Н. Насонов и его последователи [220, 221] полагали, что именно специфическое связывание в протоплазме лежит в основе механизма избирательного противоградиентного переноса. Д. Л. Рубинштейн [246, 247] наиболее ярко представлял противоположную точку зрения, а именно необходимость существования избирательно проницаемых клеточных мембран. За прошедшие после дискуссии годы наши знания о механизмах специфического переноса веществ в биологических системах чрезвычайно расширились и углубились. Ключевая роль мембран давно уже не вызывает сомнений. Однако механизм специфического связывания отнюдь нельзя считать полностью отвергнутым. Из общих соображений, приведенных выше, следует лишь, что внутриклеточное связывание низкомолекулярных веществ как способ проти- воградиентного транспорта не совместимо с высокой скоростью биохимических процессов. Однако в ряде специальных случаев внутриклеточное связывание может оказаться очень эффективным.
Мы видим, следовательно, что в ходе эволюции возникли несовместимые требования—с одной стороны, необходимо жидкое состояние значительной части внутриклеточного содержимого, несвязанное состояние внутриклеточных низкомолекулярных веществ (пока они не включаются непосредственно в ферментативные процессы), свободная их диффузия, а с другой, необходим строго специфичный противоградиентный перенос через клеточную мембрану. Выход из этого положения может состоять в постулировании аппарата специфического связывания и переноса веществ, сосредоточенного в мембране или примембранных слоях, и в сопряжении процессов переноса с расходом макро- эргических соединений (или в более общей формулировке — сопряжении эндэргонического переноса с каким-либо экзэргониче- ским процессом).
Истинные механизмы специфического трансмембранного транспорта все еще не вполне выяснены. Этим вопросам посвящен ряд фундаментальных исследований (см. [5, 33, 48, 62, 158, 171, 172, 177, 178, 180, 197, 225, 226, 285, 314, 365, 383, 434, 435, 451, 459]), к которым и должен обратиться читатель. Тем не менее, в общем виде ответ известен. Противоградиентный перенос осуществляется или за счет свободной энергии гидролиза пирофосфатной связи АТФ или за счет распада ее макроэрги- ческого предшественника. Специфичность транспорта веществ через мембрану достигается либо путем связывания этих веществ со специфическими молекулами белков-переносчиков, либо посредством калиброванных пор [399].
Целостность поверхностной мембраны — условие существования клетки. Раздражимость и возбудимость. Ясно, что повреждение поверхностной оболочки (клеточной мембраны) должно приводить к гибели клетки. Нарушение целостности мембраны сопряжено с потерей внутриклеточного содержимого и вхождением в клетку вредных компонент из внешней среды. Условием дальнейшего эволюционного прогресса оказывается теперь выработка быстрой реакции на повреждение. Эта реакция должна быть сопряжена с включением (и выключением) определенных биосинтетических систем, например, с включением системы интенсивного синтеза фосфолипидов и белков. Таким образом, очередная задача эволюции состоит в выборе предельно совершенного вида сигналов о целостности и нарушении целостности клеток. Кажется разумным предположить, что эти сигнальные функции могла бы выполнять относительно безвредная компонента внешней среды, всегда присутствующая в достаточных количествах в первичной среде обитания древних организмов. Для выбора такой компоненты необходимо выяснить состав первичной среды обитания живых организмов.
При таком анализе становятся ясными следующие выводы. Жизнь возникла в море. Химический состав морской воды определен составом земной коры, физическими и химическими свойствами ее компонент, а следовательно, химическим составом планеты. Высокая вероятность возникновения жизни именно в море подчеркивалась почти всеми. Мне также кажется это почти бесспорным. Море замечательно своей стабильностью. Химический состав морской воды определился условиями ее возникновения я существования. Первичная вулканическая вода — «рассол»—содержала все растворимые компоненты коры в соотношениях, определяемых как концентрацией этих компонент в коре, так и их относительной растворимостью. Однако по мере фильтрации извергаемой вулканами воды через образующиеся и уже образовавшиеся осадочные породы — глины (алюмосиликаты с разным содержанием железа и алюминия) из первичного рассола избирательно извлекался калий (по причинам, хорошо изложенным Г. Г. Маленковым), а в воде, стекающей в море, оказывалась повышенной концентрация натрия. Избирательное сродство сэндвичевых алюмосиликатов (глин) к калию настолько велико, что уже в первых слоях глины, соприкасавшихся с первичным рассолом задерживалось основное количество калия, и состав профильтрованного раствора приближался к составу морской воды. Свойство глин избирательно накапливать калий делает их в этом отношении похожими на «живое 1вещество» (и оправдывает распространенную ранее гипотезу об изготовлении первого человека из глины...).
Ниже приводятся округленные данные о составе морской воды (табл. 7).
Солевой состав плазмы крови различных животных, характерный для земных организмов, приведен в табл. 8, 9 [68].
Из приведенных данных видно сходство (а иногда даже совпадение) соотношения концентраций ионов в плазме крови животных и морской воде. Однако по абсолютным величинам содержание солей в морской воде отличается от солености плазмы крови — в морской воде почти в 3 раза больше натрия, в несколько раз меньше калия и почти в 12 раз больше магния. Сторонники идеи о том, 4i(j в наших жилах течет, в сущности, мор-таблица 7
КОНЦЕНТРАЦИЯ ОСНОВНЫХ КОМПОНЕНТОВ МОРСКОЙ ВОДЫ *
Вещество
%
м
Вещество
%
м
Натрий
10,56
0,44
Стронций
0,01
1,3-10-4
Калий
0,38
0,0095
Хлор
18,98
0,535
Магний
1,27
0,047
Сульфаты
2,65
0,028
Кальций
0,40
0,0096
Карбонаты
0,14
0,0023
* Данные заимствованы из 2-го издания БСЭ.
ТАБЛИЦА 8
СООТНОШЕНИЕ КОНЦЕНТРАЦИЙ ИОНОВ В ПЛАЗМЕ КРОВИ ПОЗВОНОЧНЫХ И В МОРСКОЙ ВОДЕ (%) [68]
Позвоночные
Калий
Кальций
Магний
Млекопитающие
3,6
1.9
0,8
Птицы
3,2
—
Пресмыкающиеся
4,1
—
Амфибии
5,8
1,9
1,1
Рыбы
5,3
Морская вода
3,6
3,9
12,1
Примечание. Концентрация натрия принята равной 100%.
ТАБЛИЦА 9
КОНЦЕНТРАЦИИ ИОНОВ В ПЛАЗМЕ КРОВИ (ММОЛ/Л) [68]
Позвоночные
Натрий
Калий
Кальций
Магний
Человек
145
5,12
2,49
1,23
Курица
141
4,2
Черепаха
122
5,1
Лягушка
102
5,9
2.0
1,2
Окунь
88
5,1
ская вода, не смущаются различием в абсолютных величинах содержания катионов. На протяжении сотен миллионов лет геологической эволюции солевой состав моря изменялся: осадочные породы поглощали все больше калия, при эрозии коры выщелачивались все большие количества натрия и т. д. Таким образом, если учитывать все эти изменения, то кровь (вернее, плазма крови) современных животных аналогична по своему солевому составу воде древних морей. Выйдя в давние времена из древ
них морей, животные унесли в своих кровеносных сосудах привычную и необходимую для существования их клеток среду, ставшую теперь внутренней средой организма.
Поддержание необходимого состава этой внутренней среды — одно из главных направлений физиологической работы многоклеточных организмов — их прото- или мезо- или метанефридии (почки) расходуют огромное количество энергии, сопоставимое с количеством энергии, затрачиваемым сердцем и скелетными мышцами (см. [436]).
Эти траты необходимы для обеспечения строго определенных условий существования клеток. Солевой состав, концентрация катионов и анионов в клетке и их соотношение совсем иные, чем во внешней по отношению к клеткам среде — в морской воде и в жидкости межклеточных пространств (табл. 10).
ТАБЛИЦА 10
КОНЦЕНТРАЦИЯ Ионов В ТКАНЯХ И ЖИДКОСТЯХ ТЕЛА (в мМ) [68]
Животное
Ткань или жидкость тела
Натрий
Калий
Кальций
Магний
Хлор
Крыса
Плазма крови
145
6,2
3,1
1,6
116
Мышца
27
101
1,5
11,0
16
Лягушка
Плазма крови
104
2,5
2,0
1,2
74
Мышца
24
85
2,5
11,3
10
Беззубка
Кровь
15,4
0,38
5,3
0,35
10,5
Мышца
5,2
10,5
5,4
2,46
10,6
Осминог
Кровь
525
12,2
11,6
57,2
480
Мышца
81
101
3,7
12,7
93
Голотурия
Жидкость тела
460
11,8
10,7
50
523
Мышца
191
139
89
39
277
Не имея сейчас возможности отвлекаться на рассмотрение своеобразия солевого состава клеток и внутренней среды разных животных, подчеркнем лишь одно. У большинства живых существ на Земле все полноценные живые клетки содержат натрий в концентрациях, значительно меньших, чем в морской воде или во внутренней среде организмов. Наоборот — концентрация калия в клетках во много раз выше, чем во внеклеточной среде.
Итак, мы забежали вперед — вместо дедуктивного построения предельно совершенного дискретного организма, клетки, мы сразу заглянули в ответ — посмотрели, что же получилось на Земле. Мы и дальше будем так иногда поступать, поскольку вполне «честное» решение эволюционных задач в ряде случаев еще невозможно. Зато мы можем с удовлетворением считать, что нам удалось выяснить, решению какой эволюционной задачи соответствует известный нам ответ. Итак, ответ гласит: калия в клетке больше, а натрия меньше, чем в среде, ее окружающей. Мы знаем (зернее думаем, что знаем) в чем здесь дело, каков эволюционный смысл такого соотношения концентраций.
Поддержание градиента концентрации такого химически вполне безобидного иона, как ион натрия (или калия), позволяет клетке быть в постоянной готовности к реакции на случай повреждения (а в дальнейшем, при совершенствовании этого механизма,—уже л,ишь при угрозе повреждения). Изменение градиента концентрации служит сигналом для принятия защитных мер, прежде всего для включения механизмов синтеза пограничного вещества — липидов и белков клеточной мембраны. Необходима тонкая регулировка процесса биосинтеза элементов мембраны (как и других биосинтетических процессов — синтезов ферментов и матриц). В самом деле, избыточный синтез делает жизнь невозможной — клетка переполняется веществом, на избыточный синтез напрасно расходуется вещество и энергия. Таким образок, возникает необходимость непрерывного (пока существует опасность повреждения) поддержания готовности к реагированию, к раздражению и возбуждению. Для этого приходится все время поддерживать искусственный градиент концентрации химически безвредных сигнальных веществ — ионов натрия и калия. Постоянная боевая готовность клетки обычно сопряжена с непрерывным расходом энергии. В неблагоприятных солевых условиях расходы на поддержание необходимого градиента могут превысить возможности клетки. Тогда становится «дешевле похоронить, чем прокормить».... На этом основано использование в качестве консервирующего средства поваренной соли —в сильно соленой среде истощаются и гибнут нежелательные нам микроорганизмы. Поэтому безжизненны резко соленые водоемы и столь мало пригодны для жизни солончаки (см., однако, стр. 141).
Необходимость непрерывного поддержания асимметрии распределения нонов натрия и калия в системе клетка — внешняя среда вовсе не означает, что этот механизм должен все время функционировать.
Было бы нерационально, бессмысленно непрерывно откачивать воду из дырявой лодки. Во всяком случае, ни о каком совершенстве тут говорить нечего. Необходимый градиент можно сохранить, закрыв пробоины. Конечно, умеют это делать далеко не все органязмы, а лишь специально приспособленные к жизни в необычных условиях чрезмерной солености или пресности. Физиология и биология приспособлений к жизни водных организмов при разной степени солености рассмотрена [311].
Итак, первичный механизм реагирования клеток на повреждение (раздражение) был, по-видимому, основан на изменении внутриклеточной концентрации ионов калия и натрия.
Мерой градиента концентрации ионов является электрохи
мический потенциал. Для реагирования на внешние воздействия вовсе не обязательно доводить дело до грубого повреждения клетки — функции сигнала может взять на себя изменение электрохимического потенциала. Ясно, что обязательным компонентом такого механизма должен быть процесс резкого активирования биосинтеза биодетергентов и белков. Следовательно, процессы считывания текста нуклеотидных матриц и синтезы необходимых ферментов, а также, быть может, активность уже готовых молекул ферментов должны быть чувствительны к уровню концентрации одновалентных катионов.
Так возникает в процессе эволюции электрофизиологический механизм, детальное рассмотрение которого выходит за пределы задач этой главы.
Нам остается, однако, обсудить здесь еще один важный вопрос: почему в процессе эволюции на Земле возникла именно такая ионная асимметрия.
Мы 'Считали, что ионная асимметрия, т. е. «противоестественный» градиент концентраций возник как эволюционное следствие необходимости клетки реагировать на повреждение. Однако мы уже видели, что в «простых» глинах происходит резко избирательное накопление калия, и, следовательно, возникает ионная асимметрия, а именно, натрий остается вне глины, калий проникает внутрь. Строго говоря, в глине никакого противогра- диентного накопления калия нет. Напротив, строго по предписаниям термодинамики калий заполняет пустоты в структуре сэндвичевых глин, в результате чего свободная энергия системы понижается [192]. В глиняной модели живого организма можно предусмотреть и реагирование на повреждение. В самом деле, всякое нарушение целостности сопряжено с механическим воздействием. А глина, как и другие гелеобразующие материалы, тиксотропна, т. е. разжижается при механическом воздействии (вот почему в мокрой глине ноги вязнут тем сильнее, чем интенсивнее попытки выбраться). Нарушение структуры тиксотроп- ных гелей — вполне удобный в принципе механизм раздражения, который может включить необходимые для восстановления целостности клетки процессы биосинтеза.
Таким образом, даже изменение ионной асимметрии — выход калия ,и вход натрия в «глиняную клетку» — вполне можно считать следствием, а не условием раздражения и возбуждения клетки. Для этого необходимо только, чтобы при тиксотропном разрушении структуры глины изменялось бы ее сродство к калию. И в самом деле, почему бы не считать такой тиксотропный механизм, механизм перехода гель — золь вполне соответствующим эволюционным задачам? Почему бы не считать ионную асимметрию лишь следствием структурных особенностей прото- плазматических структур?
Выбор правильного решения здесь очень не прост. Ведь мы должны найти доводы, основанные на убедительных общих соображениях, а не только на сведениях о механизмах жизнедеятельности земных организмов.
Я уже отмечал, что еще очень недавно исследователи были разделены на два непримиримых лагеря — сторонников сорбционной теории, возглавляемых Д. Н. Насоновым, и сторонников мембранной теории во главе с Д. Л. Рубинштейном. Темпераментные, не всегда академические споры завершились во втором поколении противников победой мембранной теории. Она восторжествовала благодаря замечательным достижениям в изучении биоэлектрических явлений на гигантских аксонах кальмаров и других удобных объектах. В самом деле, можно перфу- зировать, промыть гигантский аксон, удалить из него всю протоплазму— а способность к раздражению, к генерации нервного импульса останется. Более того, можно получить искусственную- возбудимую мембрану, обладающую всеми основными свойствами естественной [434, 435]. Следовательно, функция аксона и. в самом деле обусловлена лишь его мембраной. Следовательно, ионная асимметрия и в самом деле создается без участия избирательной сорбции ионов в толще внутриклеточной протоплазмы.
Мы уже очень много знаем о природе избирательных ионных насосов, локализованных в клеточной мембране. Их функцию' выполняют ферменты, аналогичные асимметрично расположенной в мембране К, Na-эктивируемый АТФазе (см. [33, 180, 459]), в сочетании с избирательно проницаемыми каналами.
Мы все больше узнаем о свойствах и природе веществ, модифицирующих проницаемость био-мембран. Все это так. Однако еще раз подчеркиваю — нам нужно понять, в силу каких причин в процессе эволюции возникли именно такие механизмы? Один из возможных ответов гласит: данное приспособление возникло как неизбежное следствие физических и (или) химических свойств веществ, вовлеченных в процесс эволюции. В духе такого ответа можно сказать, что ионные градиенты, противотер- модинамлческая асимметрия ионов в системе клетка — внешняя среда возникли как неизбежное следствие образования биоде- тергентных мембран. Если в силу эволюционной необходимости в дискретности живого вещества появились мембраны, отграничивающие клетки от внешней среды, то вследствие физических и химических свойств этих мембран, их избирательной проницаемости возникла и ионная асимметрия. Ионная асимметрия оказалась весьма удачным показателем целостности клетки и в ходе дальнейшей эволюции смогла обеспечить реагирование клетки на внешние воздействия.
Очень возможно, что такой ход рассуждений верен. Однако тиксотропия, превращение геля в золь — важнейший физико-хи- мический процесс в протоплазме как современных, так и древних земных организмов. Мало того, этот процесс представляет неспецифический универсальный ответ клетки на различные воздействия. Я думаю, однако, что процесс превращения гель — золь не был выбран в ходе эволюции как универсальный ответ на нарушение целостности клетки по вполне простой причине — отнюдь не любые повреждения клетки сопровождаются механическими воздействиями, вполне вероятны и повреждения в результате химических воздействий. А «тихое» растворение мембраны клетки не менее опасно, чем ее разрыв в результате свирепого укуса.
И все же, почему натрий снаружи и калий внутри? В настоящее время мне кажется вполне убедительным ответ на этот вопрос, предложенный В. А. Твердисловым [285]. Натрий не потому изгоняется из клетки, что он изначально был менее желателен, чем калий. И калий входит в клетку не из-за своих особых химических или физико-химических достоинств. Дело обстояло, по-видимому, проще: при концентрациях этих катионов в древнем океане только их можно было использовать для сигнализации о целостности клетки. Однако для создания электрохимического потенциала, при котором концентрация «атрия внутри клетки была бы больше, чем в окружающей среде, необходимы очень высокие концентрации ионов натрия в клетке — порядка нескольких молей на 1 л, что весьма существенно изменило бы всю физико-химическую обстановку в клетке. Наоборот, калия в среде, в морской воде настолько мало, что даже при его вполне безобидных концентрациях внутри клетки порядка 0,1 моль!л, соотношение концентраций К внутри и снаружи оказывается достаточным для асимметричного распределения натрия и создания заметного электрохимического потенциала.
Из приведенного рассуждения следует, что при осуществлении эволюции в других условиях (если это возможно), при другом ионном составе среды вполне могут возникнуть организмы с другим набором сигнальных ионов внутри и вне клетки.
В земных организмах происходят биохимические процессы, в которых роли ионов натрия и калия противоположны. Так, существуют ферменты, активность которых увеличивается в присутствии ионов калия и угнетается в присутствии ионов натрия (см. табл. 6). Однако в соответствии с приведенным логическим построением специфическое, сигнальное значение должны иметь биохимические процессы синтеза компонент мембраны, включаемые поступающим в клетку натрием (при раздражении мембраны). Число известных нам ферментных систем, включая активируемых натрием, очень невелико (табл. 11).
В этой связи необходимо сказать, что, как следует из ряда работ [48, 62, 292, 451], влияние натрия на биохимические системы опосредовано ионами кальция. Ионы натрия, проникая внутрь клетки, вызывают изменение состояния ионов кальция — их переход из связанного в свободное состояние. Действительным исполнителем сигнальных функций в клетке, звеном, связывающим изменение состояния мембран с внутриклеточной
ТАБЛИЦА II
ВЛИЯНИЕ ИОНОВ № И К НА НЕКОТОРЫЕ БИОХИМИЧЕСКИЕ ПРОЦЕССЫ [62]
Фермент или ферментативный процесс
Иои-
актива-
тор
Иои-
ингиби-
тор
Фермент нли ферментативный процесс
Ион-
актива
тор
Иои-
ингиби-
тор
Синтез ацетилхолина
к+
Na+
РНК-полимераза
к+
Синтез белка на рибосомах
к+
Na+
ДНК-полимераза
к+
Na+
Синтез липидов
Na+
—
Фосфофруктокинззн
к+
—
Дыхание митохондрий
К+
Na+
биохимией, является кальций. Число ферментов (ферментных систем), активируемых ионами кальция очень велико.
Из табл. 11 следует, что все внутриклеточные ферментативные процессы, по-видимому, приспособились к нормальной ионной асимметрии, тогда как синтез липидов включается при увеличении концентрации Na+ — сигнала о возможном повреждении клеточной мембраны. К сожалению, надежных экспериментальных данных по этим вопросам очень мало [449],
Возможно и другое решение проблемы ремонта поврежденной мембраны в ответ на увеличение концентрации ионов натрия в клетке. Опыт показывает, что вытекающая из поврежденной клетки протоплазма немедленно покрывается вновь возникающей липопротеидной мембраной (см., например, [5, 462]). Это происходит так быстро, что говорить о включении биосинтеза, как источника материала для новой мембраны, нельзя. Некоторый аварийный запас фосфолипидов и белков для быстрой сборки мембраны в клетках имеется. (Тем не менее биосинтезы должны быть включены для восполнения этих запасов). Процесс образования поверхностной мембраны при повреждении клетки был предметом глубоких исследований и широких обобщений Л. Генльбруна [64, 396, 397]. Гейльбрун считал, что эта «поверхностная реакция преципитации» осуществляется при действии ионов кальция аналогично механизму свертывания крови. Новообразованию мембраны на вытекающей из клетки капле протоплазмы, в соответствии с этой гипотезой, происходит в результате превращения белка типа фибриногена в полимери- зующийся белок типа фибрина (и лишь затем по возникшему белковому каркасу выстраивается липопротеидная мембрана).
В заключение мне хочется обратить внимание на возможность непосредственного влияш-я ионов натрия на образование мембраны. Натриевые соли жирных кислот менее растворимы, чем калиевые: все знают, что калиевое мыло жидкое, а натриевое твердое. Вполне возможно поэтому, что проникновение в примембранный слой клетки ионов натрия стимулирует самосборку мембраны из уже имеющегося запаса липидов, фосфолипидов, жирных кислот — аналогично превращению жидкого калиевого мыла в твердое натриевое.
Глава 7
БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ПРЕВРАЩЕНИЯ ЭНЕРГИИ
Создание системы энергетического обеспечения конвариантного матричного воспроизведения.
Свет — первичный источник энергии в биохимических системах. Накопление буферных рН-систем в фотохимическом преобразовании энергии. Макроэргические соединения.
Общие механизмы сопряженного фосфорилирования. Концепция Митчелла.
Гетеротрофы.
Рост кристаллов, образование полимерных молекул и аналогичные процессы завершаются при исчерпании термодинамического потенциала системы, например, тогда, когда раствор перестает быть насыщенным. Представим себе, что некоторые виды кристаллов (полимеров) могут возникать при меньших концентрациях предшественников, чем другие менее совершенные виды. Ясно, что такие более совершенные кристаллы, полимеры и победят в естественном отборе.
Кристаллизация и полимеризация, происходящие вопреки термодинамическому, концентрационному градиенту из истощенного раствора, в принципе осуществимы при сопряженном протекании экзэргонической реакции, в которой равновесие кристаллизации или полимеризации может сместиться в противогради- ентном направлении. То же справедливо и для синтезов.
Однако необходимость сверхравновесного синтеза — не единственная причина вовлечения под давлением естественного отбора источников энергии для конвариантного воспроизведения.
Совершенный процесс соединения мономеров в полимерную матричную цепь должен быть термодинамически невыгодным, требовать для своего осуществления подвода свободной энергии, быть эндэргоническим. Здесь под «должен быть» подразумевается «в результате эволюции» или «чтобы была возможной прогрессивная эволюция». В самом деле, если бы полимеризация была экзэргонической, термодинамически выгодной и полимерные цепи возникали бы -самопроизвольно, то сколько появилось бы ошибок в последовательности мономеров в полимерных нитях. Ведь нужно помнить, что любые последовательности мономеров в полимерных полинуклеотидной или полипептидной цепях термодинамически равновероятны[9]: необходимбарьер, препятствующий соединению мономеров. Полимеризация должна быть термодинамически невыгодной, должна осуществляться лишь при контролируемом подводе энергии
В ходе эволюции возникает еще одна энергетическая статья расходов, составляющая в дальнейшем значительную долю от общих потребностей. Чем совершеннее катализатор, тем он сложнее, тем вероятнее его разрушение в ходе функционирования, а также в результате термической денатурации. Становится необходимым восстановительный синтез, необходимы траты энергии для компенсации износа макромолекулярных механизмов.
Наконец, в процессе эволюции все время возрастают траты энергии на активное добывание пищи, активное создание необходимых внутренних и внешних условий существования.
Итак, энергия необходима для самого процесса полимеризации мономеров, для проведения этого процесса против концентрационного градиента, для компенсации износа и для обеспечения активной жизнедеятельности.
Посмотрим теперь, какие источники энергии могут быть использованы в ходе эволюции. Оценим сначала количество энергии, требуемой для обеспечения указанных выше нужд. Например, процесс синтеза пептидной связи относится к эндэргоничес- ким реакциям — для синтеза 1 моля пептидных связей необходимо затратить 3—4 ккал свободной энергии. По-видимому, когда- нибудь удастся из общих соображений оценить и желательную величину сверхравновесного синтеза. Допустим, что сверхравно- весная концентрация продукта в 105—106 раз превышает величину, определяемую термодинамическими соотношениями. В соответствии с известными термодинамическими формулами на это потребуется еще 7—8 ккал/моль:
С С
AF = - RT 1п ~ ж - 1400 lg кал,
где С, и С2 — концентрации исходных реагентов и конечных продуктов соответственно. Так, для обеспечения выбранной сверх- равновесной степени полимеризации аминокислот приходится тратить около 10 ккал на синтез 1 моля пептидных связей. Близкие по порядку величины мы получим при оценке энергетических расходов и в других процессах. Эти относительно очень небольшие порции энергии всего в 10—20 раз превышают kT. Кванты такой величины соответствуют инфракрасному излучению (длины волн около 3—1,5 мк), которое поглощается вследствие возбуждения колебательных степеней свободы многими органическими веществами. Казалось бы все в порядке — инфракрасное излучение может быть искомым источником энергии для наших целей. Однако оно сильно поглощается водой (недаром ИК- спектры органических молекул снимают обычно в безводных препаратах). Поэтому волны такой длины практически исключаются из числа возможных источников энергии. Следовательно, источником энергии может служить излучение, непоглощаемое водой. Значит, речь может идти о видимом свете (поэтому и видимом!) и об ультрафиолете. Короткий ультрафиолет также не годится, так как энергия соответствующих квантов сравнима по величине с энергиями связей в молекулах — будет происходить разрушение молекул.
Первичный источник энергии в биохимической эволюции. Вслед за В. П. Скулачевым [266] можно считать наиболее вероятным источником энергии во времена возникновения жизни свет. Этот вывод означает допущение первичности фотосинтеза, возникновения его в самом начале совершенствования систем энергетических превращений в биологических системах. Конечно же, речь не идет о процессе, подобном современному фотосинтезу. Ясно, что только избирательное поглощение излучения способно обеспечить энергией лишь определенные процессы, а не все реакции, как, например, при нагревании. В процессах, идущих в первичных матричных структурах, существование такой избирательности вполне вероятно. Для нуклеиновых оснований характерно сильное поглощение в области 260 нм, что соответствует (в расчете на 1 моль) порции энергии около 100 ккал. Это, конечно, слишком много, но для начала эволюционного совершенствования вполне терпимо. Основной результат поглощения света с такой длиной волны полинуклеотидными цепями — разрыв валентных связей [154], например, отрыв нуклеинового основания от рибозы, замена одного основания на другое. Вследствие интенсивных мутаций и обусловленных ими вариаций последовательности аминокислот в полипептидной цепи происходил отбор катализаторов, способствующих синтезу пигментов, которые поглощают видимое и ближнее инфракрасное излучение, соответствующее нужным квантам энергии.
Таким образом, действительный прогресс в эволюции биохимических механизмов преобразования энергии сопряжен с совершенствованием биосинтезов пигментных систем, преобразующих лучистую энергию света в химические формы энергии.
Нужно заметить, что и в этом направлении эволюция начиналась не «на пустом месте». Разнообразные пигменты легко синтезируются и без биохимических катализаторов из первичного бульона, содержащего аммиак, цианид, формальдегид, под действием например ультрафиолетового излучения. (Эти вопросы рассмотрены в ряде статей и в докладах на симпозиумах, по
священных происхождению предбиологических систем, а также в книгах А. И. Опарина [227, 228], Дж. Бернала [24], М. Кальвина [126] (см. также [1, 37, 53, 75, 127, 132, 240, 243, 250, 416, 448]).
Биологически наиболее важные пигменты — порфирины образуются -в среде, содержащей метан, аммиак, воду и водород, под действием электрического разряда и ультрафиолета. Основной частью порфиринов являются пиррольные кольца. Еще в 1915 г. А. Е. Чичибабин показал, что пирролы образуются при пропускании ацетилена и аммиака через нагретую трубку. Примерно в то же время Мейер установил образование пирролов и при взаимодействии ацетилена с цианистым водородом. Конденсация пирролов в порфирины (тетрапиррольные кольца) также представляет собой обычный химический процесс.
Порфирины замечательны сильным поглощением света в областях 400 нм (полоса Соре, энергия жванта в расчете на 1 моль примерно равна 60 ккал), а также поглощения вблизи 550 нм (энергия в расчете на 1 моль около 45—50 ккал). Такие энергии, по-видимому, наиболее удобны для наших целей — они уже недостаточны для непосредственного разрушения молекул и более чем достаточны для сдвига химического равновесия. Приняв кпд процесса фотохимического преобразования энергии равным приблизительно 50%, мы получим за счет таких порций энергии увеличение концентрации продуктов реакции, идущей вопреки термодинамическому градиенту, в 1020 раз, что заведомо достаточно для синтеза любых необходимых веществ.
Осталось совсем немного — найти способ преобразования энергии поглощенного света в энергию, обеспечивающую специфический сдвиг равновесия реакций синтеза полинуклеотидной или полипептидной цепи. Для этого нам нужно прежде всего рассмотреть способы смещения термодинамического равновесия в химических превращениях.
Возможные способы смещения равновесия в эндэргонических химических реакциях. Самый очевидный способ смещения равновесия данной реакции — осуществление сопряженной реакции, уменьшающей концентрацию одного из продуктов реакции или увеличивающей концентрацию по крайней мере одного из реагентов. Этот простейший механизм сопряжения — основа химических синтезов.
Так, например, очевидно, что выход при синтезе пептидных связей можно существенно увеличить путем поглощения воды, образующейся при конденсации аминокислот:
Н ОН
II I
СООН -f H-N-R2 ^R!-C-N-R2 -f H20. (1)
Однако в интересующем нас случае этот способ непригоден: реакция должна осуществляться в водном растворе.
Процесс синтеза пептидной связи изображен здесь не вполне верно. В реакцию вступают обычно ионизированные реагенты и ее нужно записывать следующим образом:
О ОН
II II I
Ri-C—O' + H3N+-R2 ^ Ri—С—N—R2 + Н20. (2)
Ионы в водных растворах сольватированы, т. е. окружены ориентированными вокруг них молекулами воды. Для разрушения сольватной оболочки нужно затратить энергию, и поэтому синтез пептидной связи из ионизированных реагентов термодинамически менее выгоден. Следовательно, сместить равновесие в сторону синтеза пептидной связи можно посредством уменьшения степени ионизации (диссоциации) реагентов. Это можно сделать, проводя реакцию в кислой или щелочной среде, чтобы подавить диссоциацию на ионы карбоксильной или аминогруппы. Доведение pH до нужной величины и будет способом внесения в систему энергии, необходимой для смещения равновесия проводимой реакции в нужном направлении. Однако по мере осуществления синтеза величина pH будет изменяться. При проведении синтеза пептидной связи в кислой среде последняя будет все более закисляться:
О ОН
II I
Rj-C-OH 1- H3N+-R2 <1 Rj-C-N-Rz + Н20 + Н+, (3)
при проведении реакции в щелочной среде — все более защела- чиваться:
О ОН
II I
Ri-C-O- + H2N-R2 ^ Ri-C-N -R2 + ОН'. (4)
И в том и другом случаях накопление конечных продуктов отразится на положении равновесия — выход синтеза пептидных связей будет меньше. Таким образом, мало довести pH исходных реагентов до требуемой величины, необходимо еще поддерживать оптимальное значение pH во время реакции. Способ поддержания pH общеизвестен — нужен рН-буфер. Что такое рН- буфер? Это система, в которой осуществляется непрерывная сопряженная реакция нейтрализации избытка образующихся ионов Н+ и ОН-.
Пример с синтезом пептидной связи довольно сложен — оба реагента ионизированы. Обратимся поэтому к столь же важному нам процессу синтеза полинуклеотидной цепи. Как известно, нуклеотиды связаны в полинуклеотидной цепи посредством фосфатных остатков. Рассмотрим образование этой связи с термодинамических позиций. Запишем интересующую нас реакцию при pH выше 7.
н
о
о
RI-CH,-0-P-CT + H0-C = RfiRI-CHr0-P-0 + ОН , (5)
® L©

О'
где R, и Rn — соответствующие нуклеотиды. Напомним, что ор- тофосфорная кислота имеет три гидроксила с резко различной способностью к ионизации: первый гидроксил диссоциирует при pH около 2,5, второй — при pH около 7,0 и третий — при pH около 13 (номера гидроксилов фосфорной кислоты отмечены цифрами в кружках). Ясно, что равновесие синтеза будет смещено вправо (в сторону синтеза) в кислой среде и источником свободной энергии для этого синтеза может служить рН-буфер, поддерживающий pH близким к 6,0.
Что могло бы служить в этой реакции буфером? Таких веществ с рК близким 7,0 не так-то много — фосфаты, имидазоль- ные производные, система карбонат — бикарбонат и, пожалуй, все. Таким образом, если в среде, в растворе, имеется какая- либо фосфорнокислая соль, например, однозамещенный фосфат калия, то ионы гидроксила, образующиеся при реакции синтеза межнуклеотидной связи, будут нейтрализоваться за счет сопряженно идущего процесса диссоциации второго гидроксила в буферном фосфате.
Итак, рН-буфер является источником свободной энергии, необходимой для смещения положения равновесия в эндэргоничес- ких реакциях полимеризации — синтезе полипептидов и полинуклеотидов.
Естественно, что эту энергию сначала нужно затратить при образовании буферной системы. Таким образом, обычный рН- буфер является хранилищем свободной энергии, используемой сопряженно с эндэргоническими реакциями. Такая роль буферных систем в биохимии чрезвычайно распространена, настолько широко, что ее обычно не осознают биохимики. Мы еще не раз будем обращать внимание на энергетическую, термодинамическую роль буферных систем в биохимических процессах.
Итак, мы могли бы сдвигать равновесие синтетических процессов в сторону синтеза за счет сопряженного осуществления экзэргонических реакций, а именно, за счет нейтрализации возникающих ионов ионами противоположного знака, накопленными предварительно в соответствующих буферных системах, и фотохимического преобразования энергии поглощенного света. Непосредственное использование энергии света, прямое фотохимическое сопряжение мало совершенны: синтезы могут осуществляться лишь при освещении. А ночью, в ненастье, в тени, в пещерах? Буферные системы более совершенны — они служат хранилищами теруолинамического потенциала, расходуемого по
мере надобности в любое время. Но тогда главной для нас оказывается проблема создания и наполнения буферных емкостей.
Запасание впрок световой энергии становится основной проблемой совершенствования энергетического обеспечения биохимических процессов. Такое запасание, естественно, может осуществляться лишь посредством накопления фотохимических продуктов.
Накопление рW-буферных систем при фотохимических преобразованиях энергии является одним из способов запасания энергии на первых этапах биохимической эволюции.
Преобразование энергии фотохимических превращений в свободную энергию ионных, кислотно-щелочных резервов можно осуществить лишь посредством окислительно-восстановительных процессов (см. [95]).
Рассмотрим наиболее вероятный в естественных условиях и простой вид буферной системы — соли угольной кислоты, карбонаты и бикарбонаты. Карбонатно-бикарбонатная смесь служит депо, хранилищем термодинамического потенциала для реакций, сопровождающихся изменением pH. Эта буферная смесь поддерживает pH близким к 8,0. Если реакция сопровождается образованием ионов водорода (например, при добавлении HCI), в буферной системе происходит преобразование карбоната в бикарбонат; если же в реакции образуются гидроксильные ионы (например, при добавлении NaOH), бикарбонат превращается в карбонат:
Na2COa + Н+ + Cl' -» NaHC03 + NaCl, (6)
NaHC03 + Na+ + ОН- Na2C03 -f H20. (7)
Попробуем придумать простейший преобразователь энергии света в свободную энергию буферной pH-системы. Я говорю «простейший», имея в виду заведомо добиологический, вероятный для первичного бульона в планетных условиях. Наиболее удобным процессом для указанной цели представляется окислительно-восстановительное превращение железа — восстановление и окисление ионов железа с изменением валентности железа от 3+ до 2+ и обратно. В чем особая привлекательность именно железа? В его распространенности и окрашенности его ионов и их комплексов, т. е. в способности поглощать излучение видимого диапазона, излучение, соответствующее приемлемым для наших целей энергиям. Иными словами, можно не придумывать для начала никаких пигментов: вещество, претерпевающее окислительно-восстановительное превращение, притом минеральное и широко распространенное вещество, само является пигментом, поглощает свет в нужной области спектра. Правда, у минеральных соединений железа есть недостаток—обычно они малорастворимы и легко гидролизуются. Зато железо очень легко ■образует растворимые комплексные соединения типа красной K3Fe(CN)e и желтой K4Fe(CN)6 кровяных солей.
Но сначала не будем педантично рассматривать химические процессы во всей их сложности. Начнем с раствора треххлористого железа и его восстановительного превращения в двухлористое:
FeCl3 + 1е~ -» FeCl, + С1~. (8)
Итак, мы располагаем раствором FeCl3 в воде. В том же водном растворе имеется и рН-буферная система, а то, что она необходима, мы сейчас увидим.
В нормальных условиях для превращения Fe3+ и Fe2+ нужно затратить энергию. Мы будем вводить ее в систему в виде света, поглощаемого раствором хлорного железа *. Возбужденный ион трехвалентного железа Fe3+ может превратиться в ион Fe2+, отняв у какой-либо молекулы среды один электрон. Отнять электрон в разбавленном водном растворе можно лишь у иона гидроксила, образующегося при диссоциации воды, который превращается в свободный радикал ОН, а в растворе остается неском- пенсированный положительно заряженный ион водорода Н+:
hv
Fe3+ + Н+ + ОН" К Fe!+ + Н+ + ОН. (9)
Свободный радикал ОН очень реакционно способен и может «успокаиваться» на-илучшим образом лишь соединившись с другим таким же радикалом, с образованием перекиси водорода:
НО + ОН -» Н—О—О—Н. (10)
Перекись водорода относительно стабильна. Однако именно в присутствии солей железа она разлагается на кислород и воду (в организмах эта реакция катализируется ферментом катала- зой):
2НА -»2Н20 + 02. (11)
Суммарный процесс с учетом стехиометрических соотношений реагентов запишется в виде
4hv
4Fe3+ + 4Н20 + 12C1--L 4Fe2+ + 12СГ + 4Н+ + 2На0 + 02. (12)
Четыре иона трехвалентного железа поглощают четыре кванта света и разлагают две молекулы воды на четыре протона и молекулу кислорода. (То обстоятельство, что по чисто стехио- метрическим соображениям в реакции должны участвовать четыре иона железа, кажется мне очень примечательным. Эта че- тырехтактность является условием осуществления перекисного промежуточного пути. Вероятно, именно поэтому -каталаза состоит из четырех субъединиц, четырех гемов и четырех полипептидных цепей. И гемоглобин состоит из четырех субъединиц...).
1 Фотохимия окислительно-восстановительных реакций с участием ионов Fe2+ и Fe3+, фотохимическое и радиационное разложение воды являются предметом ряда специальных работ (см. [8, 145, 156, 287, 345, 457]).
Процесс превращения трехвалентного железа в двухвалентное скоро прекратится вследствие накопления протонов, закислеиия среды. Поэтому условие относительно длительного протекания этой реакции состоит в наличии рН-буферной системы. При добавлении в раствор карбоната натрия получим:
4Н+ + 2Na2C03 -> 4Na+ + 2С02 + 2Н20. (13)
При взаимодействии четырех протонов с двумя молекулами карбоната натрия образуются две молекулы углекислого газа, выделяющегося из раствора, две молекулы воды и четыре иона натрия. Но поскольку в растворе присутствуют еще ионы хлора, в итоге получается 4NaCl. Однако при достаточном количестве молекул карбоната натрия углекислый газ не выделяется, а поглощается карбонатом натрия с образованием бикарбоната:
2Na,C03 + 2С02 + Н20 -» 4NaHC03. (14
Таким образом, итогом поглощения энергии света и превращения Fe3+ в Fe2+ оказывается накопление бикарбоната натрия, наполнение емкости выбранной нами буферной системы.
Возможности такой системы на этом не исчерпываются. Двухвалентный, двухзарядный ион железа Fe2+ можно превратить обратно в Fe3+. Последний процесс, хотя он осуществляется и самопроизвольно, может идти и при поглощении энергии света, сопряженном с разложением воды. В самом деле, превращение Fe2+ в Fe3+ сводится к отдаче электрона какому-либо подходящему акцептору. В разбавленном водном растворе возбужденный ион двухвалентного железа может отдать электрон даже протону, и тогда образуется свободный радикал Н — атом водорода. Радикал этот, естественно, неустойчив и реагирует с другим таким же радикалом (с образованием молекулы водорода Н2) «ли с каким-л,ибо иным подходящим реагентом. Напомним, что в нашей системе присутствует кислород (см. процесс [12]); тогда свободный радикал Н вступает в реакцию с кислородом (Н+02-^Нб2); затем образовавшийся Н02 вступит в реакцию с еще одним Н, и мы снова получим Н202. Знаменательно, что перекись водорода образуется в качестве промежуточного продукта в рассмотренных выше противоположных процессах. Перекись водорода разлагается с образованием Н20 и 02 и снова по чисто стехиометрическим соображениям в реакцию окисления должны вступать четыре иона Fe2+, поглощаться четыре кванта света, разлагаться четыре молекулы воды:
4 hv
4Fe2+Cl~ + 4Н20 + 202 X 4Fe3+ + 8СГ~ + 2НаОа + 40Н“ -> 4Fe3+ +
+ 8СГ- + 2Н20 + 02 -f- 40Н-. (15)
Как мы видим, при этой реакции в растворе остается избыточное количество ионов гидроксила ОН”. Ясно, что и осуществление реакции (15) зависит от рН-буферной системы, способнойпоглощать образующиеся гидроксильные ионы. Возьмем для простоты ту же карбонатную буферную систему:
4NaHC03 + 4NaCl + 40Н“ -> 4Na2COs + 4С1“ + 2Н20. (16)
Поскольку гидраты Fe3+ и Fe2+ поглощают излучение разных длин волн, нетрудно представить себе искусственную систему, в которой происходит попеременно то первая, то вторая реакция и цикл превращения железа замыкается. Цикличность этих превращений можно осуществить без попеременного изменения длин волн излучения света, а вследствие кинетических особенностей такой и аналогичных систем [102].
Радикалы, образующиеся в реакции превращения Fe2+ в Fe3+ могут реагировать не с кислородом, а каким-либо другим акцептором А, образуя АН2.
Соединим теперь реакции (12) — (16) в цикл:
4hv.

2
4hv2
О,
Мне представляется интересной эта выдуманная, искусственная неорганическая система преобразования энергии. В ней осуществляются процессы, аналогичные биохимическому фотосинтезу,— разложение воды с образованием кислорода и восстановлением акцепторов водорода. Примечательна ключевая роль перекиси водорода в обеих половинах цикла. Вместе с тем ясно, что стационарная концентрация перекиси водорода и других промежуточных продуктов может быть очень малой. Интересна необходимость четырех квантов света для прохождения половины цикла и восьми квантов для полного цикла. (Любители фотосинтеза должны взволноваться, так как пока никто не знает, почему для современного фотосинтеза необходимо восемь квантов света на элементарный цикл.)
При всем том, я не говорю, что именно так выглядела первичная, исходная в эволюции система преобразования энергии. Приведенное выше лишь служит иллюстрацией хода мысли, иллюстрацией возможности и необходимости сопряжения окислительно-восстановительных и ионных реакций при биохимических преобразованиях энергии. Наименее правдоподобно участие в этом цикле железа в виде его хлористых солей, но вполне вероятны аналогичные циклы для комплексных соединений железа,например, красной кровяной соли и желтой кровяной соли '. При полном обороте цикла — четыре молекулы Н20 разлагаются на 4Н+ и 40Н“. Это соответствует изменению энтальпии в системе на ДН = 4Х 13 = 42 ккал/моль.
Если же акцептором водорода служит не 02, а какое-либо другое вещество-акцептор А, то цикл оказывается, например,, таким:

В таком виде этот цикл почти полностью аналогичен современному фотосинтезу: разлагается вода, и образуется восстановительный акцептор водорода. Осталось еще придумать способ сопряженного синтеза АТФ...
Будем считать, что мы убедились в принципиальной возможности запасания энергии света посредством создания буферной pH-системы. Суммарная буферная емкость — это мера количества свободной энергии, которое может накопиться в системе. Запасенная свободная энергия может расходоваться по мере осуществления эндэргонических синтезов. Вполне вероятно, что эта возможность была реализована в ходе эволюции. В процессе естественного отбора возникали специализированные ферменты, катализирующие реакции в циклах, подобных рассмотренному выше. Особую заботу эволюции вызывало, вероятно, совершенствование комплексов железа — отбор таких комплексов, области поглощения которых при изменении валентности железа отличались бы наиболее резко, а также отбор систем биосинтеза пигментов и др.
«Макроэргические» соединения. Фосфорилирование, сопряженное с фотохимическим окислительно-восстановительным процессом. Теперь настало время усомниться в совершенстве запасания свободной энергии в рН-буферных системах. Термодинамически здесь, по-видимому, все в порядке. Но кинетически — отнюдь не все. Изменение pH в некотором смысле аналогично изменению температуры — эти изменения не адресованы какой- либо одной реакции, а сразу многим. Таким образом, путь к совершенствованию есть «векторизация», т. е. переход от безадресно-


РИС. 11. Схемы, иллюстрирующие изменения свободной энергии в несопряженных и сопряженных химических превращениях

■а — несопряженное превращение А в В; б — образование промежуточного макроэргиче- ского соединения В^х сопряжено с превращением А в В; в — образование универсального макроэргического соединения х~у сопряжено с превращением А в В
го, статистического подвода энергии к снабжению ею только строго определенных процессов. Механизм такого избирательного энергоснабжения в принципе ясен — он должен основываться на специфических химических взаимодействиях. Запас энергии должен содержаться в химических группах, способных избирательно реагировать с превращаемой молекулой. Потом мы увидим, что этот запас в особых так называемых макроэргических группах также в значительной мере обеспечен запасом свободной энергии в рН-буфере. Пока же посмотрим, что это за группы. Что требуется от таких макроэргических групп? Необходимо, чтобы их отщепление от подлежащей превращению молекулы сопровождалось выделением энергии, обеспечивающей сдвиг равновесия соответствующей реакции в нужную сторону.
Главное назначение макроэргических групп — предохранение свободной энергии, выделяющейся в данном экзэргоническом процессе, от теплового рассеяния и обесценивания. Свое назначение эти группы выполняют посредством сопряженного с экзэр- гонической реакцией присоединения к промежуточным продуктам с образованием макроэргических соединений.
Когда молекула А превращается в молекулу В, свободная энергия системы уменьшается, т. е. выделяется энергия AF° (см. рис. 11, а). Если к молекуле А в реакции, почти не требующей затрат энергии, присоединена специфическая группа х образуется А^-х. Превращение А—х в В~х, в принципе, может не сопровождаться выделением энергии, уменьшением свободной энергии системы. Это эквивалентно тому, как если бы энергия превращения А в В сохранились в связи В~х — стоит разрушить эту связь — образуются свободные В и х и выделится в нашем идеализированном случае та же энергия AF°, что и при непосредственном превращении А в В (рис. 11, б). В силу сказанного связь В~х выступает как вместилище свободной энергии процесса превращения А в В, обозначается значком ~ (тильда) и называется макроэргической.

РИС. 12. Схема, иллюстрирующая возможность образования х~у при последовательном сопряжении с реакцией превращения А в В при стационарном режиме процесса
Макроэргическое соединение В ~х недостаточно удобно — оно определяется конкретной природой А и В. Термодинамический потенциал превращения А в В может быть сохранен от теплового рассеяния и перенесен для использования в других процессах посредством универсальных макроэргических соединений «х~у». Такие соединения должны образовываться сопряженно с распадом В ~х\
В ~ х-{-у+±В-\-х ~ у.
В идеальном случае и образование х~у может идти изоэнергетически или с очень небольшим уменьшением свободной энергии системы (рис. 11, б).
Таким образом, свободная энергия, которая при несопряженном превращении А в В превращалась в тепло, теперь сохранена в связи хну
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ