Представленная на рис. 12 схема энергетического сопряжения идеально высокоэффективна. Малая добавка вещества А приведет к образованию соответствующего числа (от добавленного Л) молекул у (Af°=0), т. е.:
_ Ml [х] [у] р '
Такое высокоэффективное сопряжение может быть чисто химическим, т. е. не требовать осуществления процесса посредством механических или электрических механизмов.
Менее совершенно сопряжение двух химических реакций посредством немакроэргического промежуточного состояния системы. Представим себе, что А сначала превращается в В, а затем В реагирует с х (см. рис. 12). Как показал Л. А. Блюмен- фельд [30], такой механизм сопряжения в нестационарном режиме малоэффективен, «импульс» увеличения концентрации А почти не дойдет до увеличения концентрации х~г/ — синтезируется лишь очень немного макроэргических молекул — в соответствии с величиной К„ реакции В + х+-В~х. Однако в стационарном режиме, при поддержании постоянной сверхравновесной концентрации А, сопряженный синтез х~у и по этому механизму может быть вполне эффективен, как эффективно перетекание жидкости в сифоне (см. схему, рис. 12).
Макроэргические соединения х~у могут служить источником энергии во всех процессах, где возможно их специфическое химическое реагирование. Этим и достигается «векторизация» траты термодинамического потенциала экзэргонических реакций.
Так, например, добавление х~у к В может привести к образованию в реакции В + х ~у^В~х + у, что никак не удалось бы при попытке провести реакцию В+х-^В~х. Таков энергетический механизм химических сопряженных реакций, открытых в начале нашего века Н. А. Шиловым [331].
Нужно специально подчеркнуть, что «макроэргичность» — это не характеристика свойств связи х и у самой по себе, а мера изменения свободной энергии в процессе превращения распада, гидролиза вещества х~у. Ясно, что величина изменения свободной энергии процесса (и даже знак этой величины) зависит от условий проведения процесса. Таким образом, микроэргическими называются соединения, распад которых (обычно гидролиз) сопровождается существенным уменьшением свободной энергии системы (ДF° около 10—20 ккал/моль) в данных условиях.
Макроэргические соединения должны образовываться за счет энергии, внешней по отношению к системе, например, за счет энергии света. Кроме того, они должны быть универсальными, т. е. годиться для энергетического обеспечения разных синтезов.
Биохимикам ясно, что сейчас речь пойдет в основном о пирофосфатах. Установление такой роли пирофосфатов — одно и. главных достижений биохимии XX в. (см. [37, 135, 157, 176, 265- 268, 297, 407, 420, 436]). Пирофосфаты представляют собой ан гидриды ортофосфорной кислоты. Неорганический пирофосфа образуется при нагревании, при прокаливании солей ортофос- форной кислоты:
О О 0 0
II II '|° I! II Т
НО-Р-ОН + НО + Р-ОНА НО-Р-О ~ Р-ОН + н2о.
I II
0~Na+ 0~Na+ 0'Na+ 0~Na+
Ангидридная пирофосфатная связь может образоваться между большим числом остатков ортофосфорной кислоты, тогд; возникают молеь^лы полифосфатов:
Пирофосфатная связь макроэргична в указанном смысле — при ее гидролизе в стандартных условиях свободная энергия системы уменьшается на 7—10 ккал/моль, т. е. гидролиз идет практически до конца. За счет уменьшения свободной энергии при гидролизе макроэргических связей и может осуществляться соединение, например, нуклеотидов в поликлеотидную цепь. Так, в реакции с участием пирофосфатаденозина (АДФ) происходит (за счет энергии, выделяющейся при расщеплении пирофосфатной связи) присоединение аденозинмонофосфорной кислоты АМФ к другому нуклеотиду, например ГМФ (реакция Грюнберг-Мона- го, Очоа):
АДФ + (ГМФ)П^: АМФ- (ГМФ)„ + Н3Р04.
Аналогичным образом можно сместить равновесие в случае синтеза пептидных связей при сопряженном расщеплении пиро- фосфатных связей в АТФ, образовании активированной, макро- эргической формы аминокислоты — аминоациладенилата. Пирофосфаты при нейтральном и щелочном значениях pH среды служат универсальными посредниками в превращениях энергии, необходимой для биохимических процессов. Однако создание больших концентраций пирофосфатных производных нуклеотидов невозможно: нуклеотидпирофосфаты активно участвуют в синтезе полинуклеотидов и их высокие концентрации могут повлиять на неконтролируемый синтез полинуклеотидов. Необходимы склады для хранения запасов термодинамического потенциала в менее активной форме.
Наиболее простой выход из создавшейся ситуации — хранение энергии в виде минерального пирофосфата или полифосфатов. Это и реализуется в клетках некоторых низших грибов и ряда бактерий (см. работы И. С. Кулаева [162]). В таких организмах хранилищем энергии оказываются минеральные полифосфаты (при числе ортсфоефатных остатков в цепи, достигающем 200— 300). От компактных осмотически (а, значит, и кинетически) неактивных частиц по мере надобности «откусываются» посредством специальных ферментов пирофосфатные группы для энергетического обеспечения биохимических процессов.
Однако эти «питательные камни» все же не очень удобны: мала поверхность взаимодействия со средой, мала предельная скорость вовлечения в метаболизм содержащейся в них энергии. Необходимы относительно мелкие, биохимически узко специализированные хранилища термодинамического потенциала.
В организмах животных эти функции выполняют гуанидин- фосфаты: креатинфосфат и (у беспозвоночных) аргининфосфат.
Ясно, однако, что хранение больших количеств энергии в виде гуанидинфосфатных и прочих макроэргических соединений также невозможно: на самом-то деле количество энергии, освобождаемой при гидролизе каждой связи, очень мало (всего около 10—20 ккал!моль). Таким образом, мы приходим к вполне тривиальному выводу — наиболее удобно хранить энергию в виде запасов пищи: жиров, углеводов, белков (см. с. 131).
Тем не менее, и в данном случае по кинетическим соображениям именно макроэргические соединения служат непосредственным источником энергии для эндэргонических биохимиче- ких процессов: свободную энергию из них можно получить в оптимальных дозах наиболее быстрым образом.
Универсальным в процессах превращения энергии в живых организмах на Земле веществом является аденозинтрифосфор- ная кислота АТФ *:

Представляется очень интересным установить причины, которые привели к выбору в процессе эволюции именно АТФ в качестве универсального посредника для подавляющего большинства видов превращения энергии в биохимических процессах. Возможно, что и в этом случае дело не столько в существенном, «деловом» превосходстве АТФ по сравнению, например, с ГТФ или ЦТФ, сколько в легкости спонтанного возникновения фосфорных производных именно аденина.
В соответствии с эволюционной логикой нашего анализа мы должны допустить, что образование АТФ сопряжено с поглощением света. Верность такого допущения можно оценить лишь при осуществлении в эксперименте синтеза пирофосфатных связей АТФ в относительно простой модельной системе при поглощении света.
Прежде, чем приступить к оценке возможностей такого эксперимента, попытаемся выяснить физико-химические причины макроэргичности пирофосфатных связей.
Вопросы эволюции биохимических механизмов преобразования энергии (см.
[37, 152, 268]).
О причинах макроэргичности пирофосфатов. Большая величина изменения свободной энергии при гидролизе пирофосфатов, т. е. их макроэргичность, проявляется в сильном сдвиге равновесия реакции гидролиза:
АТФ4" + Н20 ^ АДФ3- + HPOf- + н+
в сторону продуктов. Как известно, связь константы равновесия реакции К с величиной сопровождающего реакцию стандартного изменения в ней свободной энергии AF0 имеет вид:
AF° = — ЯГ In К,
где К — константа равновесия. Следовательно, для гидролиза АТФ можно написать:
[АДФ3-] [НРСЯ- [Н+]
AF = — RT In [АТФ4-] [Н20]
Однако в написанной выше реакции не отражена нейтрализация образующихся ионов водорода ионами гидроксила среды, т. е. реакция:
н++он-^н2о,
сопровождающаяся очень большим стандартным (AF°) изменением свободной энергии, равным примерно 20 ккал/моль. К сожалению (или к счастью), в биохимических системах отсутствуют сильные щелочи и кислоты — скрытые резервы ОН- и Н+ ионов представлены какой-либо буферной системой, т. е. обычно слабыми кислотами и их солями.
Мы уже видели, что в молекуле ортофосфата содержатся три группы, способные диссоциировать с образованием иона водорода. Однако соответствующие рК резко различны. Первый гидроксил (тот, который успевает диссоциировать первым), диссоциирует на 50% при pH около 2,0 (т. е. его рК равна 2). рК для второго гидроксила составляет 7,0, для третьего — около 13. Таким образом, при pH около 7 полностью диссоциирован первый гидроксил, наполовину — второй и совсем недиссоциирован третий. Ниже приведены структурные формулы орто-, мета- и пирофосфата:
О
И
н+о-рч
п © Ч° о о 'jj' Метафостфат ^ ||
н-о-р-о" н-о-р-о-р-о^
© I .Ф © I ® I Р
^ сгн+ о~ СГН+
© © (D
Ортофосфат Пирофосфат
Стандартное изменение свободной энергии ДF0, т. е. при единичных концентрациях исходных реагентов, нормальном давлении, £=25°, рН=7.
В пирофосфате «не хватает» второго гидроксила — он несет 2,5 отрицательных заряда вместо 3,0, как было бы в двух ортофосфатах. При гидролизе появляется недостающая половина заряда и соответствующее количество ионов водорода нейтрализуется ионами гидроксила среды. Возьмем для конкретности прежнюю карбонат-бикарбонатную буферную систему и запишем реакцию гидролиза АТФ подробнее, с учетом нейтрализации образующихся ионов водорода в буферной системе. При гидролизе пирофосфатной связи появляется новая кислотная группа — второй гидроксил ортофосфорной кислоты:
оо о о
RO-P-0-P-Cr +H305=2-R0-P-0 + H++H-0-P-Cr
®i-®i-® ®£-о © i-®
® © ® ®
Выпишем отдельные стадии процесса гидролиза и найдем для каждой константу равновесия.
Первая стадия записывается в виде:
АТФ4- Н20 ^ ЛДФ3- + Н2Р04 ;
_ [АДФ»~] [Н2Р07]
Kl ~ [АТФ4-] [Н20] ■
Во второй стадии образовавшийся ортофосфат диссоциирует:
[Н+] [НРОП
H2POJ ^ Н++ HPOf; Кг
[Н2Р04]
[СОГ] [Н+] [НСО-]
В третьей ион Н+ реагирует с ионами С032~ карбонат-бикарбо- натной буферной системы:
С02~ + Н+ ^ НСО;; К3 =
Поскольку [С032-] значительно больше [НР042-], концентрация Н+ определяется лишь свойствами буферной системы и равна:
К3 [HCOJ]
[НЧ - -
[С032~]
Учитывая приведенные выше соотношения для [Н+] и [Н2Р04_], получим ДЛЯ Ki\
К3 [НСО-] [НРО2'] [АДФ3~]
К1
х, [СО2-] [АТФ4-] [Н20]
Поскольку концентрация воды в водных растворах постоянна и равна 55,5 М, имеем для константы равновесия R суммарного
кг [ЧСО~] [HTOJ-] [АДФ*-]
К = Кх[ Н20]^-2 4
К9 [СО®-] [АТФ4-]
Из справочников находим /С2 = 1,6-10_7 и /С3г= 5,6• 10~и, откуда в данных условиях
К = К,-1,6-105.
Иными словами, для AF получаем:
AF = - 2,3RT lg Ki — 2,3RT lg (1,6 • 105) =
= — (2,3RTlgKi-t 7,3 ккал/мэль).
Как мы видим, изменение свободной энергии, вызванное нейтрализацией продуктов гидролиза и наличием воды в большой концентрации, весьма заметно. Правда, мы взяли буферную систему, поддерживающую сильно щелочную реакцию среды.
Для реакции нейтрализации ионов водорода, например, в фосфатном буфере, где в наших обозначениях Кг=К3, имеем:
^ = K,[HsO].
Нейтрализация продуктов гидролиза в этом буфере не дает выигрыша в энергии, но становится очевидной роль высокой концентрации воды
AFHs0 = - 2,3RT lg [Н20] = - 1,4 ■ 1,74 ж — 2,4 ккал/моль.
Для того, чтобы оценить R, нужно знать Л’,. Величина Ki зависит от различий свойств молекул соответствующего пирофосфата и продуктов его гидролиза. Рассмотрим поэтому еще раз процесс гидролиза пирофосфатов
О О о о
[I II II II
Н—О—Р-0 ~Р—О- 4 н2о -> Н-О—Р—О- + Н-О-Р—о- + н+.
! I I I
О- О- о- о
При гидролизе пирофосфата рвутся связи Р—О (пирофосфат- ная связь) в пирофосфате и О—Н в воде и образуются снова те же связи Р—О и О—Н, но уже в ортофосфате. Для того, чтобы судить об энергетических изменениях при таком гидролизе, нужно знать различия в энергиях этих связей в пиро- и ортофосфате, т. е. знать эффекты, обусловленные влиянием третьих атомов на энергию связи двух. Эффекты эти невелики и оцениваются 2—3 ккал/моль.
Связь Р~0 в пирофосфате менее прочна, чем связь Р—О в ортофосфате, т. е. термодинамически менее выгодна; при ее образовании выделяется меньше энергии, чем при образовании такой же связи в ортофосфате. Причины ее меньшей прочности, меньшей стабильности были рассмотрены в 1939 г. Г. Калька-
ром (см. [407]), в 1941 г. Ф. Липманном >[420], в 1950 г.— П. Оспером [438] и т. д. В пирофосфатной связи атом кислорода, соединяющий (или, если угодно, разделяющий) два фосфатных радикала, препятствует резонансному усреднению л-электронной структуры ортофосфата и возникает ситуация «Беспрепятственного резонанса» (opposite resonance). Квантовомеханический резонанс сопровождается выделением энергии, он термодинамически выгоден [233, 279]. Нарушение резонанса обусловливает термодинамическую нестабильность: гидролиз устраняет препятствия для резонанса и возникают более выгодные связи Р—О в ортофосфате. Приведенная схема иллюстрирует сказанное:
о
/и
/\\

о

НО—Р^;о-Н
В ортофосфате я-электроны двойной связи растекаются па всем четырем связям фосфор-кислород в результате резонанса структур, что выгодно термодинамически. В пирофосфате резонансное растекание л-электронов нарушено на кислородном мостике. Поэтому при гидролизе пирофосфата уменьшается свободная энергия, образуются более стабильные продукты. Все эти эффекты, насколько мне известно, не были до сих пор оценены с достаточной точностью — о их величине можно судить лишь на основании косвенных, главным образом экспериментальных, данных.
Из экспериментальных данных ДF гидролиза пирофосфатных связей оценивается в 5—8 ккал1моль в зависимости от условий [362], и поэтому на долю ДFa (т. е. К\) остается около 2 ккал[ /моль.
Таким образом, нейтрализация продуктов гидролиза и высокая «концентрация воды в воде» обусловливают основной вклад в изменение свободной энергии гидролиза пирофосфатной связи
[455].
Макроэргичность пирофосфатов определяется в значительной степени значением pH, поддерживаемым в среде, т. е. величиной буферной емкости. Расход свободной энергии, накопленной в рН-буферной системе векторизуется, т. е. направляется в нужную реакцию посредством сопряжения гидролиза пирофосфата с тем или иным эндэргоническим процессом.
Рассмотренные выше причины макроэргичности нельзя считать единственно возможными.
Так, основной вклад в изменение свободной энергии при гидролизе гуанидинфосфатов (креатинфосфат, аргининфосфат), по-видимому, вносит протонирование освобождающейся NH2- группы гуанидина и снятие запрета на резонанс структур:
NH H 0 NH О
I II II II
C-N ~ P—0~ 4- H20+ H+ C-N+H3 -1- HO-P-O-.
II
R O' R O-
Естественно, что изменение свободной энергии при гидролизе этих соединений больше в кислой среде (а не в щелочной, как при гидролизе пирофосфатов).
Особым примером макроэргического соединения, рассмотренным еще Калькаром и Липманном, является фосфоенолпируват. При его гидролизе образующиеся продукты дополнительно не ионизируются:
соон о соон о
II I II
С—О-Р-О- + Н20 С-ОН + H0-P-0-.
Н I I! I
СН2 О- СН2 О-
Основной вклад в макроэргичность вносит превращение термодинамически нестабильной енольной формы пирувата в стабильную кетоформу.
В этом случае макроэргичность молекулы не проявляется в ее физических свойствах. Термодинамическая невыгодность существования молекулы выявляется лишь в процессе ее разрушения при гидролизе. Макроэргичность такого типа, характерная для пирофосфата, фосфоенолпирувата и гуанидинфосфатов особенно привлекательна для биохимических целей. Перечисленные выше молекулы кинетически устойчивы, запас энергии, содержащийся в них, выделяется лишь при катализе — специфическом ускорении реакции их гидролиза. Вероятно, именно в силу особой кинетической стабильности и достаточной макроэргич- ности пирофосфаты и заняли столь выдающееся место в процессах превращения энергии в биологических системах.
Мне здесь хочется особенно подчеркнуть, что запасания энергии в виде одних только пирофосфатов невозможно — нужно еще располагать соответствующей буферной системой, поддерживающей pH на должном уровне.
Фотохимический синтез АТФ. Займемся теперь поисками способов запасания энергии, например, света, посредством сопряженного с поглощением света синтеза пирофосфатных связей н образования буферных систем.
Из рассмотренных выше соображений очевидно, что сами молекулы ортофосфата или пирофосфата не пригодны для фотохимического сопряженного синтеза: они не поглощают свет в необходимом для этих целей диапазоне. Вообще-то здесь нужны вещества окрашенные, поглощающие видимый свет. Однако для начяля эволюционного совершенствования пригодились бы и молекулы, поглощающие в ближнем ультрафиолете. Естественно предположить, что такими поглощающими свет -молекуламимогут быть спонтанно возникающие в первичном бульоне молекулы нуклеиновых оснований и нуклеотидов. Уже удалось осуществить синтез фосфорных производных аденозина за счет энергии ультрафиолетового излучения, но в присутствии этилмета- фосфата и метафосфата [447, 448].
Каким образом энергию, поглощенную нуклеиновым основанием, можно направить на синтез нирофосфатной связи? Мне представляется чрезвычайно привлекательной гипотеза о механизме фосфоршшрования АДФ в АТФ, выдвинутая много лет назад Л. А. Блюменфельдом и М. И. Темкиным [28].

Эта гипотеза основывается на том, что при нарушении сопря жения в пиримидиновом кольце 6-аминопурина (аденина) резк< возрастает способность азота аминогруппы переходить в поло жительно заряженное четырехвалентное состояние (четвертич ный азот):
NH2
!
С N
/\/Ч
N С СН
| || | +1е- + 2Н+
С С N
/Ч/ I
Н N R
Изменение рК-аминогруппы, например, в результате нар? шения сопряжения, как изображено выше, при восстановлен!! азота пуринового кольца с образованием свободнорадикально1 состояния углерода, соответствует изменению свободной энерги примерно на 10 ккал/моль, т. е. приблизительно на столью сколько нужно для синтеза пирофосфатной связи из ортофосфг тов. Мы видим здесь яркий пример преобразования энерги, окислительно-восстановительного превращения в энергию ионных взаимодействий.
Нарушение сопряжения в пуриновом кольце может возникнуть в результате фотохимического восстановления кольца. Для этого нужен довольно большой квант энергии света. Во всяком случае поглощение излучения с длиной волны 260 нм (энергия около 100 ккал!моль), характерное для пуриновых и пиримидиновых колец, заведомо обеспечивает возможность нарушения сопряжения в кольце — величина этих квантов даже излишне велика.
Однако самое главное здесь — представить себе, каким же образом осуществляется сопряжение, т. е. синтез пирофосфатной связи, наступающий вслед за восстановлением пуринового кольца аденина. Согласно Блюменфельду и Темкину, дело обстоит следующим образом.
Возникновение положительного заряда в аминогруппе пуринового кольца должно способствовать фиксации отрицательнозаряженного неорганического фосфата и, вероятно, также фосфатного конца молекулы АДФ или АМФ. При этом соответствующие нуклеотиды приобретают скорпионоподобную конфигурацию:
О
It
+
0
1
0-
1
о
X
сг
1 +
О NH,
1 *
I °-
О
1 II
\ О
.р'
о
/
о
-сн2-Хн н
N
сн
N
н
\
н
он он
Перенос водорода от свободнорадикальной формы аденозин- ;рифосфата на какой-либо подходящий акцептор должен сопровождаться значительным уменьшением свободной энергии — выделением энергии, способной превратиться в работу. При этом восстанавливается сопряжение в пуриновом кольце (свободно- радикальное состояние исчезает) и за счет выделяющейся свободной энергии синтезируется нормальная молекула АТФ:
t н Ф
hl I i
АДФ + фосфат -\- Н = донор ^ (АДФ)’ -)- (окисл.) донор,
Н (АДФ)- фосфат + акцептор -» АТФ + Н = акцептор.
Таким образом, синтез АТФ, сопряженный с поглощением света, оказывается двухтактным, двухстадийным; в первой стадии поглощение света приводит к возникновению свободнорадикальной формы АДФ, восстановленной водородом, поставляемым неким донором, и к образованию комплекса этой активной АДФ с молекулой ортофосфата; во второй стадии происходит рекомбинация свободнорадикальной формы пуринового кольца с сопряженным замыканием пирофосфатной связи, сопровождающемся отдачей лишнего водорода некоему акцептору.
Фантастична ли нарисованная нами картина? Выглядит она весьма привлекательно и термодинамически, по-видимому безупречна. Однако термодинамике угодить легко: ей безразличны пути реализации ее предначертаний. А что происходит на самом деле? Исчерпывающего ответа еще нет. Однако уже много лет назад Л. П. Каюшин и его сотрудники {36, 1316] обнаружили свободнорадикальную форму промежуточного продукта при гидролизе АТФ (а это делает вероятным появление такой формы и при синтезе).
Вскоре после опубликования гипотезы Блюменфельда и Темкина были проведены исследования, показавшие реальность окислительно-восстановительных превращений аденина (в частности, входящего в состав АТФ) [153, 270, 170]. Возможность сопряжения окислительно-восстановительных превращений аденина и синтеза АТФ была рассмотрена и в книге В. П. Скулаче- ва [266],
Таким образом, можно ожидать в близком будущем осуществления фотохимического или электрохимического модельного синтеза АТФ из АДФ и ортофосфата в присутствии подходящих доноров и акцепторов водорода (электронов) [267]. Мне кажется полезным попытаться теперь соединить две наших гипотетических схемы — схему процессов фотохимического разложения воды и создания буферной емкости при посредстве каких-либо соединений железа типа красной и желтой кровяной соли и схему фотохимического синтеза АТФ.
Выше уже отмечалось, что осуществление фотохимических реакций за счет энергии относительно короткого ультрафиолета биологически нецелесообразно; в самом деле, при таком облучении легко наступает разрушение уже синтезированных молекул и естественно ожидать возникновения в ходе естественного отбора биосистем, использующих энергию видимого света. Поэтому синтез пирофосфатов, сопряженный с поглощением света непосредственно пуриновым или пиримидиновым кольцом, должен вытесняться синтезом за счет энергии света, поглощаемого какими-либо окрашенными веществами — пигментами. Простейшими, способными к необходимому преобразованию энергии окрашенными молекулами являются соединения железа. Поэтому имеет смысл выяснить, вероятно ли образование свободнорадикальной формы активной АДФ, сопряженное с фотохимическими превращениями соединений железа. Мы видели выше, что переход Fe2+ в Fe3+ может происходить с передачей электрона иону водорода с образованием свободнорадикального водорода. Мы считали, что акцептором этого водорода служит молекула кислорода и образуется перекись водорода.
Представим себе теперь, что акцептором Н оказывается пуриновое кольцо АДФ, т. е. идет реакция Н +АДФ-v (АДФ)" и образуется активная АДФ. Соединяясь с ортофосфатом она должна отдать лишний водород и вернуться в нормальное, а не свободнорадикальное состояние. Для этого необходим соответствующий акцептор водорода. Им может быть тот же кислород и тогда образуется перекись водорода:
2Н (АДФ)' + 2Н3Р04 + 02 -» 24ТФ + Н202.
Объединив две наши схемы, мы получим следующее. Соединение трехвалентного железа (например, красная кровяная соль), поглощая свет, разлагает за счет поглощенной энергии воду и образуются двухвалентное железо (желтая кровянаясоль), ионы водорода, (наполняющие буферную емкость) и кислород. Двухвалентное железо при поглощении света (или спонтанно, в темноте), окисляется в трехвалентное железо при взаимодействии с водой (разлагая при этом воду на ионы гидроксила,, наполняющие соответственную буферную емкость) и реализует сопряженный синтез АТФ из АДФ и фосфата.
Мы получили комплексную систему, осуществляющую и реакции фотосинтеза (разложение воды на водород и кислород, образование восстановленного акцептора водорода) и сопряженное (быть может, темновое) образование АТФ при «обратном» транспорте электронов. Примечательно обязательное наличие перекиси водорода по крайней мере в одной половине цикла. Важно еще подчеркнуть, что наш цикл отнюдь не сводится к транспорту электронов — мы имеем здесь и транспорт протонов, и процесс образования и распада перекиси водорода, и процесс разложения воды.
Я подчеркиваю последние обстоятельства потому, что и для биохимических систем фотосинтеза и окислительного фосфори- лирования у ныне живущих организмов на Земле, также вероятны все перечисленные выше особенности — и участие воды, и перенос протонов *, и существенная роль следов кислорода и перекиси водорода.
Выше неоднократно подчеркивалась необходимость наличия Н202 и 02 в качестве участников многоэтапных превращений энергии в биохимических системах. Такое участие кислорода п перекиси водорода представляется очень вероятным из самых общих соображений. Нужно отметить здесь, что проблема роли Н202 в биохимических процессах — одна из основных и старейших в биохимии. Огромный вклад в ее исследование внес А. Н. Бах. Однако в течение многих лет после его смерти в биохимии господствовало мнение о Н202 лишь как о нежелательном побочном продукте в процессах биологического окисления.
Сейчас положение изменяется. Появляются публикации, в соответствии с которыми и Н202, и 02 (часто в очень небольших концентрациях) служат необходимыми участниками основных процессов превращения энергии.
Становится все более вероятной картина, в соответствии с которой Н202 и 02 являются ключевыми веществами в процессах синтеза и использования макроэргических фосфатных соединений. Большой материал по этому вопросу опубликован С. Е. Ма- нойловым [195, 196]. Особенно существенно в связи с обсуждаемым здесь обнаружение синтеза АТФ сопряжено с разложением перекиси водорода под действием каталазы в модельной системе. В растворе, содержащем АДФ, глюкозу, фосфат, гексо-
Об этом свидетельствуют значительные изотопные эффекты в системе митохондриального транспорта электронов при замене Н20 на D20 [125, 1816].
киназу, при pH 7, после добавления перекиси водорода и ката- лазы наблюдалась убыль неорганического фосфата (25% от исходного) и синтез АТФ.
Следует отметить также, что в работах М. Н. Кондрашовой и Г. Д. Мироновой [147] показано, что Н202 и 02 обязательно нужны для осуществления и окислительного фосфорилирования, и АТФ-азной реакции в митохондриях. Важность этих фактов как самих по себе, так и для подкрепления изложенных мною общих соображений очевидна.
Мне хочется еще раз подчеркнуть очевидную мысль — ничто в ходе эволюции не может возникнуть внезапно, без связи с уже существующими механизмами. Не может появиться . аппарат энергетического обеспечения синтезов полинуклеотидов и полипептидов, не родственный уже отобранным в ходе эволюции химическим системам. Поэтому нам следует искать механизмы преобразования энергии, механизмы сопряжения эндэргонических процессов с реакциями превращения молекул, уже существовавших на ранних стадиях эволюции. Вот почему мое внимание и привлекает фотохимическое превращение именно фосфорных производных исходных матричных молекул — нуклеотидов.
В дальнейшем всемогущая эволюция шаг за шагом усовершенствовала древние механизмы. В фотохимические процессы вовлекутся уже рассмотренные кратко пигменты (скорее всего, порфирины). Отбор каталитических активных полипептидных цепей приведет к возникновению высоко совершенных ферментов. Самое трудное (и, может быть, самое важное) найти начало. Таким началом и представляется мне фотохимическое сопряжение, синтез пирофосфатов аденозина, сопряженный с поглощением света пуриновым кольцом \ Весьма вероятно, что для такого синтеза абсолютно необходимы ионы тяжелых металлов, железа, кобальта, меди, цинка. Установить это можно лишь экспериментально, что и было выполнено недавно при изучении первичного синтеза аминокислот и нуклеотидов из первичного бульона.
В соответствии с таким подходом следующим шагом после использования непосредственного сопряжения поглощения ультрафиолета пуриновым кольцом и синтеза АТФ должно быть создание в ходе эволюции аппарата синтеза АТФ, сопряженного с поглощением света комплексными соединениями железа, пор- фириновыми или иными пигментами и лишь затем создание биохимической системы сопряжения синтеза АТФ с реакциями окисления углеводов и т. п. При этом вполне возможно, что фотохимические механизмы сохраняются и в темновых процессах, например, при сопряженном фосфорилировании в митохондриях (см. ниже).
Эта мысль давно высказывалась в ряде работ. Она лежит в основе экспериментов Пониамперумы и его сотрудников по синтезу АТФ [447, 448].
Таким образом, следуя логике нашего изложения, следует признать, что фотосинтез должен был появиться в процессе эволюции раньше, чем темновые процессы биохимического преобразования энергии.
Утверждению о первичности фотосинтеза, как я думаю, не противоречит ничто из известного ныне. Мы почему-то связываем относительно позднее в эволюции биосферы Земли образование атмосферного кислорода (см. [49, 126, 1276, 228, 240, 250, 367, 452]) с эволюционным возникновением фотосинтеза. Это неверно. Кислород выделяется при фотосинтезе лишь у высших растений и водорослей. Выделение кислорода в значительных количествах отнюдь не было обусловлено тем, что этот газ столь нужен нам для дыхания. Кислород образовывался первоначально как неизбежный побочный продукт, «экскрет», при радиационном фоторазложении воды. Лишь затем, по мере выработки механизмов запасания энергии в виде энергии связи органических молекул жиров, углеводов, белков возникла необходимость и стало возможным образование макроэргических пирофосфатов, сопряженное с процессами деградации пищевых молекул, т. е. процессами дыхания и брожения.
Необходимо напомнить, что степень макроэргичности существенно зависит от концентрации воды. Поэтому фотохимический сопряженный синтез макроэргических пирофосфатов значительно легче осуществлялся бы в неводной среде. Эти вопросы мы обсудим ниже.
Ожидание осуществления фотохимического синтеза АТФ в простых модельных системах оправдались уже во время завершения в 1975 г. работы над текстом этой главы (см. с. 124). В серии работ Н. В. Гончарова и В. Б. Евстигнеев осуществили синтез АТФ за счет энергии света, поглощаемого хлорофиллом, а также (!) p-каротином или феофитином, адсорбированными на окиси алюминия [72, 74]. Кроме того эти авторы вслед за С. Е. Манойловым осуществили синтез АТФ за счет энергии, выделяющейся при разложении Н202 под действием каталазы [71] и за счет энергии, получаемой при измерении pH в суспензии частиц окиси алюминия с адсорбированными пигментами- хлорофиллами, каротином, феофином в темноте [73]. Ввиду большого принципиального значения достижений Н. В. Гончаровой и В. Б. Евстигнеева рассмотрим их работы подробнее.
На основании собственных экспериментов на бесклеточных препаратах анаэробных серобактерий и давних результатов химиков, изучавших образование перфосфатов и пирофосфатов при электролизе в щелочной среде растворов ортофосфатов, авторы пришли к очень существенному предположению. Они допустили, что в определенных условиях за счет различных эндэргоничных процессов может происходить превращение ортофосфата в метафосфат, который далее легко образует пирофосфатную связь при
реакции с молекулами свободных или замещенных ортофосфатов:
HPOJ' -> РО3 + он-
О
II
R-0-P0J- + РО~ -» R-0-P-0-P-0-.
43 II
о- о-
Превращение ортофосфата в метафосфат в водных растворах при средних значениях pH существенно эндэргонично и может быть осуществлено лишь за счет свободной энергии, выделяющейся в сопряженных энзэргонических процессах. Сами авторы полагают вероятным механизм превращения ортофосфата в ме-' тафосфат, основанный на промежуточном образовании свободно радикальных форм: фосфорила, гидроксила атомарного кислорода. Мне не кажутся эти допущения вполне вероятными. Но это и не важно. Важен сам факт осуществления сопряженного фосфорилирования в очень простых системах, например, сопряженно с реакцией разложения перекиси водорода, катализируемой каталазой! [71]:
2Н202— -АДФ + Н3Р04
2Н20 + 02<- АТФ + Н20
Реакция разложения перекиси водорода резко экзэргонична: ДF° 59 ккал/моль Н202 {436], поэтому в принципе при разложе- йии моля Н202 могло бы образоваться из АДФ и ортофосфата 6-=-8 молей АТФ. Однако количественная характеристика этого процесса явно преждевременна. Само осуществление его является большим событием в биохимии. Синтез АТФ сопряженно с каталазной реакцией осуществлен в очень простой модельной системе — в растворе 7-10~2 М Н202, ЫО-2 М КН2Р04; 0,3- • 10-2 М АДФ в присутствии — 1 -10—6 М каталазы. Примерно 30% АДФ превращалось в АТФ (что было установлено прямым анализом при помощи хроматографии на бумаге).
Затем был осуществлен синтез АТФ за счет энергии света, поглощаемого хлорофиллом, адсорбированным на частицах суспензии окиси алюминия [72]. В 1977 г. эти же авторы опубликовали результаты опытов [74], в которых наблюдали синтез макроэргических фосфатов за счет энергии света, поглощаемого не только хлорофиллами а и Ь, но феофитином (хлорофиллом без атома Mg в центре порфиринового кольца и p-каротином). Модельное фотофосфорилирование было осуществлено также в очень простой системе — суспензии соответствующих пигментов в частицах окиси алюминия в водных растворах КН2Р04 и АДФ. В том же 1977 г. Н. В. Гончаров и В. Б. Евстигнеев сообщили [73] о синтезе АТФ, сопряженном с быстрым изменением pH в суспензии адсорбированных на частицах окиси алюминия хлорофилла в водном растворе КН2Р04 и АДФ и измененным pH от 4,0 до 7,8—8,4. Наблюдалось образование 0,4 мкмолей АТФ
-из 10 бывших исходно мкмолей АДФ, т. е. около 4% —выход продукта нельзя считать большим, но сам факт синтеза АГФ в этих условиях представляется чрезвычайно важным.
ЗАПАСАНИЕ ЭНЕРГИИ ДЛЯ ДЛИТЕЛЬНОГО ХРАНЕНИЯ.
БИОСИНТЕЗ ЖИРНЫХ КИСЛОТ И УГЛЕВОДОВ.
ВОЗНИКНОВЕНИЕ ГЕТЕРОТРОФОВ. АНАЭРОБНЫЙ МЕТАБОЛИЗМ
Макроэргические соединения даже в случае предельно эффективного сопряженного с экзэргоническими реакциями их синтеза мало пригодны для длительного запасания больших количеств энергии — очень уж мала их удельная энергетическая емкость. Свободная энергия гидролиза макроэргических соединений равна 10—20 ккал/моль. Для синтеза макромолекулы среднего размера из нескольких сотен мономеров нужно соответственно в 2— 3 раза большее число сотен молекул типа АТФ (или креатинфос- фата). Накопление высоких концентраций макроэргических соединений физико-химически невозможно: высокая ионная сила, большое осмотическое давление и т. д. затрудняют сохранение необходимой конфигурации макромолекул. Нужны более компактные хранилища энергии. Один из видов таких хранилищ (уже упоминавшиеся выше полифосфаты) — полимеры ортофос- форной кислоты, остатки которой соединены ангидридными пи- рофосфатными связями. Однако эти «питательные камни», по- видимому, имеют принципиальный недостаток — при использовании накопленной в них энергии образуются те же высокие концентрации кинетически активных молекул фосфорной кислоты и множество катионов, связанных на полифосфате, как на поликатионите. И самое главное как мы видели, макроэргичность макроэргических соединений обусловлена в основном емкостью рН-буферных систем. Запасание больших количеств энергии в макроэргических соединениях возможно лишь при высокой концентрации рН-буфера, т. е. при высокой ионной силе большом осмотическом давлении и других «неприятных» физико-химических условиях. Таким образом, по самой своей природе макроэргические соединения не пригодны для запасания значительных количеств энергии. Процесс запасания энергии должен происходить не в результате ионных превращений, а вследствие превращений электрически нейтральных молекул.
Направление эволюционных поисков в связи со сказанным ясно — энергия должна запасаться в молекулах, окислительная деградация которых сопровождается освобождением большого количества энергии. Наиболее экзотермичны реакции полного окисления углеводородов:
СПН2П+2 + V2 (Зп + 1) 02 - п С02 + (п + 1) Н20.
Изменение энтальпии АН при таком полном окислении (сжигании) углеводородов составляет примерно 106 ккал на 1 мольизрасходованного кислорода. Синтез углеводородов, сопряженный с поглощением энергии, излучаемой Солнцем, можно считать пределом термодинамического совершенства запасания энергии. Кислород, необходимый для освобождения энергии, накопленной в синтезированных углеводородах, образуется в том же процессе их фотосинтеза (нужно, правда, удержать 02 до момента темнового окисления).
Однако углеводороды гидрофобны и, следовательно, сечение взаимодействия, т. е. поверхность, доступная действию ферментов, оказывается очень малым. Кинетика использования углеводородов весьма несовершенна (мы снова убеждаемся здесь в несоответствии термодинамического и кинетического критериев биологического совершенства). Для запасания энергии нужны гидрофильные вещества. Среди них на первом месте — жирные кислоты (особенно ди- и трикарбоновые) и углеводы. Синтез углеводов, сопряженный с фотохимическим разложением воды (аналогичным выдуманному нами процессу разложения воды при превращении Fe2+^=Fe3+), представляет наиболее рациональный способ запасания легко мобилизуемой энергии и вещества. Когда быстрое использование энергии не требуется, а нужно запасти ее и отправить на длительное хранение, может происходить фотосинтез жирных кислот с длинной цепью (их триглицеридов — жиров и масел) полисахаридов, белков (как, например, в семенах, клубнях ныне существующих растений).
Фотосинтезирующие первичные автотрофы казалось бы располагают всем необходимым для достижения предельного (пока лишь биохимического) совершенства. Каков же биологический смысл возникновения гетеротрофов, зачем они появились? И не просто возникли, а еще достигли столь высокого совершенства. В сущности и автотрофы—химеры; их вполне можно (мысленно, а иногда и в действительности) разделить на две части — фотосинтезирующую и потребляющую. Потребляющая часть авто- трофа и есть гетеротроф, еще неотделенный от автотрофа. (Зеленую эвглену можно заставить разделиться так, что хлоропласт останется лишь в одной дочерней клетке. Другая, бесхлоро- пластная клетка — это гетеротроф, нуждающийся в органической пище).
Итак, что же позволяет гетеротрофной части первичного автотрофа отделиться и перейти к самостоятельному, хотя и зависимому от автотрофа существованию?
Я думаю главное здесь — возможность завоевания ареалов, недоступных автотрофам. В самом деле, фотосинтезирующие автотрофы могут расселяться по лику планеты в местах с достаточно интенсивным потоком солнечного света. Гетеротрофы способны существовать всюду, куда поступают тем или иным способом питательные продукты жизнедеятельности автотрофов. Возможность почти неограниченного расселения гетеротрофов особенно широко реализуется при возникновении в ходе эволю-
РИС. 13. Общая схема аэробных превращений энергии в биосфере

Ei— энергия солнечного света; £2 — низкокачественная тепловая энергия; А— акцептор водорода; ~Р— макроэргические фосфаты
ции аппаратов перемещения в пространстве, о чем мы специально будем говорить в следующих главах. Разделение живых существ на две группы — автотрофов и гетеротрофов — обусловливает разветвление дальнейшего пути эволюционного совершенствования биохимических процессов — на одном пути происходит биохимическое совершенствование автотрофов, на втором — биохимическое совершенствование гетеротрофов (сначала гетеротрофной части холотрофа — первичного автотрофа).
При достижении предельного совершенства и автотрофов и гетеротрофов устанавливается замкнутый цикл преобразования веществ и энергии в масштабах биосферы планеты. Автотрофы за счет энергии поглощаемого ими света разлагают воду на водород и кислород. Водород соединяется с какими-либо акцепторами — в основном с С02 с образованием, сохраняющих энергию молекул пищи (фотосинтез). Кислород уходит в атмосферу. Гетеротрофы осуществляют обратный процесс — образуют воду, освобождая законсервированную ранее энергию при соединении кислорода с водородом органических молекул (дыхание) (рис. 13). Прохождение этого термодинамического цикла, естественно сопровождается деградацией энергии — «высококачественное» видимое и ультрафиолетовое излучение Е, в конце концов превращается в «низкокачественное» тепловое излучениеЕ2, т. е. в относительно низкотемпературный белый шум (см. рис. 13). При осуществлении такого цикла, реализующегося сопряженно с процессами деградации солнечной энергии, совершаются все процессы жизнедеятельности, вызванные к жизни (в буквальном смысле этого словосочетания) биологической эволюцией. Сведение всех весьма сложных биохимических процессов превращения энергии к разложению и образованию воды— вероятно, одно из самых сильных научных обобщений нашего века.
Нефть, уголь и кислород[10]. К счастью (для нас — дышащих кислородом), этот цикл замкнулся не сразу. Сначала фотосин- тетическое разложение воды преобладало над образованием воды в процессах дыхания. Гетеротрофы могут использовать кислород при его не очень низкой концентрации в атмосфере.
Замечательно, что стационарный уровень концентрации кислорода в атмосфере соответствует количеству необратимо разложенной при фотосинтезе воды.
Следовательно, количество биогенных углеводородов (и других органических веществ), накопленных в истории развития аэробной атмосферы Земли, должно быть эквивалентно количеству кислорода в атмосфере (которое, согласно оценке, составляет 1,5-1015 т).
Нефть и другие каустобиолиты являются «зеркальными аналогами» кислорода. Нефть, уголь, торф и другие образуются в результате фоторазложения воды и накапливаются по мере увеличения концентрации кислорода в атмосфере. Отсюда следует, что, если верна теория биогенного образования кислорода атмосферы, то полное окисление всех каустобиолитов приведет к поглощению всего кислорода атмосферы. Кроме того, их полное окисление приведет к образованию воды, и уровень воды в Мировом океане может повыситься примерно на 3 м. Эти рассуждения позволяют оценить запас по всей Земле органического вещества в каустобиолитах примерно в 1 • 1015 т.
Таким образом, до накопления в атмосфере достаточного количества кислорода гетеротрофы могли получать энергию лишь в анаэробных процессах (бескислородных). Анаэробные условия сохраняются в ряде мест и после установления стационарной концентрации кислорода в атмосфере. Это объясняется все теми же диффузионными ограничениями — в толще воды, при отсутствии перемешивания концентрация кислорода быстро падает — там могут жить лишь гетеротрофы, способные к добыванию энергии в анаэробных процессах. Практически анаэробные условия легко возникают и в «толще» многоклеточных организмов. Этим объясняется странное, на первый взгляд, обстоятельство. Широкое распространение анаэробных биохимических превращений веществ и энергии на протяжении многих сотен миллионов лет после установления стационарного уровня концентрации кислорода, а странным это могло бы показаться, поскольку анаэробные превращения во много раз менее энергетически эффективны, чем аэробное окисление (дыхание). Итак, высокосовершенные анаэробные процессы деградации пищевых веществ — условие существования гетеротрофов (и фото-автотро- фов в темноте). Анаэробные биохимические процессы типа гликолиза или брожения настолько совершенны и неожиданно сложны, что почти невозможно использовать метод их дедуктивного, «умозрительного» построения. В этом случае правильнее сразу посмотреть их действительные свойства. Гликолиз и брожение — прекрасный пример предельно совершенного решения конкретной эволюционно-биохимической задачи. Энергетический и химический смысл этих процессов — выделение свободной
энергии в результате внутримолекулярных перегруппировок и расщепления исходных молекул. При гликолизе молекула глюкозы превращается в две молекулы молочной кислоты и свободная энергия системы уменьшается на 50 ккал/моль:
С.Н120. -» 2QHe03, AF° = — 50 ккал/моль.
При полном окислении глюкозы в стандартных условиях имеем:
С„Н120„ + 602 -» 6С02 + 6Н20, AF* = — 688 ккал/моль
Сущность анаэробного процесса гликолиза состоит в перегруппировке атомов. Составляя баланс разрываемых и образующихся связей, находим, что превращение состоит в образовании одной связи С=0 и одной С—Н вместо одной связи С—О, одной О—Н и одной С—С.
Изменение энтальпии при таком превращении можно оценить по таблицам энергии связей (см. например, книгу Я. К- Сыркина и М. Е. Дяткиной [279]. Результаты оценки дают, что при разрыве связей расходуется 248 ккал/моль, а при образовании новых связей выделяется 240 ккал/моль. Учитывая неточность табличных данных, можно сказать, что при гликолизе изменение энтальпии молекул АН, равное 8 ккал/моль, пренебрежимо мало. Нас, однако, интересует изменение свободной энергии. По-видимому, главной причиной энергетической выгодности превращения глюкозы в молочную кислоту являются изменения энтропии (образование двух частиц из одной), диссоциация (рН=буфер!) и сольватация образовавшихся ионов карбоксила.
Процесс брожения аналогичен гликолизу и отличается от него лишь на последних стадиях. В итоге молекула глюкозы распадается на две молекулы этилового спирта и две молекулы С02:
CeH12Oe -» 2CsH6OH + 2С02, AF0 = — 54 ккал/моль.
Существенным отличием брожения от гликолиза является улетучивание углекислого газа. С02 выходит из реакции, в результате чего происходит еще больший (чем при гликолизе) сдвиг равновесия слева направо, и «бродящие» гетеротрофы могут осуществлять такой расточительный процесс и дальше. (Это в сущности, возмутительная расточительность—при образовании спирта теряется большая часть энергии молекулы глюкозы, которую можно было бы получить при полном сжигании до С02 и Н20).
Ясно, что брожение эффективно лишь в условиях, позволяющих улетучиваться углекислому газу. Поэтому оно осуществляется лишь микроорганизмами, живущими в относительно открытых средах — в мелких водоемах, на поверхности питательных субстратов; если же сосуд закрыт, то С02 насыщает раствор, и брожение останавливается. Так происходит при изготовлении шампанского и других шипучих вин. Может показаться, что и второй продукт брожения — этиловый спирт улетучивается, и равновесие еще больше сдвигается вправо. Недаром же этиловый спирт называется по латыни spiritus vini — винный дух. Однако, как это ни удивительно, спирт, образующийся при брожении, не улетучивается из водного раствора: скорость его испарения при умеренных температурах (15—20°) только приближается (снизу) к скорости испарения воды[11]. Так достигается предельная концентрация спирта в сусле (около 16%), останавливающая жизнедеятельность дрожжей и превращающая его в сухое вино.
Второе весьма важное преимущество брожения (в тех случаях, когда оно возможно) перед гликолизом состоит в том, что молочная кислота очень сильная, а угольная — слабая. Физиологически допустимая концентрация молочной кислоты при обычных запасах рН-буферов порядка 10-2 М, предельная концентрация спирта около 2—3 М, т. е. примерно в 50 раз выше.
Следует все же отметить, что речь идет о предельной концентрации для дрожжевых клеток. В клетках животных даже очень небольшие концентрации спирта вызывают нарушение деятельности поверхностных и иных мембран. Клетки теряют способность создавать ионные градиенты, генерировать нервные импульсы и т. д. Поэтому животные не могут воспользоваться некоторыми энергетическими преимуществами брожения еще и из-за устройства мембран своих клеток. Следовательно, процесс брожения все равно остается неприемлемым для животных. Поэтому достойна всяческого осуждения привычка иных гетеротрофов сохранять образующийся при брожении спирт и потреблять в чрезмерных количествах конечный продукт анаэробного катаболизма.
Так или иначе, но эти, пусть и энергетически малоэффективные превращения углеводов виртуозно совершенны с точки зрения химика.
В их совершенстве легко убедиться, рассмотрев даже простую схему гликолиза или брожения [176] (т. е. схему, не учитывающую своеобразия кинетического поведения системы, динамики взаимной регуляции отдельных этапов и т. п.). Ясно, что осуществление таких процессов, как брожение или гликолиз, требует решения в процессе эволюции ряда сложных задач. Главная задача — обеспечение возможно быстрого, однозначного и строго последовательного превращения веществ. Строгий порядок, точное выдерживание последовательности стадий в многоэтапных превращениях достигаются посредством строгой специфичности ферментов к своим субстратам. Из множества броунирую- щих в среде молекул фермент выбирает молекулу своего субстрата. Поэтому эволюция первичных гетеротрофов в основном состояла в совершенствовании специфичности ферментов. Итак, длительное, сотни миллионов лет сохраняемое, существование
анаэробных процессов объясняется диффузионными ограничениями доставки кислорода. Одним из способов функционирования в таких условиях свободноживущих организмов, как было показано в гл. 5, является ограничение размеров клеток. Облигатные анаэробы (т. е. живущие только в анаэробных условиях) и факультативные анаэробы по-необходимости — мелкие 1— 3 мк — клетки. Поскольку в анаэробных условиях, в процессах1 гликолиза в многоклеточных организмах в особенности, лимитирующим является процесс отвода конечных продуктов. Кинетически выгодно иметь возможно большую поверхность выхода этих продуктов из клеток. Поэтому, вероятно, образование каких-либо надмолекулярных комплексов полиферментных систем для гликолиза не дает физико-химических преимуществ — гликолиз осуществляется в гомогенных растворах ферментов и субстратов. Однако до сих пор точно неизвестно, имеется ли структурная организация процессов гликолиза и брожения у ныне живущих организмов.
ПРЕВРАЩЕНИЕ ЭНЕРГИИ ПОСРЕДСТВОМ АСИММЕТРИЧНЫХ МЕМБРАН. КОНЦЕПЦИЯ МИТЧЕЛЛА
Из изложенного ясно, что степень совершенства функционирования системы преобразования термодинамического потенциала экзэргонических реакций в термодинамический потенциал макроэргических соединений становится на ранних стадиях развития жизни фактором эволюции, критерием естественного отбора.
Совершенство образования и использование макроэргических фосфатов слагается из двух компонентов: кинетического — скорости соответствующих реакций, разнообразие и концентрации необходимых ферментов и термодинамического — эффективности (КПД) сопряженного преобразования энергии.
Кинетика этих как и других биохимических процессов определяется совершенством соответствующих ферментов и величиной диффузионных ограничений.
Термодинамическая эффективность сопряженных преобразований, хотя это и кажется на первый взгляд странным, определяется реальными путями, механизмами перехода системы из одного состояния в другое. В самом деле, мы видели, что Л может быть превращено в В при полном рассеянии — превращении в тепло выделяющейся энергии. Эта энергия до тепловой деградации может быть направлена на выполнение какой-либо работы! Таким образом, качество использования термодинамического потенциала, КПД его преобразования в полезную работу- Полностью определяется (до теоретического предела) реальным ide: ханизмом преобразования энергии. Таким образом биолбгиче* ская эволюция должна быть направлена на выработку предельно совершенных механизмов сопряженного образования и-иёпользО- вание макроэргических фосфатов. ...v.. ..v.zi:
т
Рассмотрим «а-приорные» свойства таких механизмов.
В сущности сам переход от накопления энергии в простых буферных емкостях к биохимии макроэргических соединений был решающим шагом к такому совершенству. Он, как мы видим, состоял в векторизации потока энергии от безадресного изменения pH к точно направленному переносу термодинамического потенциала к строго определенным молекулам и процессам посредством молекул АТФ.
От чего зависит эффективность сопряженного синтеза АТФ?
Вероятно, более всего эффективность сопряжения зависит от соответствия квантов энергии, поступающей в систему синтеза АТФ и порций энергии, необходимых для синтеза одной макро- эргической связи. В самом деле, при фотохимическом сопряжении кванты света относительно очень велики 100—40 ккал/моль, а для синтеза ~Р связей нужно около 10 ккал/моль. Следовательно, фотохимическое «одноактное» сопряжение не может быть эффективным. Такая же картина наблюдается при фосфорилиро- вании, сопряженном с поглощением кислорода и окислением, например, водорода. Эта реакция «гремучего газа» сопровождается выделением 55 ккал/моль образующейся воды. Общеизвестен выход из этого затруднения, найденный в ходе эволюции— Замена одноэтапных превращений — многоэтапными, в которых энергия выделяется относительно небольшими порциями. В результате процесс окисления водорода органических молекул до воды осуществляется посредством последовательной цепи «транспорта электронов» — системы окислительно-восстановительных переносчиков. Теперь возникает новая сложная задача — обеспечения синтеза АТФ сопряженно с окислительно-восстановитель- ными переходами разных переносчиков. Кроме того, создание системы переносчиков с идеальными перепадами термодинамического (окислительно-восстановительного) потенциала очень сложно — эффективность энергетических преобразований может быть низкой. Как мы видели, синтез АТФ из АДФ и Н3Р04 при нормальных pH сопровождается образованием ОН- — защела- чиванием среды.
АДФ»~ + HPOJ- -> АТФ4- + ОН-.
Процесс синтеза АТФ может быть продуктивным лишь при сопряженной нейтрализации образующихся ионов гидроксила в реакции нейтрализации: он- + н+^н2о,
Эта реакция экзэргонична. Величина АР ее вполне приемлема (~20 ккал/моль) для энергетического сопряжения с синтезом макроэргических фосфатов (AF0'~ 10 ккал/моль).
Мы видели, однако, что в реальных буферных системах с рК близким к рКг фосфатных групп нельзя обеспечить сопряженное изменение свободной энергии более чем на 3—5 ккал/моль.
MEMИРАНА Окзэргоннческие процессы (фотосинтез, дыхание), создающие градиент рН(
ПРАВАЯ СТОРОНА
ЛЕВАЯ СТОРОНА
-ч
АДФ
+
н3ро,
II
АТФ
ГТ20
I \
НО ^ И + он"
Нт + ОН
: Н,0
ОН - \ •
РИС. 14. Схема синтеза АТФ в асимметричной мембране за счет энергии градиента pH, создаваемого в процессах фотосинтеза, дыхания и т. д. в соответствии с концепцией П. Митчелла Из активного центра Н+— АТФ-азы, локализованной в асимметричной мембране, ио- иы Н+ могут диффундировать только направо; ионы ОН- только налево. Неиони- зоваиные молекулы АДФ, АТФ, Н3РО4 растворяются в гидрофобной зоне мембраны. Синтез АТФ в этих условиях из АДФ и НэР04 происходит почти изоэнергетически. В целом процесс осуществляется за счет изменеиня свободной энергии при образовании двух молекул воды: слева при нейтрализации иона ОН- в кислой среде, справа — иона Н+ в щелочной среде
Выход из этого, непреодолимого для биохимических реакций в гомогенных растворах затруднения, состоит в механизме, предложенном П. Митчеллом [426—428]. Сущность этого механизма состоит в проведении синтеза АТФ посредством асимметричной мембраны, обеспечивающей при синтезе каждой молекулы АТФ расход вместо одного иона Н+ — двух, что приводит к большему сдвигу равновесия в сторону синтеза и, соответственно к большей эффективности сопряжения.
Представим себе асимметричную фосфолипопротеидную мембрану, по разные стороны которой существенно различна концентрация ионов водорода (рис. 14). Пусть например, слева от мембраны раствор имеет рН=4, а справа рН = 8. Слева в растворе имеются АДФ и ортофосфат. В кислой среде они в заметной концентрации будут находиться в недиссоциированном, незаряженном состоянии. В таком виде АДФ и Н3Р04 легко растворяются в мембране и попадают в гидрофобный активный центр АТФ-синтетазы. Так, в гидрофобном окружении АТФ не макро- эргична, и мы примем, что синтез ее из АДФ и H3POt идет изо- энергетично (ДР^О).
АДФ + Н8Р04 ^ АТФ + Н20.
Мембрана асимметрична — из активного центра образовавшаяся АТФ может диффундировать только обратно, налево. Образовавшаяся вода из активного центра может диффундировать лишьпосле диссоциации — налево ионы ОН- (левая сторона мембраны, омываемая кислым раствором с избытком Н+ ионов заряжена положительно), направо — ионы Н+ (правая сторона мембраны, омываемая щелочным раствором с избытком ОН" ионов заряжена отрицательно). Н+ и ОН- из образовавшейся в активном центре АТФ — синтетазы воды вступают, соответственно слева и справа в две реакции нейтрализации. Запишем теперь весь прочесе:
й шаг НР042-+АДФ3- + 5Н+^Н3Р04+АДФ
й шаг Н3Р04+АДФ->в мембрану
й шаг Н3Р04+АДФ^АТФ + Н20 в мембране
й шаг в мембране АТФ->АТФ4~-)-4Н+ в среду слева
в мембране Н20->-Н+ в среду направо \
ОН- в среду налево
й шаг слева ОН_ + Н+ ^Н20
справа Н+ + 0Н-^Н20
Сравним теперь процессы синтеза АТФ в гомогенном буферном растворе и в асимметричной мембране при наличии градиента pH:
в растворе: НР042_ +АДФ3 + Н+^АТФ4~ + Н20;
в мембране: НР042-+АДФ3++2Н++0Н^АТФ4-+2Н20. Видно, что в механизме Митчелла за счет асимметричного распределения Н+, т. е. градиента pH, синтез АТФ сопрягается с образованием вместо одной двух молекул воды, тем самым достигается существенный сдвиг реакции в сторону синтеза АТФ.
В самом общем виде смысл механизма Митчелла — дополнительная векторизация потока энергии, обеспечиваемая строго ориентированной переносом веществ соответственно пространственному градиенту pH.
Таким образом, к рассмотренным ранее аспектам кинетических достоинств структурной организации биохимических процессов (гл. 5, с. 87) следует добавить увеличение термодинамической эффективности преобразования энергий. Синтез АТФ в соответствии с механизмом Митчелла, посредством специальной структурной организации осуществляется с высокой эффективностью, поскольку он сопрягается с двумя относительно «низкопотенциальными» реакциями — нейтрализацией 2Н+ за счет 20Н~ при относительно малых перепадах pH.
В асимметричную мембрану могут быть встроены переносчики электронов, пигменты, ферменты-синтетазы. Энергия света, поглощаемого пигментами (фотосинтез), или энергия, выделяющаяся при транспорте электронов от водорода субстратов к кислороду (дыхание), тратится в соответствии с механизмом Митчелла на создание градиента концентрации ионов водорода (или других ионов), что проявляется в возникновении разности pH (или электрических зарядов) по обе стороны мембраны.
Синтез АТФ сопрягается не с отдельными разнообразными
реакциями, а с одной и той же на всех этапах реакцией нейтрализации— образовании воды из ионов водорода и гидроксила. Это сопряжение катализируется универсальным ферментом: мембранной Н+АТФ-азой [271]. Разность электрического потенциала, создаваемая градиентом концентрации отличных от Н+ и ОН-, катионов и анионов, например, К+ и С1~ легко преобразуются в разность концентраций Н+ и ОН-:
К+ СГ ^к+он- СГН+
Н20 Н20 ^ н+ ОН-.
Накопление энергии в виде градиента концентраций «иных» катионов и анионов может быть очень удобным ввиду больших запасов этих ионов в протоплазме. Энергетическая эквивалентность градиентов концентраций ионов водорода и гидроксила и разных катионов и анионов создает особо совершенную кинетику включения и выключения сопряженного фосфорилирования— градиенты электрических зарядов в отличие от градиентов концентраций— относится к дальнодействующим — это особенно существенно при трансмембранной передаче энергии — диффузия через мембрану процесс относительно медленный. Диэлектрическая постоянная гидрофобной мембраны мала — соответственно велика напряженность трансмембранного электрического поля и высокоэффективна трансмембранная передача энергии электростатических взаимодействий. Электростатический механизм накопления свободной энергии экзэргонических реакций в силу дальнодействия градиентов электрических зарядов позволяет сопрягающей мембране функционировать как единое целое, эффективно используется все, в том числе весьма малые сами по себе вклады в создание разности электрохимического потенциала по обе стороны мембраны.
Верность термодинамической схемы, т. е. самого общего механизма, предложенной П. Митчеллом в 1961 г. неоднократно иллюстрировалась экспериментально. Одной из наиболее ярких иллюстраций является опыт Ягендорфа и Урайба, осуществивших в 1966 г. синтез АТФ в изолированных хлоропластах за счет искусственно созданного градиента pH [404]. С тех пор число экспериментальных работ, подтверждающих концепцию Митчелла, значительно увеличилось. Замечательным примером осуществления фосфорилирования за счет энергии света, преобразуемой в энергию градиента pH, являются процессы в пурпурных, солелюбивых бактериях [374]. В мембранах этих клеток содержится зрительный пигмент — родопсин. Поглощаемая им световая энергия используется для работы «протонного насоса», создающего градиент pH. АХ'Ф синтезируется за счет этого градиента. Большой вклад в выяснение общих механизмов сопряженного фосфорилирования и особенно идущего при посредстве асимметричных мембран внесен В. П. Скулачевым и его сотрудниками, [266—271]. (См. также [360, 360а, 415,418,419,463,470]).
Глава 8
ПРОБЛЕМЫ МОРФОГЕНЕЗА
Диффузионные ограничения скорости биосинтезов — предел биохимического этапа эволюции.
Их преодоление посредством формирования все более совершенной морфологии живых организмов и (или) посредством аппаратов активного перемещения в пространстве.
Отсутствие необходимости в предположении об особом морфогенном поле.
Достаточность кодирования на всех уровнях сложности синтеза определенных молекул и времени их синтеза (временная организация).
Цветковые растения — пример морфологического совершенства.
Первый макроэтап биологической эволюции завершается при образовании предельно совершенной системы матричного воспроизведения, предельно совершенных катализаторов системы преобразования энергии и механизмов отграничения дискретных организмов от внешней среды.
С некоторого времени скорость все более совершенных процессов биосинтеза начинает лимитировать диффузия (см. гл. 5, с. 81).
Некоторый эволюционный потенциал, т. е. возможность увеличения кинетического совершенства, содержится в ускорении диффузии посредством создания более резких градиентов концентрации. Эту возможность мы уже рассматривали. Она реализуется при образовании структурно-организованных ансамблей ферментов, например, в митохондриях и хлоропластах. Однако таким способом, посредством «игры на градиенте», достигается скорее экономия материалов, чем макроскопический выигрыш в суммарной скорости процессов. Поэтому показателем дальнейшего прогресса становится скорость диффузии, скорость потока метаболитов, превращаемых в вещество данного вида. Прогресс можно теперь измерять в см/сек. «Диффузионный барьер» не может быть преодолен чисто химическим путем. Дальнейшее совершенствование биохимических механизмов (катализа, маршрутов реакций) оказывается бесполезным.
Ясно, что суммарный поток можно увеличить, увеличивая поверхность, через которую осуществляется диффузия. Предметом отбора становится форма организма, его геометрические характеристики. Наименее выгодной формой организма данной массы является шар, так как его поверхность минимальна, наиболее выгодной — нить. Следовательно, первый шаг эволюции в направлении морфологического прогресса должен состоять в выработке механизмов построения нитевидных организмов вместо шарообразных. Эта задача уже довольно сложна. Ведь нить не может быть длинной — из-за медленности диффузии нарушатся связи между ее частями. По-видимому, пределом совершенства в данном эволюционном направлении является многолучевой еж, организм типа известных из зоологии беспозвоночных солнечников. Но такая сферически симметричная многолучевая морфология предельно совершенна лишь в отсутствие градиентов пищевых веществ и энергии. Равномерно питательная во всех направлениях среда окружает лишь планктонные организмы (и то, если пренебречь, например, градиентами света). В большинстве же случаев существует строгая направленность потоков пищи и энергии, что приводит к более сложным морфологическим задачам. Их можно решить путем выработки геометрических структур типа ветвей, стволов, листьев. Этот путь, путь морфологического прогресса для преодоления диффузионных ограничений, привел к возникновению сложной и рациональной геометрии растений (деревьев, трав) и животных, ведущих прикрепленный образ жизни (кораллы, актинии).
Совершенно ясно, что морфологические задачи возникают в дальнейшем и в связи с другими эволюционными проблемами. Однако именно вследствие необходимости преодоления диффузионных ограничений должны выработаться все основные морфогенные механизмы. Понятно, что естественный отбор наиболее совершенных геометрических форм организмов может осуществляться лишь при наследственном закреплении сведений о наиболее удачных морфологических конструкциях. Следовательно, в матричных текстах должны быть записаны не только сведения о строении (свойствах) ферментов, структурных белков, биодетергентов и т. д., но и инструкции для построения данных морфологических, геометрических конструкций, форм. Способ кодирования все тот же — посредством определенной последовательности нуклеотидов в полинуклеотидной цепи. Проблема перевода нуклеотидного текста в пространственное взаиморасположение частей организма, его морфологию—центральная проблема современной биологии. Однако прежде чем перейти к этой увлекательной проблеме, нужно все же сказать, что морфологический прогресс — не единственный способ преодоления диффузионных ограничений. И даже не лучший. Значительно большим эволюционным потенциалом характеризуется совершенствование путем создания аппаратов активного перемещения в пространстве. Этим направлением мы займемся в следующей главе, а сейчас продолжим рассмотрение проблем морфогенеза *.




ФИС. 15. Гигантские одноклеточные водоросли [163]
a— Caulerpa prolifera; 6 — Botridium granulatum; в — Acetobularia medi- terrianea (/) и A. wettsteini (2) и вегетативный гибрид (1+2) — регенерация стебля (}), посаженного на ризонд (2). Видно, что форма зонта определяется ядром, находящимся в основании ризонда
Когда говорят о морфологии организмов, невольно возникает образ многоклеточного организма сложной формы. В многоклеточном организме морфология обусловлена главным образом пространственным расположением клеток друг около друга.
Однако некоторые вопросы преобразования наследственной информации в морфологические особенности можно сформулировать уже для одноклеточных организмов и даже для неклеточных— вирусов и фагов. В самом деле, многие одноклеточные организмы имеют весьма сложную морфологию. На рис. 15 изображены гигантские (для клеток) одноклеточные (точнее, неклеточные) водоросли каулерпа, ботридиум и ацетабулярия, на рис. 16 — сложнейшие из одноклеточных животных — инфузории разных родов и жгутиконосцы, замечательные своей уникальной морфологией. Уникальная и очень сложная морфология свойственна и отдельным органеллам одноклеточных животных, (рис. 17), а также изученным Н. К. Кольцовым сперматозоидам насекомых, пауков и ракообразных (рис. 18). О сложности морфологии вирусов и фагов можно судить по рис. 19.
Таким образом основные механизмы морфогенеза, вероятно,, в наиболее чистом виде можно надеяться выявить уже для одноклеточных и даже неклеточных форм жизни.
Морфологические структуры могут возникать в результате самосборки из соответствующих макромолекул. В последние годы было выполнено очень много исследований по самосборке биологических структур (см. [303]). Правда, основные данные были получены при изучении самосборки вирусов и их частей («деталей»), Большой обзор интересных сведений приведен в книге Б. Ф. Поглазова [237]).
Попробуем опять подойти к этому вопросу на основании общих эволюционных положений. Речь идет, следовательно, об отборе в процессе эволюции молекул, агрегация которых автоматически приводила бы к построению все более биологически целесообразных структур. Наиболее естественно было бы выбрать с этой целью белки-—вариация их аминокислотного состава и последовательности аминокислот заведомо обеспечивает любое необходимое разнообразие свойств молекул. Свойства молекул, синтезируемых нематричным путем (например, липидов или полисахаридов), могут варьировать в процессе эволюции лишь посредством значительно более громоздких механизмов. Для синтеза любой новой молекулы типа моносахарида или фосфолипида необходимо большое число строго специфичных ферментов. Таким образом, кажется вероятным, что когда потребовалось не просто отграничить клетку от внешней среды, но придать ей уникальную форму, для ее построения понадобились специальные структурные белки. Мысль эта находит подтверждение во всех случаях биоморфогенеза. Определяющая роль белков в морфогенезе на молекулярном уровне была выяснена в замечательных исследованиях самосборки вирусов ([см. 237]). Начало было положено при изучении вируса табачной мозаики (ВТМ). Этот вирус состоит из РНК (около 5% по весу) и белка. Частица ВТМ распадается на составные части под влиянием различных воздействий: разбавленной щелочи, концентрирован-
- В
РИС. 16. Одноклеточные — инфузории, жгутиконосцы, радиолярии а — Euplotes patella (инфузория); б — Poludlnium mysozeum (инфузория из кишечника слона); в —скелет Cycladopora pantheon (радиолярия); г — Heteronema spirale (жгутиконосец, эвглеиовые); д — Ceratium longlpes (жгутиконосец, перидиниевые); е — Gonyaulax polyedra (жгутиконосец, перидиниевые); а, б, в заимствованы из книги [921, остальные — ■из книги [163]


РИС. 17. Стрекательная капсула одноклеточного организма-споровика Nasema
Капсула имеет двойную оболочку и ввернутую в капсулу полную нить. Выстреливание обусловлено быстрым развертыванием нити
РИС. 18. Спермий длиннохвостого рака Galathea squamifera [144]
РИС. 19. Иллюстрация сложной морфологии вирусов и фагов [237]
а—модель строения вируса табачной мо-

мой уксусной кислоты, мочевины, додецилсульфата и других агентов. При защелачивании среды до pH 10,5 происходит дезагрегация белковой оболочки ВТМ на небольшие субчастицы — А-белки. При подкислении щелочного раствора А-белка начинается упорядоченная агрегация, самосборка — образуются длинные палочкообразные структуры, внешне не отличающиеся от ВТМ. Чрезвычайное волнение вызвало в 1955 г. сообщение Френ- кель-Конрата о самосборке, реконструкции целого инфекционного вируса при агрегации А-белка в присутствии РНК, выделенной из ВТМ. Это было первое искусственное воссоздание (почти создание) живого организма. (Вирусы вполне подходят иод определение живого организма — объект биологической эволюции, находящийся или способный находиться в процессе био- .логической эволюции. А то, что вирусы в ходе эволюции обленились и разучились самостоятельно добывать, готовить, переваривать и использовать пищу — просто характеризует их очень ллохо...) И это воссоздание осуществилось посредством самосборки. Строение ВТМ показано на рис. 19, а. Видно, что самосборка структурных элементов может происходить и при не очень •сложных белковых субчастицах, субъединицах — они должны иметь специфические контакты, определяющие их соединение как друг с другом по спирали, так и с РНК. Успех искусственного осуществления самосборки ВТМ вызвал интенсивные исследования этого процесса на других вирусах. Было установлено, что в результате самосборки из белковых молекул образуются большей частью или полые цилиндры, или плоские мембраны, способные образовывать замкнутые сферы. Большие успехи были достигнуты при изучении самосборки мембраны малых сферических вирусов (237, с. 29], в частности, вирусов, вызывающих рост незлокачественной опухоли папилломы. Крик и Уотсон предположили в 1956 г., что из идентичных белковых молекул (морфологических единиц) могут возникать плоские мембраны, полые сферы, эллипсоиды, полые цилиндры (трубы) и их комбинации. Каспар и Клуг подтвердили их предположение посредством геометрического анализа (см. [237]).
Характер автоматически возникающей структуры зависит в основном от числа контактов, которые способны осуществлять имеющиеся в системе морфологические единицы. Число таких контактных точек в них в свою очередь зависит от числа образующих их белковых субъединиц.
Так, морфологические единицы, имеющие по шесть контактных точек и состоящие из шести субъединиц, образуют плоскую однослойную мембрану (рис. 20, а). Для образования из такой мембраны замкнутой поверхности многогранника она должна быть перегнута во многих местах. Образующиеся ребра делят поверхность на серию треугольников. Для этого наряду с шестиконтактными морфологическими единицами в системе должны находиться и пятиконтактные, состоящие из пяти субъединиц

РИС. 20. Модели, иллюстрирующие принципы самосборки надмолекулярных структур [237]
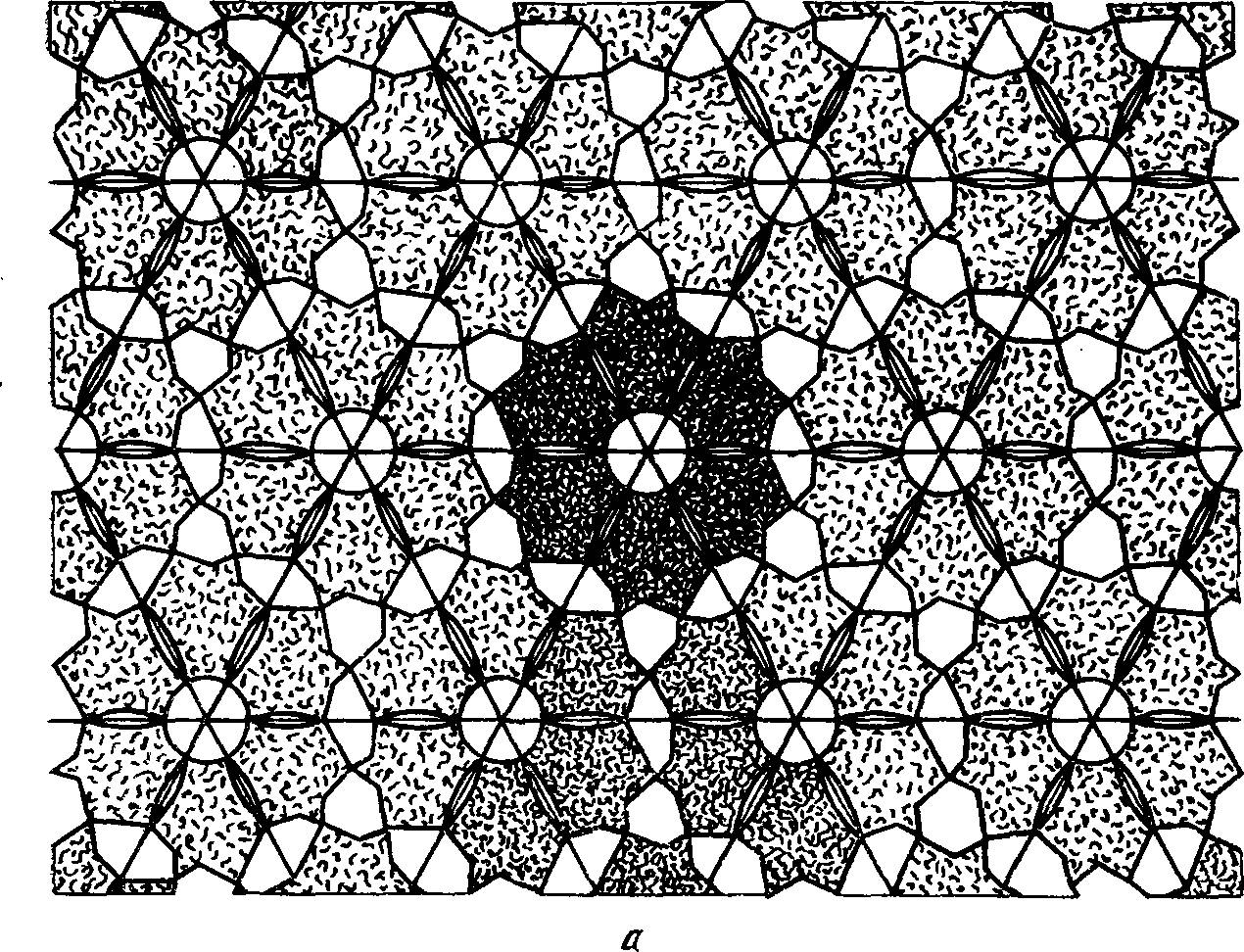
а — шестиконтактиые морфологические единицы, образуют плоские мембраны (одиа из единиц зачернена; б — пятикоитактные морфологические единицы (одиа из иих зачернена) образуют вершниы в ограненных мембранах
(см. рис. 20, б). Пятиконтактные морфологические единицы встраиваются в вершины многогранников, не нарушая непрерывной упаковки [237]. Наименьший многогранник состоит лишь из двенадцати пятиконтактных морфологических единиц. Различные сочетания пяти- и шестиконтактных морфологических единиц обеспечивают решение сложных морфологических задач.
Модель вируса папилломы, предложенная Финчем и Клугом (см. [237]), представляет собой икосаэдр из 72 морфологических единиц, образованных 420 субъединицами первого порядка. Если морфологические единицы образованы не только шестью п пятью субъединицами молекул белка, но и меньшим их числом, то при участии в построении надмолекулярных структур и неассоциированных субъединиц первого порядка мо^ут автомати- чески возникать разнообразные геометрические формы — трубы, эллипсоиды, икосаэдры (см. рис. 20). Еще более сложные морфологические структуры получаются при самосборке отдельных блоков Т-четных фагов (см. рис. 19, б). Самосборка этих фагов определяется большим числом генов — синтез белковых субъединиц контролируется 17 генами, около 30 генов регулируют самосборку образующихся белковых субъединиц и отдельных блоков фага [237].
Для наших целей совершенная экскурсия в область изучения самосборки вирусов достаточна. Мы видим, что морфология вирусов является следствием структуры, морфологии специфических белковых молекул. Теперь нужно попробовать выяснить, могут ли по тому же принципу строиться значительно более крупные образования типа клеток инфузорий, сперматозоидов или водорослей?
Интересующий нас вопрос можно сформулировать и иначе: является ли морфология клеток прямым следствием морфологии молекул белков? В таком виде этот вопрос эквивалентен вопросу о возможности многократного увеличения молекул с сохранением их морфологических особенностей. Подобная возможность кажется сомнительной. Форма и морфологические особенности зерен серебра никак не связаны с формой фотографического изображения. Ситуация с клеткой, ее морфологией и формой белковых макромолекул представляется сходной. Диаметр субъединицы белка порядка 10 А, диаметр клетки порядка 10 мк, т. е. их диаметры различаются на 4 порядка. (В фотографии диаметр зерна серебра тоже отличается от линейного размера детали изображения на 4 порядка.) Однако мы не удивляемся тому, что форма даже гигантских монокристаллов является следствием прямого увеличения элементарной кристаллической ячейки атомарно-молекулярных размеров. Но теперь взглянем на рисунки, на которых изображены инфузории, неклеточные гигантские водоросли— вошерия, ацетабулярия, ботридиум и др. (см. рис. 15, 20) уж очень их морфология отличается от морфологии кристалла. Очень уж эта морфология «неправильна» и «причудли-за». Однако на примере вирусов мы видели, что в зависимости •от строения морфологических единиц, а, следовательно, от набора не очень разнообразных субъединиц, автоматически образуются разные достаточно сложные морфологические структуры — полые сферы, эллипсоиды, трубки. Поэтому, если последовательность появления (биосинтеза) тех или иных субъединиц заложена в генетической программе, то можно представить себе последовательность образования очень сложных морфологических структур непосредственно из макромолекул белка.
Следовательно, морфология клетки и ее частей может быть .записана в нуклеотидном коде в виде текстов (генов), определяющих синтез в необходимой последовательности полипептид- лых цепей с определенной последовательностью аминокислот. Естественно, мы говорим сейчас лишь о принципиальной возможности такого механизма морфогенеза клетки. Весьма привлекателен и другой принцип морфогенеза на этом уровне. В самом деле, мы по существу рассматривали следующую модель. Набор разных кубиков разной формы с липкими гранями насыпают в ящик и какое-то время трясут (тепловое движение); кубики слипаются так, чтобы суммарная свободная поверхность, смазанная .клеем, была минимальной, т. е. образуется сложная морфологическая структура (эта модель была реализована Ферстером [303]. Затем в ящик добавляют кубики другой формы и снова трясут— прежняя морфологическая структура достраивается, превращаясь в структуру нового типа, и т. д. В этом случае реализуются структурные особенности морфологических единиц и их субъединиц, причем их реализация происходит при стохастическом взаимодействии структурных единиц.
Никаких кинетических особенностей, никакой кинетической организации пространства нам не требовалось. Дело в том, что кинетические особенности вполне могут приводить к пространственным геометрическим эффектам. Это обязывает нас поставить вопрос — не используются ли в биологических морфоген- яых процессах и кинетические механизмы? А если нет, то почему эволюция прошла мимо столь замечательных явлений?
По-видимому, первым изученным примером кинетического образования структуры были кольца Лизеганга. Они представляют собой правильные периодические структуры, возникающие при образовании осадка в результате реакции равномерно распределенного вещества с другим реагентом, диффундирующим в зону реакции. Кольца Лизеганга легко получить, если пропитать желатиновый слой фотопластинки хроматом калия, а затем капнуть на него раствор азотнокислого серебра. По-видимому, для образования кристаллического осадка хромата серебра необходимо наличие затравки, появляющейся лишь при некоторой пороговой концентрации хромата калия. Поэтому при диффузии ионов серебра через область, обедненную (в результате предыдущего осаждения и диффузии) хроматом калия, осадок не образуется. При достижении некоторого критического соотношения ионов серебра и хромата лавинообразно развивается процесс кристаллизации, с избытком ионов серебра реагируют ионы хромата из прилежащих областей (последние обедняются этим анионом). И вновь, при продолжающейся диффузии серебра в этих обедненных зонах не появляется осадок. Так образуются концентрические кольца — пустые кольца чередуются с кольцами осадка хромата серебра. Получение колец Лизеганга произвело большое впечатление на минералогов — концентрические структуры в яшме, малахите и т. п. стали рассматриваться как результат сочетания процессов диффузии и осаждения в период образования этих минералов. Позже, особенно после открытия (методом электронной микроскопии) тонкой структуры миелино- вого волокна с его концентрическими слоями миелина [417], стали высказываться мнения о возможном участии механизмов, аналогичных рассмотренным выше, и в образовании морфологических структур в биологических системах (например, структуры миели- нового волокна). Но мне кажется это очень сомнительным — нельзя «доверять» сферически симметричной диффузии тонкую морфологическую работу. Кроме того давно и точно установлено, что концентрическая структура миелинового волокна возникает при многократном наворачивании тонких блиноподобных клеток на аксон.
Одним из наиболее интересных примеров кинетического механизма организации пространства является возникновение пространственных структур в процессе распространения химической колебательной реакции. Такие реакции были капитально исследованы в нашей лаборатории [101, 102]. При реакциях, изученных А. М. Жаботинским и А. Н. Заикиным, образуются подчас весьма сложные узоры, обусловленные распределением в пространстве окисленных и восстановленных форм соответствующих катализаторов. Таким образом возможны кинетические по происхождению структуры, кинетическая организация пространства. Пространственные характеристики определяются в данном случае кинетическими параметрами — скоростями реакций, соотношением положительных (активация) и отрицательных (угнетение) обратных связей в реакционной цепи. Следовательно, пространственная организация структуры легко поддается регулированию. А это именно то, что совсем не нужно в морфологии (вернее, обычно не нужно). Морфология должна быть достаточно консервативной, инвариантной относительно не сильных модификаций условий ее возникновения. Мне кажется, что кинетический морфогенез не мог устроить эволюцию.
До сих пор мы говорили о морфологических (морфогенных) процессах на уровне клетки. Наиболее сложны, вероятно, проблемы морфогенеза многоклеточных организмов.
Многоклеточные организмы возникают из одной клетки — ?иготы. Морфология на этом уровне определяется взаимным рас
положением и взаимодействием клеток в пространстве. Значит, и в данном случае должен существовать однозначный механизм перевода нуклеотидного текста в план, чертеж постройки из клеток. В самом деле, что определяет соединение клеток друг с другом в строго определенных положениях? Можно представить себе несколько ответов на этот вопрос. Проще всего предположить аналогию в механизме образования морфологических структур из клеток и из макромолекул. Геометрия построек из клеток может определяться геометрией клеток — числом возможных контактов каждой клетки и ориентировкой контактных участков, их расположением на «шкуре» клетки. Как мы видели, сочетание гексамерных и пентамерных морфологических единиц приводит к возникновению разнообразных структур. Гексамерные, шестиконтактные клетки должны образовывать плоские структуры, двухконтактные — нити.
Другим возможным способом морфогенеза мог бы быть такой процесс дробления яйца (или любой клетки на поздней стадии морфогенеза), при котором взаимное расположение клеток определяется направлением митотического веретена и тем самым границы, разделяющей дочерние клетки. Последовательная переориентация митотического веретена в последовательных актах клеточного деления могла бы приводить к образованию любых сложных морфологических структур (такая возможность казалась особенно привлекательной А. Г. Гурвичу (76]). Однако указание на такой способ морфогенеза лишь видоизменяет задачу— все равно нужно выяснить причины той или иной ориентации митотического веретена при очередном делении клеток. Но самое •сильное возражение против подобного механизма, как я думаю, состоит в том, что морфология многоклеточных образований не определяется процессом размножения клеток. Это следует из замечательных опытов по реагрегации клеток после дезагрегации органов и тканей (и даже организмов)!
Такие исследования начались на губках. В начале нашего века было обнаружено, что если нарушить связи между клетками, «слегка помяв» кусок губки в морской воде, то происходит мацерация, и свободные клетки начинают плавать в морской воде. Однако очень быстро наступает реагрегация клеток — они собираются и вновь восстанавливается исходная типичная для тубок структура [215]. Аналогичный процесс реагрегации можно наблюдать при мацерации печени или почек эмбриона мыши или цыпленка. Реагрегация почки с ее сложной морфологией особенно впечатляюща — клетки разных типов располагаются в нужных местах, образуя характерные морфологические структуры. Следовательно, в этих случаях взаимное расположение клеток не •определяется ориентацией митотического веретена. В процессе реагрегации клетки активно перемещаются друг около друга, а их мембраны совершают волнообразные движения. Как только жлетки оказываются в «правильном» положения, их движенияи колебания резко прекращаются; такая реакция остановки является существенным элементом формообразования в многоклеточных постройках [47, 190, 191]. Вполне возможно, что клетки останавливаются тогда, когда совпадают их контактные участки. Отличие самосборки макромолекул в надмолекулярные структуры от самосборки многоклеточных построек, быть может, и состоит лишь в способе перемешивания — в первом случае мы имеем стохастическое тепловое движение, а во втором — целенаправленное или случайное активное перемещение клеток. А геометрия построек в обоих случаях определяется геометрией морфологических единиц — макромолекулярных комплексов или; целых клеток.
Так может быть все уже ясно? И можно допустить, что считывание генетических текстов — записей инструкций о морфологии многоклеточных организмов-—происходит посредством возникновения в нужной последовательности во времени клеток, необходимой формы с нужным числом контактов на поверхности? Но в ряде случаев клетки образуют структуры без непосредственных контактов и находятся друг около друга на расстоянии около 200 А. Промежуток же между клетками заполнен колла- геновыми волокнами или иными контактными веществами. Это- первое затруднение. Второе заключается в том, что при формообразовательных процессах в эмбриогенезе наблюдается перестройка структур; например, превращение бластулы в гаструлу происходит посредством изменения взаимного расположения уже образовавшихся ранее клеток, а именно, клетки некоторой зоны, (полюса) сферической бластулы вдавливаются, инвагинируются и образуют гаструлу. Трудно (трудно, но все же можно) представить себе детерминированное изменение морфологии клетки,, такое изменение числа контактных участков, ори котором из- сферы автоматически образовалась бы двуслойная гаструла.. Третье затруднение состоит в том, что одни и те же клетки в разных условиях дают разные структуры. При пересадке клеток эмбриона они образуют структуры, как правило, соответствующие тому месту, в которое их пересадили. Данная морфологическая структура индуцируется окружающими клетками и тканями. Явление индукции — предмет многих замечательных исследований в экспериментальной эмбриологии (см. [35, 291 ^ 295а, б]). Пожалуй, наиболее ярким, убедительным примером индуцированного морфогенеза является формирование оптической системы глаза. Глаз развивается в ходе эмбриогенеза из 'двух источников: передний мозг образует вырост—глазной бокал (превращающийся впоследствии в светочувствительную' ткань — сетчатку и в зрительный нерв), который индуцирует в ближайшей прикрывающей его эктодерме развитие оптической системы глаза — хрусталика и роговицы. Глазной бокал можно пересадить в разные места зародыша [182] и в этих местах в эктодерме будет индуцироваться развитие хрусталика и роговицы. Природа агентов, вызывающих индукцию данной структуры, не ясна. Вопрос этот очень сложен. Индуцирующим действием могут, например, обладать и заведомо неспецифические повреждающие воздействия, что когда-то поразило исследователей и заставило их надолго отказаться от поисков эндогенных специфических индукторов. С сожалением должен признаться, что и в данном случае наиболее вероятна доминирующая роль химии (конечно, биохимии), а не физики; определенные вещества, вероятно, индуцируют определенные структуры, а неспецифические повреждающие агенты способствуют выработке или освобождению таких веществ. Эти специфические индукторы, по-видимому, представляют собой факторы, снимающие репрессию определенного белкового синтеза.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ