ГЛАВА IX Ди-хлор-этил-сульфид
В начале развития газовой войны господствовало убеждение, что вещество ценное, как военный газ, должно обладать большой упругостью пара. Высокое давление пара производит значительную концентрацию, достаточную для того, чтобы причинить заболевание при вдыхании насыщенного газом воздуха. Введение "горчичного газа" (ди-хлор-этил-сульфида) является величайшим и единственным открытием в газовой войне, где замечается отступление от этого первоначального представления, так как горчичный газ есть жидкость, кипящая приблизительно при 220 °C и имеющая очень низкую упругость пара. Горчичный газ, помимо большой стойкости, обладает еще особым характерным свойством, делающим его одним из наиболее ценных военных газов, известных в настоящее время. Это особое свойство состоит в способности вызывать нарывы (волдыри) на коже. Очень низкие концентрации паров его способны "ожечь" кожу и причинить заболевания, требующие от трех-недельного до трех-месячного лечения. Эти два свойства уничтожили необходимость внезапных атак и реализацию артиллерийского огня высокого напряжения. Достаточно выпустить несколько снарядов по открытому месту, чтобы причинять потери в течение многих часов и даже дней.
С химической точки зрения, горчичный газ есть ди-хлор-этил-сульфид (СlСН2CH2)2S. Название свое он получил от английских солдат вследствие того, что в естественном виде это вещество, впервые выпущенное немцами, напоминало им по запаху горчицу или чеснок. Этому соединению давались разнообразные названия, как, напр., „желтый крест", соответственно марке германских снарядов, "иперит" — название, употреблявшееся французами, так как газ был впервые применен на Ипре, "нарывной газ", — вследствие его особенного действия на кожу.
Весьма вероятно, что нечистый горчичный газ был получен Ричи в 1854 г. посредством действия хлора на сернистый этил. Он впервые описан Гутри (1860 г.), открывшим его особенное и могущественное физиологическое свойство. Интересно отметить, что Гутри изучал действие этилена на двухлористую серу и эта реакция стала основанием метода, который был окончательно избран союзниками.
Первое подробное исследование горчичного газа, известного тогда только как ди-хлор-этил-сульфид, было сделано Виктором Мейером (1886). Мейер исследовал реакцию между этилен-хлор-гидрином и сернистым натрием, при последующей обработке полученного продукта хлористо-водородной кислотой. Весь германский горчичный газ, применявшийся в 1917 и 1918 году, был, повидимому, добыт при помощи этих реакций, и вся первоначальная экспериментальная работа союзников велась в том же направлении.
Германцы использовали горчичный газ, как наступательный элемент, при Ипре 12–13 июля 1917 г. Согласно английским сведениям, физиологические свойства его были исследованы ими летом 1916 года. "Департамент Газовой Борьбы" высказывал уже тогда мысль о применении горчичного газа для химического ведения войны, но мероприятие это не было одобрено. Указанные работы дали англичанам возможность быстро и правильно установить подлинность содержимого первого полученного снаряда "желтого креста", и немецкое сообщение о том, что вещество было принято сначала за ди-этил-сульфид, неверно.
Тактическая ценность горчичного газа была сразу оценена немцами, и громадное количество его было ими использовано. Высчитано, что в продолжение 10-ти дней, осенью 1917 года, было выпущено приблизительно 1.000.000 снарядов, содержавших около 2.500 тон горчичного газа. Занетти сообщает, что в продолжении одного только месяца применение горчичного газа вызвало почти столько же случаев отравления среди англичан, сколько их было за все предыдущие годы войны, вместе взятые. Поп говорит, что действие горчичного газа, как средства борьбы, было признано настолько опустошительным, что уже ранней осенью 1917 года все технические силы британского, французского и американского правительств были мобилизованы для постановки производства этого вещества в широком заводском масштабе.
Анализ первого немецкого снаряда показал, что горчичный газ, содержавшийся в нем, был получен по способу, опубликованному Виктором Мейером (1886) и позднее использованному Кларком (1912) в Англии. Поэтому естественно, что первоначально все внимание было направлено на постановку этого способа в широких размерах.
Производство состоит из следующих операций: этилен добывается дегидратацией этилового спирта. При взаимодействии этилена и хлорноватистой кислоты HClO получается хлор-гидрин-гликол ClCH2CH2OH. Обрабатывая последний сернистым натром, переводят его в ди-гидро-окси-этил-сульфид, который, будучи нагрет с соляной кислотой, дает ди-хлор-этил-сульфид.
Химические реакции могут быть изображены следующим образом:
СН3СН2ОН = СН2: СН2 + Н2О
СН2: CH2 + НClО = НО СН2 СH2 Cl
2НО СН2 СН2 Cl + Na2S = (HО СН2 СН2)2 S + 2NaCl
(НО СH2 СН2)2S + 2НСl = (СlСН2 СН2)2S = 2Н2О
Не вдаваясь в разбор приведенных реакций, которые были в совершенстве изучены Гомбергом[11]. (см. немецкое производство), можно сказать, что этот "способ приготовления оказался неудобно-выполнимым для производства в широком масштабе" (Дорсей). По замечанию Попа, "тот факт, что немцы были в состоянии добывать ежемесячно 300 тонн горчичного газа заводским путем, применяя чисто-академический метод Мейера, делает честь немецкой химической промышленности, сумевшей довести свои фабрики до наивысшей степени совершенства". Первая часть экспериментальной работы была произведена союзниками по тому же пути, но дальнейшая разработка прекращена после открытия нового метода Попа.
Первым успехом в деле производства горчичного газа было открытие реакции этилена на двухлористую серу. В то время, как практическое выполнение этой реакции не удавалось американским химикам ни в лаборатории, ни на заводах, новый способ, согласно показанию Занетти, стал единственным, избранным французами (первыми из союзников, изготовлявшими и применявшими горчичный газ).
Завод принадлежал Society Chimique des Usines du Rhone и был открыт в начале марта 1918 года, с производством от 2–3 тонн в день. В июле ежедневная выработка его возросла до 20 тонн. Ко времени перемирия завод был расширен вдвое, почему, вероятно, в декабре 1918 года производство горчичного газа при помощи двухлористой серы достигло бы 40 тонн. Занетти отмечает, однако, что в этот процесс входили сложные и дорогие аппараты, и требовалось значительное количество четырех-хлористого углерода, как растворителя. По этой причине метод Левинстейна получил бы громадное значение, если бы война продолжалась далее.
Около конца января 1918 г. Поп и Джибсон, при изучении реакции Гутри, нашли, что действие этилена на одно-хлористую серу (S2Сl2) при 60° дает горчичный газ и серу:
2СН2: СН2 + S2Cl2 = (СН2 СlСН2)2S + S.
При указанной температуре реакция идет с выделением серы; сера выделяется либо после того, как продукт оставят стоять некоторое время, либо тотчас же, если на него действовал влажный аммиачный газ. Этот способ был поставлен фабричным путем в Англии и Америке, но с производственной точки зрения представлял значительные трудности. Сера часто выделялась и забивала трубы для впуска этилена и, хотя горчичный газ можно было сравнительно легко отделить от выделившейся серы сливанием, некоторое количество его все же пропадало. Добиться выделения горчичного газа нацело было невозможно, а присутствие его увеличивало трудность удаления серы из реакционного аппарата, так как люди, работавшие при этой операции, почти всегда отравлялись.

Рис. 29.
Реактор Левинстейна, установленный в Эджвудском Арсенале.
В виду этого особое значение получило открытие Грина, состоявшее в том, что при понижении температуры реакции до 30°, сера. не выделяется, а остается, как псевдо-раствор (Поп) или, как слабое химическое соединение моно-сульфида с атомом серы (Грин). Это вещество обладает всей физиологической активностью чистого моно-сульфида, между тем как при таком способе производства, громадные технические трудности при манипуляции с выделившейся серой совершенно устраняются. Для осуществления этой реакции Акц. Общ. Левинстейна конструктировало так называемый Левинстейновский "реактор", показанный на рисунке 29. Сущность процесса состоит в присоединении хлористый серы к очень чистому этилену с помощью неочищенного горчичного газа, как растворителя, при температуре, колеблющейся между 30–35 °C. В реагирующую жидкость непрерывно вводится хлористая сера до тех пор, пока не получится значительный ее избыток. Тогда введение хлористой серы прекращают и продолжают пропускать этилен до полного насыщения или момента окончания его поглощения. Во время хода процесса быстрота реакции может настолько увеличиться, что становится необходимым понижать температуру.
Продукт, полученный таким образом, представляет собой бледно-желтую жидкость, не выделяющую серы и не требующую дальнейшей обработки. Она совершенно пригодна для снаряжения снарядов. Очевидная простота этого метода привела к применению его на всех американских заводах, начавших производство горчичного газа (Эджвуд, Кливлэнд и Буффало).
Из работ некоторых французских химиков известно, что в присутствии каолина, как катализатора, при повышенной температуре этиловый спирт дегидрируется в этилен. Процесс, окончательно разработанный американскими химиками, состоит в введении смеси паров спирта и воды, в весовом отношении один к одному, в 8-дюймовую железную трубу, внутри которой проходит 3-дюймовая, находящаяся в соприкосновении с глиной, температура которой поддерживается около 500–600 °C. Употребление водяного пара уменьшает температурные колебания, и каждый аппарат получает способность давать большие выходы продукта и полученные при реакции газы пропускались через конденсаторы, охлаждаемые водой. Одна установка этого типа изготовляла в час 400 куб. футов газа, в котором было от 92–95 % чистого этилена, между тем как непосредственное превращение спирта в этилен давало только 85 %. Эджвудский завод имел 40 таких установок, дававших этилен в количестве, достаточном для производства 40 тонн горчичного газа в сутки. Англичане употребляли в качестве катализатора кокс, пропитанный фосфорной кислотой. Печь, построенная в Америке по этому принципу, давала в час до 2.000 куб. футов этилена от 98–99 % чистоты. Однако, употребление таких печей не нашло себе широкого применения, вследствие удовлетворительных качеств каолиновых печей.

Рис. 30.
Опытная каолиновая печь для получения этилена производительностью в 400–500 куб. фут. в час.
1. Ввускпые клапаны для каталит. раств.
2. Газ.
3. Выход этилена.
4. Заглушенный конец.
5. Виутреннаа труба.
6. Пирометр.
7. Конденсатор.
8. Трубы дла стока.
9. Крепления для труб.
10. Выход воздуха.
11. Впуск пара.
12. Манометр.
13. Отверстия дли впуска паров спирта.
14. Втулка.
15. Кольцо горелки.
16. Резервуар дла стока.
17. Вакуум манометр.
18. От насоса.
19. Калиброванный уровень.
20. Дискометр.
21. Впуск паров спирта.
22. Компрессор.
23 Бак дла спирта.
24. Аспиратор.
25. Улавливатели конденсата.
26. Манометр давления.
27. Счетчик.
28. Газгольдер.
29. Т'руба для взятия проб.
30. Регулятор.
31. Разрежающий насос.
32. Конденсационные резернуары.
33. Выход отбросов.
34. Клапан дла выхода катализатора.
35. Дно.
36. Испаритель спирта.
37. Выход отбросов.
38. Впуск спирта.
39. Паровой сифон.
40. Выход.
41. Боченок спирта.
42. Дымовая труба.
С тех пор, как при Эджвудском арсенале стали приготовлять хлор, было логично утилизировать часть его для приготовления хлористой серы. Выстроенный для этого завод имел 30 чанов (78 дюймов в диаметре и 35 футов длины), из которых каждый был рассчитан на ежедневную производительность в 20.000 фунтов хлористой серы. Чаны наполнялись серой, через которую пропускался хлор. При достаточном притоке тепла, поддерживающего серу в расплавленном состоянии, реакция протекает быстро. Если хлор вводился слишком быстро, то температура поднималась настолько высоко, что образовавшаяся хлористая сера начинала кипеть. Во избежание этого к аппаратам были проведены трубы, по которым протекала холодная вода, поддерживавшая температуру чанов в должных пределах. Для производства одной тонны горчичного газа требовалось около одной тонны хлористой серы и немного меньше полтонны (12.640 куб. футов) этилена.

Рис. 31.
Ряд печей для выработки этилена.
Приготовление этилена. Газ получался при пропускании паров спирта над окисью алюминия, при температуре от 380–400 °C. Подробности конструкции одной из печей даны на рисунках 32 и 33. Печи были очень малы, и их нужно было около 60 штук, чтобы доставить требуемое количество газа. Трубы, содержавшие катализатор, были сделаны из меди и нагревались в ванне из расплавленного азотнокислого калия. Было известно, что катализатор приготовлялся по способу Ипатьева и выдерживал от 10 до 20 дней. Полученный газ промывался обычным образом в скрубберах. Судя по сообщениям, этилена получалось около 90 % теоретического выхода.
Приготовление хлоргидрина гликоля. Реакция производилась в горизонтальном цилиндрическом котле, который был снабжен мешалкой и покрыт пробковой изоляцией во избежание нагревания внутренности котла от окружающего воздуха. В котел вводилось определенное количество хлорной извести, достаточное для получения 500 килогр. хлора, и 5 куб. метров воды. Сначала в смесь пропускали около 20 куб. метров углекислоты, потом этилен и, наконец, этилен и углекислоту одновременно. Отмечалась быстрота поглощения этилена и, когда реакция замедлялась, добавляли углекислоту. Никаких более подробных сведений по этому поводу не имеется, кроме того, что впуск газов был передан на усмотрение рабочего, наблюдающего за процессом. Реакция должна была идти при возможно низкой температуре, но имевшиеся на заводе аппаратов не давали возможности поддерживать ее ниже 5 °C. Температура во время хода производства колебалась в пределах от 5° — 10 °C. С целью поддержания ее на низком уровне, реагирующий раствор непрерывно перекачивался через змеевик, охлаждаемый холодной водой. Когда этилен более не поглощался, и в котле оставался избыток углекислоты, раствор испытывали на хлорноватистую кислоту. Для введения этилена требовалось от 2 до 3 часов.

Рис. 32.
Получение этилена на Баденской Содо-Анилиновой фабрике, 60 единиц
1. Предохранительный клапан.
2. Выход этилена.
3. Впуск охлаждающей воды.
4. Выход горячих газов.
5. Газовая труба.
6. Змеевик холодильника.
7 Этиленовая труба к скрубберу.
8. Впускная трубка.
9. Впускная трубка для паров спирта.
10. Трубка для пара.
11. Дымовая труба.
12. Выход охлажденного спирта.
13. Кирпич.
14. Выход охлаждающей воды.
15. Трубы контакта.

Pис. 33.
Получение этилена на Баденской Содо-Анилиновой фабрике. 1 элемент.
1. Предохранительная труба.
2. Газовая труба.
3. Выход горячих газов.
4. Входные трубы для паров спирта.
5. Выход этилена.
6. Медный змеевик (12 оборотов).
7. KNO3.
8. Контакт.
9. Газ.
10. KNO3.
11. Змеевик вокруг внутренней трубы.
12. Змеевик с контактным веществом у основания.

Рис. 34.
Котел для реакции хлоргидрина на Баденской Содо-Анилиновой фабрике. 16 единиц.
1. Впуск этилена.
2. Трубки.
3. Впускная трубка.
4. Контрольный сосуд.
5. Насос.
6. К змеевику и фильтру прессу.
7. Мешалки.
8. Свинцовый змеевик.
9. Впуск СО2.
10. Свинцовые трубки.
При фильтровании продукта реакции через пресс удаляли углекислый кальций. Полученный раствор содержал от 10 до 12 % хлоргидрина гликоля и, после перегонки его с водяным паром, количество хлоргидрина в дестилляте повышалось от 18 до 20 %. Выход хлоргидрина составлял от 60 до 80 % теоретического, считая на затраченный этилен.

Рис. 35.
Производство горчичного газа в Ливеркузене.
Установка для хлорирования тио-ди-гликоля.
Приготовление ди-гидро-окси-этил-сульфида. Чтобы приготовить ди-гидро-окси-атил-сульфид, к 18 или 20 % раствору хлоргидрина гликоля прибавляли теоретическое количество сернистого натра в виде безводной соли или в кристаллах. После этого смесь нагревалась до 90 — 100 °C, затем перекачивалась в выпарительный чан, где вода удалялась нацело кипячением. Полученный тио-гликоль отфильтровывался от выделившейся соли и перегонялся под уменьшенным давлением. Выход составлял около 90 % теоретического, рассчитанного на хлоргидрин.
Приготовление ди-хлор-этил-сульфида. Тио-ди-гликоль подвозился по рельсовому пути к двум большим бакам, служившим его хранилищами, и отсюда перекачивался посредством вакуум-насоса прямо в реакционный сосуд. Каждый реакционный сосуд был помещен в отдельной камере, вентилируемой как сверху так и. снизу, и снабженной стеклянными окнами для наблюдения. Сосуды были сделаны из 1¼-дюймового чугуна и выложены 10-м.м. свинцом; они имели вышину 2,5 м., диаметр 2,8 м. и были покрыты кожухом, позволявшим производить нагревание водой и паром и поддерживать реакцию при 50 °C. Газообразная соляная кислота, направляемся по главной трубе, пропускалась через серную кислоту, что давало возможность наблюдать за скоростью, и поступала затем в реакционный сосуд через 12 стеклянных трубок, каждая около 2 см. в диаметре. Скорость течения соляной кислоты поддерживалась в такой степени, чтобы произвести поглощение до максимума. Газы, выделяющиеся при реакции, выводились из сосуда по трубке в коллектор, проходили через скруббер, содержащий древесный уголь и воду, потом через сепаратор и, наконец, направлялись в вытяжную трубу. Эти выпускные газы высасывались посредством вентилятора, соединенного также с нижней частью камеры, в которой помещался реакционный сосуд, так что все газы должны были пройти через скруббер, прежде чем выйти в вытяжку. По окончании реакции масло удалялось посредством вакуум-насоса в чугунный промывной чан.
Слой водного раствора соляной кислоты из реакционных сосудов удаляли также посредством вакуума в глиняный приемник. Стеклянное окно в камере позволяло наблюдателю избегать перегонки масла с кислотой. Реакционный сосуд был снабжен термометрам как внутри, так и снаружи, у чехла. Для испытаний во время хода реакции, пробы вещества могли быть подведены насосом к гидрометру, находящемуся под стеклянным колпаком; окончательная проба должна была показывать 126° Тв. Другая порция могла быть втягиваема в пробирку, при чем становилось возможным следить за прохождением соляной кислоты. Поплавок, помещенный в стеклянную внешнюю трубку, соединенную с реакционным сосудом, служил для показания уровня жидкости. Реакционные, промывные и дестилляционные аппараты, служившие для производства горчичного газа на немецких заводах, были нормального типа и применялись уже. раньше при многих других операциях.
Промывная ванна представляла собой чугунный сосуд, выложенный свинцом, 2,5 м. в диаметре и 2 м. глубины, снабженный колпаком и мешалкой. Для введения воды и раствора соды служили свинцовые трубы; подобные же трубы были устроены для высасывания вакуум-насосами. Крышка, имевшая плоский верх, была снабжена стеклами для освещения и наблюдения, к которым, для предотвращения заболевания, был прикреплен маленький паровой змеевик. Промытое масло перекачивалось в дистилляционный куб, — чугунный сосуд, выложенный свинцом, 1,5 м. в диаметре и 2 м. глубины, снабженный нагревающими свинцовыми змеевиками и соединенный посредством спирального свинцового холодильника и приемника с вакуум-насосом. Вода отгонялась от масла при 62–70 мм. давления. Высушенное масло перекачивали в резервуар, весьма сходный по. форме с промывной ванной, в котором оно смешивалось на заводе с определенным количеством растворяющего вещества, обычно хлор-бензола или иногда четырех-хлористого, углерода. Относительное количество растворителя изменялось в зависимости от времени года, и инструкции по этому поводу доставлялись из Берлина. Готовая смесь передавалась в баки складов и в вагоны-цистерны.
Испытательный отдел "Военно-Химической службы" внимательно исследовал немецкий, французский и английский методы получения горчичного газа и избрал в конце концов процесс Левинстейна. Нижеследующая выдержка приведена из сообщения, сделанного в период организации дела в сентябре 1918 года.
Левинстейновский реакционный аппарат состоит из окруженного кожухом и выложенного свинцом сосуда или стального котла 8 футов 5 дюймов в диаметре и 14 футов вышины. Внутри его помещена свинцовая трубка (внешний диаметр 2 3/8 дюйма), согнутая в виде 5 змеевиковых колец, длиной 1.400 фут. с охлаждающей поверхностью в 1.200 кв. фут. Аппарат имеет емкость на 12 тонн.
Этилен вводится при помощи 16 свинцовых инжекторов, из которых каждый прикреплен к своему отверстию наверху крышки; трубки проходят через реакционный сосуд и оканчиваются в расстоянии 12 дюймов от его дна. Отверстия вводных трубок имеют внешний диаметр 3/16 дюйма; этилен проходит через них под давлением в 40 фунтов.
Перед началом реакции в аппарат вливается хлористая сера в таком количестве, чтобы покрыть отверстия вводных: трубок. Затем впускают этилен и, по мере развития реакции, прибавляют хлористую серу в количестве, необходимом для того, чтобы поддерживать скорость реакции на должной высоте. Через змеевики пропускается соленая холодная вода, чтобы температура не поднималась выше 35 °C.
Когда реакция окончена, пуск этилена ослабляется настолько, что только небольшое количество его пузырьков продолжает выходить из инжекторов. Полученный продукт перекачивают с помощью сифона в железный бак 8 футов в диаметре и 19 футов вышины, который снабжен железным змеевиком для охлаждения или нагревания жидкости. Выделившаяся сера скопляется на дне котла и может быть расплавлена. Бак достаточно велик, чтобы вместить 6 полных зарядов горчичного газа и серу, выделяющуюся при реакции. Всплывающий горчичный газ отводят с поверхности серы в цистерны для хранения.
На ход реакции оказывают влияние следующие условия:
При под'еме температуры свинцовых труб выше 60 °C в присутствии хлористой серы происходит медленное разложение продукта.
Присутствие железа ведет к быстрому разложению продукта при 50 °C и, возможно, даже при значительно более низкой температуре.
Чистота продукта зависит от длительности реакции. Между горчичным газом и хлористой серой всегда происходит медленная реакция, и поэтому процесс должен продолжаться не более 8-ми часов.
Чем больше серы выделится из раствора, тем лучше продукт. Температура имеет заметное действие на выделение серы. С целью совершенно удалить серу из продукта в конце реакции нередко повышают температуру с 55° до 70 °C, что, однако, может причинить закупорку сети и реакционного аппарата.
Ди-хлор-этил-сульфид (горчичный газ) есть бесцветная, маслянистая жидкость, имеющая слабый запах горчицы. Чистое вещество, как говорят, напоминает своим запахом кресс. Несмотря на характерный запах, газ может находиться в атмосфере в очень опасных количествах, не будучи обнаружен обонянием. Вопрос о том, парализует ли горчичный газ чувство обоняния, до сих пор остается открытым, — существуют мнения за и против.
Горчичный газ кипит под атмосферным давлением при 215° — 217 °C, что ясно указывает на его большую стойкость, Хотя он перегоняется при этой температуре без разложения, но он очищается лучше при перегонке под уменьшенным давлением или при перегонке с водяным паром. Перегонный куб для горчичного газа под уменьшенным давлением описан Стритером[13].
Совершенно чистый горчичный газ имеет температуру плавления 13° — 14 °C (летняя t° обычно 20° — 25 °C). Неочищенный продукт, получаемый непосредственно из реакционного аппарата, плавится при 9° — 10 °C. Для того, чтобы он оставался в снаряде жидким при зимней и летней температуре, немцы прибавляли к нему от 10 до 30 процентов хлор-бензола, позднее смесь хлор-бензола и нитро-бензола и, наконец, чистый нитро-бензол; употреблялся также четырех-хлористый углерод, как средство для предотвращения его перехода в твердое состояние. Много других смесей, как хлор-пикрин, синильная кислота, бром-ацетон и др. были испробованы, но не вошли в употребление.
Действие примесей на точку плавления горчичного газа указано в следующей таблице:
| Температура плавления смесей горчичного газа | |||
|---|---|---|---|
| % примеси | Хлор-пикрина | Хлор-бензола | Четырех-хлористого углерода |
| 0 | 13,4 °C | 13,4 °C | 13,4 °C |
| 10 | 9,8 °C | 8,4 °C | 9,8 °C |
| 20 | 6,3 °C | 6,4 °C | 6,6 °C |
| 30 | 2,6 °C | — 1,0 °C | — 3,1 °C |
Получаемый в Соединенных Штатах горчичный газ содержал в растворе от 17 до 18 процентов серы. Этот газ, заключенный в снаряд, употреблялся без прибавления какого-либо растворителя. На практике оказалось, что этот нечистый продукт причиняет значительно более острое заболевание, чем такое же количество чистого вещества, вследствие чего никакой первоначально предполагавшейся очистки более не производилось.
Удельный вес горчичного газа в жидком состоянии при 20 °C равен 1,2741. В твердом виде он имеет несколько больший удельный вес = 1,888 при 18 °C. Его давление пара при комнатной температуре очень низко: при 20 °C оно равно 0,06 м.м. ртутного столба.
Горчичный газ почти нерастворим в воде; насыщенный раствор его в воде содержит менее 0,1 %. Существуют указания на то, что был получен одно-процентный водный раствор, но при этом не был принят во внимание гидролиз. Горчичный газ свободно растворяется во всех обыкновенных органических растворителях, как-то в лигроине, спирте, эфире, хлороформе, уксусной кислоте, хлор-бензоле и т. д. В случае, если растворитель легко смешивается с водой, горчичный газ выделяется из него в виде масла.
Горчичный газ медленно разлагается при действии воды, вследствие своей незначительной растворимости. Продуктами распада являются ди-гидро-окси-этил-сульфид и соляная кислота:
(ClCH2CH2)2 + S+ 2 H2O = OH. СН2CH2)2 S + 2HCl.
Некоторые сернистые масла повышают скорость гидролиза, увеличивая, с одной стороны, скорость перехода горчичного масла в раствор, с другой, усиливая его растворимость. Щелочи также повышают степень гидролиза. Окислители разрушают горчичный газ. Эта реакция была проведена в жизнь, применением порошка хлорной извести, как средства для уничтожения горчичного газа в поле (рисунок 9)
Хлор, двухлористая сера и другие хлорирующие вещества быстро превращают горчичный газ в бездеятельное (не нарывное) вещество. Двухлористая сера являлась ценным реактивом как в лабораториях, так и на заводах для очистки горчичного газа. Этой реакцией об'ясняются также первоначально неудачные попытки приготовления горчичного газа взаимодействием этилена и двухлористой серы. Горчичный газ, вероятно, образуется при этом, но почти моментально подвергается действию хлора, благодаря избытку двухлористой серы.
Однохлористая сера не действует на горчичный газ. Хлор-амин Т и ди-хлор-амин Т (ценные терапевтические средства, примененные Дэкином и Каррелем для лечения ран) также вступают в реакцию с горчичным газом.
По этой причине они были рекомендованы для лечения ожогов от горчичного газа, но, как мы увидим далее, не имели полного успеха.
Первоначально, единственным способом обнаружения горчичного газа было чувство обоняния. Тогда концентрации, которые не могли быть уловлены на запах, считались безвредными. Позднее это оказалось неверным, и явилась необходимость изобрести более тонкие методы исследования. Опыты, произведенные для этого в поле и в лаборатории, оказались не вполне удовлетворительными, так как были направлены на открытие хлора, содержащегося наравне с прочими галоидами в большинстве военных газов. Определение хлора лампой было основано на окислении медной сетки галоидом и последующем нагревании сетки на Бунзеновской горелке. Таким путем одну часть горчичного газа можно было обнаружить в 10 миллионах частей воздуха. Другой способ, рекомендованный Военно-Химический Службой, состоял в употреблении селеновой кислоты, но и здесь можно отметить полное отсутствие специфичности, потому что, в то время, как соединения, содержащие галоиды, не действуют на селен, мышьяковые и органические мышьяковые производные дают с ним положительную реакцию и часто в более короткое время, чем горчичный газ, Говорят, что у немцев были доски, покрытые желтым составом, обладающим способностью чернеть в присутствии горчичного газа. Эти доски опускались на дно только что захваченных траншей, и, если через несколько минут они становились черными; то можно было подозревать присутствие горчичного газа. Также сообщалось, что желтая краска для головной части снаряда с горчичным газом имела тот же состав и служила для обнаружения снаряда, давшего течь. Однако, из допроса одного немецкого дезертира явствует, что доверие, возлагаемое на эти реактивы, было неосновательным и приводило иногда к несчастным случаям.

Рис. 36
Полевой прибор для обнаружения горчичного газа.
1. К резервуару с газом.
2. Гибкая металлическая газовая трубка.
3. Нормальный патрон-респиратор.
4. Отделение для маски.
5. Место для сосуда с кислотой.
6. Место для сосуда с пробой.
7. Дрексель.
8. Основание воронки, закрытое фильтром для задержания пыли и пр.
9. Вход воздуха.
Существовала также белая краска, становившаяся в присутствии горчичного газа красной, но перемена цвета не была характерна для испытуемого вещества, так как опыты, сделанные в нашей армии, показали, что и другие масла (анилин, скипидар, льняное масло) производят то же самое действие.
Отделам Военно-Химической Службы удалось составить эмалевую и масляную краску, которые были очень чувствительными реактивами на горчичный газ. Обе краски были желтого цвета и при соприкосновении с газом становились темно-красными. Перемена окраски происходила мгновенно. Эмалевая краска состояла из желтого хрома, как пигмента, смешанного с красным маслом и целулоидным лаком (раствором нитроклетчатки в амило-уксусном эфире). Один галлон эмали покрывает 946.500 кв. см. или пояски шириной в 3 см. на 12.500 7-сант. снарядах. Масляная краска состояла из 50 % сырого льняного масла и 50 % японского сиккатива, к каковой смеси добавлялась выше-описанная эмаль в требуемом количестве. При соприкосновении с жидким горчичным газом, эта краска переходит в 4 секунды в темно-малиновый цвет, с мышьяковыми производными становится пурпурной или темно-зеленой, при чем перемена цвета почти мгновенная и очень чувствительная даже к парам этих составов. Другие вещества не оказывают на окраску никакого влияния.
Однако, в поле ничто не могло сравниться с хорошо. развитым обонянием; сомнительно, чтобы какой-нибудь из указанных реактивов нашел себе в будущем широкое применение на войне.
Одним из наиболее интересных свойств горчичного газа является его физиологическое действие, которое подробно исследовалось как в отношении степени ядовитости, так и форм накожного или нарывного заболевания.
Если принять во внимание высокую точку кипения горчичного газа и малую упругость его паров, то можно прийти к заключению, что такое вещество сравнительно малоценно; как ядовитый, или отравляющий газ. Хотя, конечно, главное значение горчичного газа приписывается его нарывному действию, но все же остается несомненным, что он принадлежит к числу наших наиболее ядовитых боевых газов. Это указывает следующее сравнение с другими газами:
| Mg на литр | ||
|---|---|---|
| Мыши | Собаки | |
| Горчичный газ | 0,2 | 0,05 |
| Фосген | 0,3 | – |
| Цианисто-водородная кислота | 0,2 | 0,1 |
| Хлор-пикрин | 1,5 | 0,8 |
| Хлор | – | 3,0 |
Когда животное подвергается действию варов горчичного газа высокой концентрации, оно последовательно обнаруживает ряд симптомов, могущих быть разделенными на 2 класса.
1) Местное действие на глаза, кожу и дыхательные пути, которое выражается главным образом в виде конъюнктивита и поверхностного омертвения роговой оболочки глаза, гиперемии, отека и позднее омертвения кожи, приводящего к очень затяжным накожным ранам; прилива крови и омертвения эпителия, покрывающего трахеи и бронхи.
2) Общее действие, вследствие поглощения вещества кровью, разносящей его к разным тканям тела.
Наиболее интересным наблюдением над симптомами отравления горчичным газом является скрытый период, протекающий между моментом отравления и временем, когда какие-либо серьезные об'активные или суб'ективные действия газа становятся заметными. В этот период действие газа проявляется очень слабо, если введенная доза не была слишком значительной.
Вначале являлось очень серьезным вопросом, будет ли слепота, причиняемая горчичным газом, постоянной или временной. Позднее, когда ближе познакомились с глубиной и тяжестью причиняемых им ожогов тела, предметом удивления стало то, что слепота не остается постоянной.
Причина здесь, повидимому, механическая. Постоянное моргание век, очевидно, смывает горчичный газ с глазного яблока и удаляет его настолько, что оставшегося газа недостаточно для глубокого ожога, причиняющего долговременную слепоту.
Благодаря тому, что концентрации газа, в силу медленности его испарения, на полях сражений были весьма невелики, производимая горчичным газом смертность очень мала, приблизительно около 1 % среди американцев, пострадавших от него во время войны.
С другой стороны, если бы газ был широко и мелко рассеян большим зарядом взрывчатого вещества в снаряде, он был бы очень смертоносен. В этом случае люди принуждены были бы вдыхать мелкие частицы жидкости и таким образом поглощать в сотни раз большие количества газа, чем при вдыхании его паров. Так называемый "горчично-газовый бризантный снаряд" был изобретен немцами в самые последние месяцы войны. Сила его действия дает уверенность, что в будущем громадное количество таких снарядов войдет в употребление.
Сходство симптомов и патологических эффектов после вдыхания большого количества паров горчичного газа или впрыскивания в кровь его растворов в оливковом масле или воде, привело Маршала и его сотрудников к заключению, что при высокой концентрации газ влияет на организм через легкие. Доказательством служит выделение в моче животных, отравленных вдыханием горчичного газа, продукта его гидролиза: ди-гидро-окси-этил-сульфида. Хотя этот продукт распада не ядовит, но соляная кислота, выделяющаяся при гидролизе газа, вызывает определенные признаки отравления и может даже причинить смерть.
Исходя из этих фактов, Маршаль[14] предполагает следующий механизм действия горчичного газа:
"Ди-хлор-этил-сульфид очень медленно растворяется в воде и очень быстро в органических растворителях и жирах. Поэтому, надо 'думать, что он проникает без затруднения в клетки. Способность газа к быстрому прониканию доказана на практике его действием на кожу. Проникнув в живую клетку, он, несомненно, начинает гидролизироваться, и освобождение соляной кислоты внутри клеточки производит серьезное отравление, которое может об'яснить действие ди-хлор-этил-сульфида. Итак, суммируя механизм реакции горчичного газа, приходим к следующим выводам:
1) Газ быстро проникает в клетки, благодаря своей высокой растворимости в жирах.
2) При действии воды внутри клеточки происходит гидролиз е выделением соляной кислоты и ди-гидро-окси-этил-сульфида.
3) Соляная кислота действует разрушительно на ткани и жизнедеятельность клеточки.
Хотя соляная кислота проникает внутрь клетки с известными затруднениями и отчасти нейтрализуется щелочными жидкостями, находящимися в теле, можно ожидать, что проникновение больших количеств соляной кислоты вызовет указанные характерные симптомы отравления горчичным газом. Стимуляция дыхательного центра есть известное действие соляной кислоты; конвульсии и слюнотечение могут быть вызваны впрыскиванием ее внутрь организма; впрыскивая ее, мы имеем возможность замедлять сердечную деятельность.
Медленное действие горчичного газа может быть об'яснено образованием соединения его с какой-нибудь составной частью крови. Однако, кровь, взятая от собак, отравленных горчичным газом и проявивших типичные симптомы заболевания, впрыснутая в здоровых собак, не производила никакого действия. Кровяная сыворотка, обработанная "in vitro" с горчичным газом, состоявшая некоторое время и затем впрыснутая в собаку, не производила действия. Жидкость, образующаяся в пузырях и волдырях кожи, вследствие проникновения горчичного газа, не оказывает никаких вредоносных влияний".
При исследовании ядовитости горчичного газа на собаках было замечено, что животное может выносить беспредельно концентрацию в 0,01 mg. газа на литр. Эта доза считается начальной и сказывается с величины ядовитости в разные периоды времени. Определенное отношение между ядовитой концентрацией и временем действия яда может быть выражено общей формулой:
(с — 0,01) t = k.
где с есть концентрация, наблюдаемая в данное время t; при колебаниях t от 7,5 до 480 минут, k имеет приблизительную величину 1,7.
Кроме ядовитых свойств горчичный газ имеет большое значение вследствие своего раздражающего действия на кожу. Это видно из того, что 1/14.000.000 часть его способна вызвать коньюктивит глаз, а 1/3.000.000 или даже 1/5.000.000 часть причиняет чувствительному человеку ожог кожи при продолжительном действии яда. По Уортину раны, полученные от горчичного газа, имеют характер химических и похожи на раны, полученные от действия соляной кислоты, но гораздо большей силы. Патология этих ран внимательно исследована и подробно описана Уортином и Уеллером в их. книге "Патология Горчичного Газа". Поэтому наши рассуждения должны ограничиться лишь несколькими характерными замечаниями о нарывном действии этого вещества.
Каждый рабочий, имевший дело с горчичным газом, мог заметить, что некоторые люди имеют кожу более восприимчивую к ожогам от этого вещества, чем другие. Маршаль произвел опыты над 1.282 людьми в Эджвудском арсенале, применяя от 1 % до 0,01 % раствор горчичного газа в парафиновом масле. Маленькая капля этих растворов наносилась, на предплечье и локтевую часть руки; остававшиеся открытыми приблизительно минут на десять. Присутствие или отсутствие положительной реакции узнается по появлению или отсутствию эритемы через 24 часа после опыта. Результаты оказались следующие:
| 1% | 0,01% | % в итоге |
|---|---|---|
| Положительный | Положительный | 3,3 |
| Положительный | Отрицательный | 55,3 |
| Отрицательный | Отрицательный | 41,4 |
Опыт, произведенный над 84 неграми, дал следующие результаты:
| 1% | 0,01% | % в итоге |
|---|---|---|
| Положительный | Положительный | 0,0 |
| Положительный | Отрицательный | 15,0 |
| Отрицательный | Отрицательный | 78,0 |
| Отрицательный | Сомнительный | 7,0 |
Из вышеуказанных таблиц видно, что негры обладают гораздо менее восприимчивой кожей, нежели белые. Ни один из 84 подвергшихся испытанию негров не реагировал на 0,1 процентный раствор и, конечно, ни один не стал бы реагировать на более слабый раствор. Около 10 процентов белых людей реагируют на 0,1 % раствор, между тем, как 2–3 %, реагируют даже на 0,01 % раствор, следовательно они гораздо более чувствительны. Около 78 % негров не реагируют на однопроцентный раствор, в то время как только от 20 до 40 % белой расы способны не поддаваться этой реакции.
Один и тот же индивидуум может при различных условиях проявить различную восприимчивость, что также исследовано Маршалем.
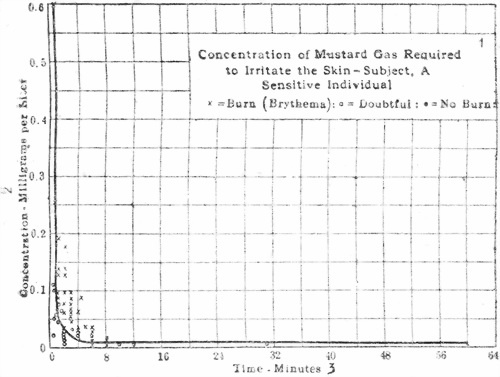
Рис. 37.
1. Концентрация горчичного газа, необходимая для кожи у восприимчивого об’екта опыта Х — ожог (бритема); Д — сомнительно; О — ожог не чувствуется.
2. Концентрация в миллиграммах на 1 литр.
3. Время в минутах.
Было испытано действие физических упражнений и выделения пота. Несколько людей получили газовые ожоги (длительность отравления от 1 до 5 минут), после чего работали до выступления обильного пота и затем снова подвергались действию газа. Во всех случаях ожоги, полученные после упражнений, были гораздо сильнее. При появлении пота, вызванного горячими ножными ваннами, замечалось также усиление восприимчивости. Влажность кожи является отчасти, если не вполне, причиной усиленной восприимчивости, что доказано следующим образом:
Небольшое место на руке было намочено на несколько минут влажной ватой, затем, после удаления ее, было сделано два опыта, один над влажным местом, другой над сухой кожей. Всегда ожог на смоченном месте был более сильным и сразу производил нарыв,
Кожа в различных частях тела, без сомнения, также разнится по восприимчивости. Все наши опыты производились на предплечьи. Кисти рук значительно менее восприимчивы, чем предплечье. Опыты, произведенные масляным методом на предплечье, груди и спине, во всяком случае, указывают на очень малую разницу в восприимчивости этих мест. Кожа по соседству со старыми ожогами оказывалась более чувствительной.
В общем, один и тот же суб'ект от повторных действий газа не становится более чувствительным к ожогам кожи. Большое количество опытов, произведенных над одними и теми же лицами в различное время и при одних и тех же условиях указывается замечательное постоянство реакции. Опыты, произведенные над рядом людей в различное время, в продолжение 4 месяцев, обнаружили слабые изменения, замечаемые от времени до времени у некоторых из них. Ни один из реагировавших первоначально только на 1 % раствор, не стал реагировать на 0,01 % и также ни один, первоначально реагировавший на 0,01 %, не перестал реагировать на 0,1 % раствор.
Восприимчивость кожи у животных. Опыт с парафиновым маслом был произведен над многими животными и показал, что разница в восприимчивости существует, как для различных видов, так равно и для отдельных индивидуумов одного и того же вида.
| Виды | Число опытов | Процент положительный | ||
|---|---|---|---|---|
| 1% | 0,1% | 0,01% | ||
| Лошадь | 1 | 100 | 100 | 100 |
| Собака | 91 | 83 | 35 | 0 |
| Коза | 11 | 55 | 36 | 0 |
| Крыса | 10 | 30 | 20 | 0 |
| Мышь | 7 | 70 | 14 | 0 |
| Кролик | 2 | 100 | 0 | 0 |
| Морская свинка | 12 | 33 | 0 | 0 |
| Обезьяна | 9 | 22 | 0 | 0 |
Лошадь оказывается наиболее чувствительной, а обезьяна и морская свинка наименее чувствительными видами, между тем как собака ближе всех других обследованных видов подходит к человеку по восприимчивости. До сих пор еще не найдено животного, получающего нарывы от действия горчичного газа.
Смис, Клаус и Маршаль[15] изучили механизм поглощения: газа кожей. Они считают совершенно ясным, что горчичный газ сначала быстро воспринимается какими-нибудь частицами на поверхности кожи и может быть удален совершенно без следа через 2 или 3 минуты, а через 10–15 минут только частично, продолжительным промыванием органическими растворителями или просто мылом и водой.
Наблюдается интересное явление, когда не подвергавшаяся отравлению здоровая кожа одного суб'екта прижимается на 5 минут к коже другого, подвергшегося действию горчичного газа. При этих условиях оба суб'екта могут получить ожоги (вследствие перемещения яда с одной кожи на другую), сила которых изменяется в соответствии с обстоятельствами и относительной чувствительностью участников.
Степень ожога здоровой кожи зависит от степени отравления принимаемой к ней больной кожи. Если два одинаковых ожога сделаны на руке чувствительного человека, и один из ожогов, так сказать, лечится контактом с здоровой кожей: менее чувствительного лица в продолжение пяти минут, то этот ожог будет значительно слабее, чем другой и может быть, в некоторых случаях, совершенно излечен. Но если получающий одинаково или в большей мере чувствителен, чем больной, сила ожога последнего уменьшится в гораздо меньшей степени. Оба опыта могут быть произведены сразу на двух воспринимающих индивидуумах, одним с большей, другим с меньшей восприимчивостью, чем тот, который передает ожог. В таком случае ожог, произведенный от соприкосновения с менее восприимчивой кожей, будет менее сильным.
Если восприимчивый суб'ект будет прижимать свою руку попеременно к ожогам одной и той же концентрации и времени экспозиции восприимчивого и невосприимчивого лица, то он получит более сильный ожог от восприимчивого человека, нежели от невосприимчивого.
Это показывает, что кожа невосприимчивых людей обладает большой ёмкостью для поглощения горчичного газа, чем кожа восприимчивого человека. Между двумя соприкасающимися кожами происходит разделение газа с очевидной тенденцией установить равновесие, при котором большая часть газа остается в той коже, которая обладает для него большой емкостью.
Попытка об'яснения этого явления может быть сделана следующим образом: "Имеется трех-фазная система: воздух над поверхностью кожи составляет внешнюю фазу, жировые и роговые элементы кожи — центральную фазу, а клетчатка кожи — внутреннюю фазу. Центральная фаза богата липоидами и бедна водой, между тем как внутренняя богата водой и бедна жирами. После действия паров ди-хлор-этил-сульфида центральная фаза является поглощающей средой, стремящейся установить равновесие с обеими другими фазами. Благодаря жиру центральной фазы, здесь не может быть причинено вреда, так как горчичный газ не гидролизирован. При переходе из центральной во внутреннюю фазу вещество гидролизуется в клеточке и производит разрушение ее при достаточной концентрации соляной кислоты. Внешняя фаза, непрерывно освобождаемая от паров токами диффузии и конвекции, может вбирать в себя все большее и большее количество вещества из центральной фазы. Восприимчивость индивидуума зависит от относительной способности центральной фазы удерживать яд в не активной форме, т. е. в не гидролизованном виде, и препятствовать его входу во внутреннюю фазу со скоростью, производящей ядовитую концентрацию. Мы не пытаемся локализировать центральную или внутреннюю фазы какой-либо определенной структурой кожи, так как известно, что горчичный газ, проникая в сальные каналы и жир, может образовывать здесь одну фазу, а в эпителии другую".
Как уже сказано, горчичный газ, подобно многим другим веществам, применявшимся в течение войны, был открыт в мирное время. Виктор Мейер (1886) вполне ясно отмечает его вредоносные качества. Материалы, служившие для изготовления горчичного газа, подобно материалам, служившим для производства фосгена и хлора, вошедшим в употребление раньше него, находились в обильном количестве в продаже, благодаря широко развитой промышленности красок или фотографической химии.
Горчичный газ, кроме сильной ядовитости, имеет так много других важных качеств, что получил за время войны название "короля газов", каковым остается до сих пор. Применение его под Ипром в ночь на 12 июля 1917 года совершенно изменило принципы газовой борьбы и внесло значительную перемену воззрений на способы ведения войны вообще. Горчичный газ в высшей степени ядовит, будучи в атом отношении одним из наиболее полезных военных газов. Он не производит моментального действия, оно довольно длительно. Он ожигает тело как внутри, так и снаружи, где только встречается влажность. Глаза, легкие и нежные части тела подвергаются немедленному отравлению. Он действует в продолжение 2-х или 3-х дней в самую теплую погоду, между тем как в холодную, сырую погоду действие его опасно в течение от недели до 10 дней, а в более холодную погоду может продолжаться целый месяц или дольше, пока погода не потеплеет настолько, чтобы способствовать испарению жидкости. В земле он разлагается настолько медленно, что делает опасным земляные работы вокруг воронок от снарядов на недели и месяцы, а возможно на год и больше.
Германцы применили его вначале просто для того, чтобы вывести людей из строя и помешать или прекратить угрожавшие им атаки британцев под Ипром. Применение горчичного газа германцами в конце 1917 г. оказалось настолько пагубным для англичан, что заставило их отложить начало наступления по крайней мере на 2 недели и помогло немцам выиграть драгоценное время, причиняя при этом серьезный ущерб врагу частичным расстройством рот, полков и дивизий в английской армии.
Германцы применяли горчичный газ в конце 1917 г. и зимой 1917 и 1918 г., как уже было сказано, для отравления врага, действия на его психику, расстройства его боевых частей и нарушения намеченных им операций. Позднее ими было разработано более научное применение горчичного газа, и при начале своих больших наступлений в марте, апреле, мае и июне 1918 г. они стали употреблять горчичный газ перед боями для нанесения потерь, расстройства частей, морального воздействия, и во время боев — для обезоружения сильных пунктов, которые они не имели желания пытаться брать приступом. Одним из наиболее выдающихся примеров может служить наступление на Армантьер в апреле, когда немцы затопили город таким количеством горчичного газа, что, как говорят, он тек по улицам. Действие газа было настолько сильно, что не только британцы принуждены были оставить город, но немцы не могли вступить в него в продолжение 2-х недель. Это во всяком случае дало им возможность взять Армантьер без больших потерь людьми. Была масса других менее разительных случаев, когда горчичный газ применялся таким же путем.
Вследствие стойкости, он вошел в употребление для целей обороны, и с этой точки зрения может считаться незаменимым. Выпуск достаточного количества горчичного газа почти наверное может остановить занятие какого-либо района противником или даже преградить переход через отравленную зону. Он дает возможность нейтрализовать сильные пункты, которые нежелательно атаковать, и сделать их негодными для пребывания в них, понуждая к их эвакуации.
В конце войны предполагалось (и будет без сомнения применено в будущем) зарывать баллоны газа в землю и взрывать их при попытках неприятеля к наступлению. Это был бы наиболее экономный способ выпуска большого количества вещества в наиболее нужный момент, в наиболее важном месте. Предполагалось даже, и это кажется вполне осуществимым, пульверизировать горчичным газом целые местности посредством гидропульта, прикрепленного к баллонам, или даже к цистернам, поставленным на тракторы.
Как раз перед перемирием германцы стали применять горчичный газ в бризантных снарядах. Вместо обычного количества взрывчатого вещества, наполняющего снаряд, и достаточного для его разрыва и вытекания заключенный в ней жидкости, они стали заполнять около 30 % всего пространства снаряда бризантным веществом. Последнее рвало гранату на мельчайшие осколки и разбрасывало большую часть жидкого горчичного газа в виде мелких брызг. Эти брызги, при вдыхании, оказывались чрезвычайно смертоносными, чего и следовало ожидать, зная, что человек может одним вдыханием набрать в легкие, в виде мелких брызг, в сотни раз большее количество вещества, чем он вдохнул бы в виде газа.
Так как горчичный газ обладает замедленным действием и производит эффект в малых концентрациях, он может с успехом употребляться в орудиях малого калибра; как 75 мм. или 3-дюймовых. Кроме того, в виду продолжительности его действия, минимум от 2-х до 3-х дней, малое количество орудий может насытить газом значительную площадь. С фосгеном и подобными ему непостоянными газами, улетучивающимися почти совершенно после взрыва снаряда, всегда необходимо немедленно реализовать высокую концентрацию, полученную стрельбой. С горчичным газом происходит как раз обратное. Он испаряется очень медленно, и можно быть уверенным, что все снаряды, выпущенные в одно время, будут беспрерывно действовать после разрыва в продолжение 12 и более часов, вплоть до выпуска следующих залпов. Таким образом, в то время как при употреблении фосгена для газовой атаки необходимо большое количество орудий, с горчичным газом количество их может быть доведено до 1/10 или даже меньше. Горчичный газ может употребляться в будущем и уже употреблялся для наполнения ручных гранат, совершенно безопасных по причине весьма малой упругости его пара при обыкновенной температуре. Это имеет важное значение при устройстве баллонов и других резервуаров, служащих для хранения горчичного газа, так как они должны быть только достаточно крепкими, чтобы быть безопасными в обращении, и не имеют надобности противостоять высокому давлению, которому подвергаются фосгеновые или хлорные баллоны.
В будущем, горчичный газ будет применяться всеми вышеуказанными способами и, без сомнения, многими другими. Он может быть выпущен в большом количестве по опорным пунктам, чтобы заставить их очистить. Он может быть рассеян на флангах атакующих армий для защиты против контр-атак. Он может быть выпущен против неприятельской артиллерии, и заставит ее замолчать и прекратить стрельбу. Американцы применяли его с этой целью в Аргонне против неприятеля на восточном берегу реки Мааса, разделявшей американскую и германскую армии. Действие его было чрезвычайно сильно и заставило замолчать неприятельскую артиллерию. Бризантные снаряды с горчичным газом, имеющим большое постоянство и быстро действующие смертоносные качества, можно выпускать по одиночке и быть уверенным, что они произведут свою работу, будь там люди или животные. Вероятно, войдет в употребление простое опрыскивание газом с аэропланов.
В будущем горчичный газ должен применяться почти всегда с некоторым количеством слезоточивого газа, в виду того, что горчичный газ, как сказано выше, не наносит немедленного вреда и не имеет резкого запаха. Соответственно с этим, в решительном бою люди будут продолжать сражаться от 4-х до 8-ми часов без масок в горчично-газовой атмосфере. Правда, несчастные случаи могут быть очень серьезными и сопровождаться большой смертностью; тем не менее в период боя артиллерия может остановить начатую атаку. Но, если во время начала испарения горчичного газа будет выпущено несколько сильных слезоточивым снарядов, то это заставит людей немедленно надеть маски. Тогда неприятель подвергнется ожигающему действию горчичного газа и будет страдать от неудобства долгого ношения масок.
Можно наверное ожидать, что последуют новые открытия в применении горчичного газа, в способах выпуска его на противника и стрельбы заключающих его снарядов.
 ТЕЛЕГРАМ
ТЕЛЕГРАМ Книжный Вестник
Книжный Вестник Поиск книг
Поиск книг Любовные романы
Любовные романы Саморазвитие
Саморазвитие Детективы
Детективы Фантастика
Фантастика Классика
Классика ВКОНТАКТЕ
ВКОНТАКТЕ